
分析我国农村妇女宫颈癌检查项目实施效果。
资料来源于全国30个省份(不包含中国香港、澳门和台湾地区数据)开展农村妇女宫颈癌检查项目县上报的2009—2018年季度统计表数据(西藏开展项目但未上报数据)。纳入35~64岁、有性生活史、具有本地区农村户籍且自愿接受筛查的女性,排除非宫颈癌或非宫颈病变原因行子宫全切除术者。分析2009—2018年宫颈癌不同初筛方法的阳性率、阴道镜异常检出率、组织病理学异常检出率、宫颈癌前病变和癌检出率、宫颈癌早期诊断比例等指标。
共有85 041 490人次适龄农村妇女接受宫颈癌免费筛查并获得最后诊断,宫颈细胞学异常率为3.71%(2 567 610例次),人乳头瘤病毒(HPV)阳性率为9.91%(331 158例次),醋酸/复方碘染色检查(VIA/VILI)阳性率为10.10%(1 167 930例次),阴道镜异常检出率为28.85%(1 420 847例次),组织病理学异常检出率为21.20%(303 068例)。2009—2018年宫颈癌前病变检出率为153.88/10万,并由2012年的106.85/10万逐年上升至2018年223.89/10万(P<0.001),且东部(207.37/10万)高于中部(177.65/10万)、中部高于西部(108.65/10万)(均P<0.001)。宫颈癌检出率为21.58/10万,由2012年的18.02/10万上升到2018年的26.54/10万(P<0.001),且中部(25.46/10万)高于东部(19.62/10万)和西部(19.30/10万)(均P<0.001)。宫颈癌早期诊断比例为91.24%(136 140例),并由2012年的89.60%(11 883例)上升到2018年的92.80%(26 962例)(P<0.001);且东部早期诊断比例(94.02%,37 600例)高于中部(91.06%,56 488例),中部高于西部(89.12%,42 052例)(均P<0.001)。
我国农村妇女宫颈癌检查项目宫颈癌前病变检出率、早期诊断比例等体现筛查技术水平的指标在东、中、西部间存在差异,间接反映服务公平性存在地区差异;中西部地区特别是西部地区仍是未来关注的重点。

宫颈癌是威胁女性生命健康的常见恶性肿瘤。根据国际癌症研究署(IARC)估计,2018年全球范围内宫颈癌新发与死亡病例在女性恶性肿瘤中均位居第4位[1]。中国肿瘤登记年报2015数据显示,全国宫颈癌的发病率与死亡率分别为16.56/10万和5.04/10万,位列女性恶性肿瘤发病与死亡的第六位和第八位[2]。开展宫颈癌筛查、发现癌前病变并给予及时规范治疗是降低宫颈癌发病率与死亡率的重要途径[3, 4, 5]。2009年起,原卫生部、财政部及全国妇联三部委联合启动了中国农村妇女“两癌”检查项目,并纳入国家重大公共卫生项目范畴,在全国范围内优先为农村地区35~64岁适龄女性提供免费宫颈癌和乳腺癌筛查。为了解十年期间全国农村妇女宫颈癌检查项目的实施效果并为完善国家宫颈癌防控政策提供数据支持,本研究采用横断面研究对2009—2018年全国农村妇女宫颈癌检查项目数据进行分析。
资料来源于全国30个省份(不包含中国香港、澳门和台湾地区数据)中开展农村妇女宫颈癌检查项目县上报的2009—2018年季度统计表数据(西藏自治区开展项目但未上报数据)。其中,2009—2011年数据来源于各省宫颈癌检查项目信息纸质报表,2012—2018年数据来自国家妇幼重大公共卫生服务项目信息直报系统,宫颈癌检查项目数据由县(区)级报送单位逐级报送至地市级、省级和国家级项目管理单位。筛查对象纳入标准:35~64岁、有性生活史、具有本地区农村户籍且自愿接受筛查的女性;排除标准:非宫颈癌或非宫颈病变原因行子宫全切除术者。
各地参照原卫生部、原国家卫生计生委、国家卫生健康委在不同时期印发的农村妇女宫颈癌检查项目相关方案[6, 7, 8](包括项目目标、范围、检查项目及标准、筛查流程等)组织开展宫颈癌筛查。
1.筛查任务:2009—2011年为1 000万适龄农村妇女开展宫颈癌筛查(其中,2009年为200万,2010和2011年分别为400万);2012—2015年每年为1 000万适龄农村妇女开展宫颈癌筛查;2016—2018年不再下达任务数,但每年筛查人数不少于上一年度。
2.项目地区:由省级卫生行政部门结合辖区的工作基础和人群健康需求等因素确定。
1.人群筛查:初筛方法主要包括细胞学检查(主要为巴氏涂片法)并采用TBS系统分类或巴氏分类对宫颈细胞进行评价,醋酸/复方碘染色检查(VIA/VILI)和人乳头瘤病毒(HPV)检测(2014年起部分农村地区采用该方法);对HPV任意高危亚型检测结果为阳性或HPV高危分型检测结果为其他高危型(非HPV16、18型)者采用宫颈细胞学检查或VIA/VILI检查进行分流。
2.阴道镜检查:对细胞学检查结果TBS分类为未明确意义的非典型鳞状上皮细胞(ASC-US)及以上者或巴氏分类ⅡB及以上者,VIA/VILI检查可疑或异常者,HPV高危分型检测结果为HPV16/18亚型者,以及分流检查阳性者进行阴道镜检查。
3.组织病理学检查:对阴道镜检查结果异常或肉眼检查有可疑病变者行组织病理学检查。
宫颈癌检查项目实施前和实施过程中,对相关专业技术人员进行规范化培训;定期对承担宫颈癌筛查工作的机构进行质量控制;信息报表设四级审核,发现错项、漏项、逻辑错误等情况及时驳回并通知报告人核对。
初筛异常指宫颈细胞学检查TBS分类报告ASC-US及以上、巴氏分级报告为ⅡB及以上、VIA/VILI检查阳性以及HPV检测阳性;阴道镜检查异常指阴道镜结果为低度病变、高度病变、可疑癌和其他异常;组织病理学检查异常指低级别鳞状上皮内病变、高级别鳞状上皮内病变、原位腺癌、微小浸润癌和浸润癌;宫颈癌前病变指高级别鳞状上皮内病变及原位腺癌;宫颈癌指微小浸润癌及浸润癌;早期诊断例数指高级别鳞状上皮内病变、原位腺癌及微小浸润癌例数之和;不同初筛方法使用比例(%)=(宫颈细胞学检查或VIA/VILI检查或 HPV检测人数)/全部初筛方法检查人数总和×100%;阴道镜异常检出率(%)=阴道镜异常检出例数/阴道镜实查人数×100%;组织病理学异常检出率(%)=组织病理学异常检出例数/组织病理学实查人数×100%;宫颈癌前病变检出率(/10万)=宫颈癌前病变检出例数/筛查人数×10万;宫颈癌检出率(/10万)=宫颈癌检出例数/筛查人数×10万;早期诊断比例(%)=早期诊断例数/宫颈癌前病变及宫颈癌例数×100%。
采用SAS 9.4软件进行数据整理和统计学分析。按照国家统计局分类标准将上报数据的30个省份划分为东、中、西部,应用χ²检验进行东、中、西部地区之间的组间比较(组间两两比较的检验水准设定为α=0.05/3=0.0167),应用Cochran-Armitage趋势检验进行相关指标的年度变化趋势分析。双侧检验,检验水准α=0.05。
2009—2018年宫颈癌检查项目以县为单位的覆盖数量由2009年的221个增至2018年的1 739个;筛查人次数由2009—2011年共计1 400余万人次上升到2012年后每年超过1 000万人次(表1);10年期间共有85 041 490人次的适龄农村妇女接受了宫颈癌免费筛查并获得最后诊断。
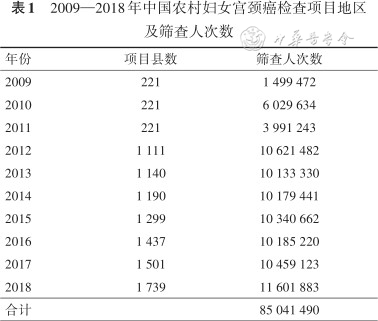
2009—2018年中国农村妇女宫颈癌检查项目地区及筛查人次数
2009—2018年中国农村妇女宫颈癌检查项目地区及筛查人次数
| 年份 | 项目县数 | 筛查人次数 |
|---|---|---|
| 2009 | 221 | 1 499 472 |
| 2010 | 221 | 6 029 634 |
| 2011 | 221 | 3 991 243 |
| 2012 | 1 111 | 10 621 482 |
| 2013 | 1 140 | 10 133 330 |
| 2014 | 1 190 | 10 179 441 |
| 2015 | 1 299 | 10 340 662 |
| 2016 | 1 437 | 10 185 220 |
| 2017 | 1 501 | 10 459 123 |
| 2018 | 1 739 | 11 601 883 |
| 合计 | 85 041 490 |
细胞学检查、VIA/VILI检查及HPV检测方法初筛人次数分别为69 227 622、11 564 641和3 342 778人次,占比分别为82.28%、13.75%及3.97%。宫颈细胞学检查使用比例由2009年的64.79%上升到2018年的87.83%(Z=1 260.69,P<0.001);VIA/VILI检查使用比例由2009年的35.21%下降到2018年的3.59%(Z=-2 206.27,P<0.001);HPV检测使用比例由2014年的4.97%上升到2018年的8.59%(Z=371.90,P<0.001)。
细胞学检查异常为2 567 610例次,异常率为3.71%;VIA/VILI检查阳性为1 167 930例次,阳性率为10.10%;HPV检测阳性为331 158例次,阳性率为9.91%。宫颈细胞学异常率在2012—2018年间保持在3.24%~3.91%,VIA/VILI检查阳性率由2009年的15.25%下降到2018年的7.60%(Z=-134.72,P<0.001);HPV阳性率由2014年的8.84%上升到2018年的11.00%(Z=47.65,P<0.001)。
2009—2018年阴道镜异常检出率为28.85%(1 420 847/4 924 148),其中2009年较高,为44.51%(59 027/132 609),之后下降到2014年的23.80%(161 626/679 006)(Z=-159.29,P<0.001);随后又由2015年的25.39%(155 445/612 293)逐年上升到2018年的33.76%(164 569/487 437)(Z=96.14,P<0.001)。2009—2018年组织病理学异常检出率为21.20%(303 068/1 429 298),2018年最高达36.87%(61 696/167 323),10年间组织病理学异常检出率呈现持续上升趋势(Z=219.28,P<0.001)。
1.宫颈癌前病变检出情况:2009—2018年全国共检出宫颈癌前病变130 864例,检出率为153.88/10万。2012年起,宫颈癌前病变检出率由106.85/10万上升到2018年的223.89/10万(Z=83.21,P<0.001)(表2)。东部检出率(207.37/10万)高于中部(177.65/10万)(χ²=524.63,P<0.001),中部高于西部(108.65/10万)(χ²=5 693.46,P<0.001)。
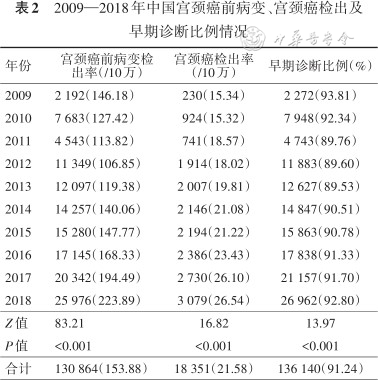
2009—2018年中国宫颈癌前病变、宫颈癌检出及早期诊断比例情况
2009—2018年中国宫颈癌前病变、宫颈癌检出及早期诊断比例情况
| 年份 | 宫颈癌前病变检出率(/10万) | 宫颈癌检出率(/10万) | 早期诊断比例(%) |
|---|---|---|---|
| 2009 | 2 192(146.18) | 230(15.34) | 2 272(93.81) |
| 2010 | 7 683(127.42) | 924(15.32) | 7 948(92.34) |
| 2011 | 4 543(113.82) | 741(18.57) | 4 743(89.76) |
| 2012 | 11 349(106.85) | 1 914(18.02) | 11 883(89.60) |
| 2013 | 12 097(119.38) | 2 007(19.81) | 12 627(89.53) |
| 2014 | 14 257(140.06) | 2 146(21.08) | 14 847(90.51) |
| 2015 | 15 280(147.77) | 2 194(21.22) | 15 863(90.78) |
| 2016 | 17 145(168.33) | 2 386(23.43) | 17 838(91.33) |
| 2017 | 20 342(194.49) | 2 730(26.10) | 21 157(91.70) |
| 2018 | 25 976(223.89) | 3 079(26.54) | 26 962(92.80) |
| Z值 | 83.21 | 16.82 | 13.97 |
| P值 | <0.001 | <0.001 | <0.001 |
| 合计 | 130 864(153.88) | 18 351(21.58) | 136 140(91.24) |
2.宫颈癌检出情况:2009—2018年全国共检出宫颈癌18 351例,检出率为21.58/10万。宫颈癌检出率由2012年的18.02/10万上升到2018年的26.54/10万(Z=16.82,P<0.001)(表2)。中部检出率(25.46/10万)高于东部(19.62/10万)(χ²=163.50,P<0.001),同时中部高于西部(19.30/10万)(χ²=287.57,P<0.001)。
3.宫颈癌早期诊断情况:2009—2018年宫颈癌早期诊断共计136 140例,宫颈癌早期诊断比例为91.24%;且由2012年的89.60%上升到2018年的92.80%(Z=13.97,P<0.001)(表2)。东部宫颈癌早期诊断比例(94.02%,37 600例)高于中部(91.06%,56 488例)(χ²=296.51,P<0.001),且中部高于西部(89.12%,42 052例)(χ²=114.38,P<0.001)。
2015—2018年,HPV检测方法的宫颈癌和癌前病变检出率为398.42/10万(11 351/2 848 979),细胞学检查方法的宫颈癌和癌前病变检出率为195.74/10万(77 781/39 737 909),HPV检测方法检出率高于细胞学检查方法,差异有统计学意义(P<0.001)。各年份不同初筛方法检出情况见表3。
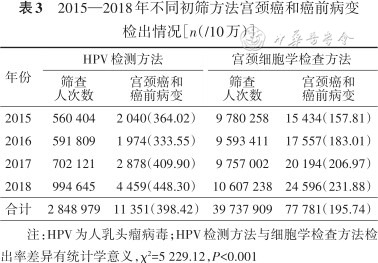
2015—2018年不同初筛方法宫颈癌和癌前病变检出情况[n(/10万)]
2015—2018年不同初筛方法宫颈癌和癌前病变检出情况[n(/10万)]
| 年份 | HPV检测方法 | 宫颈细胞学检查方法 | ||
|---|---|---|---|---|
筛查 人次数 | 宫颈癌和 癌前病变 | 筛查 人次数 | 宫颈癌和 癌前病变 | |
| 2015 | 560 404 | 2 040(364.02) | 9 780 258 | 15 434(157.81) |
| 2016 | 591 809 | 1 974(333.55) | 9 593 411 | 17 557(183.01) |
| 2017 | 702 121 | 2 878(409.90) | 9 757 002 | 20 194(206.97) |
| 2018 | 994 645 | 4 459(448.30) | 10 607 238 | 24 596(231.88) |
| 合计 | 2 848 979 | 11 351(398.42) | 39 737 909 | 77 781(195.74) |
注:HPV为人乳头瘤病毒;HPV检测方法与细胞学检查方法检出率差异有统计学意义,χ²=5 229.12,P<0.001
高质量、广覆盖、有组织的宫颈癌筛查是宫颈癌防控的一项有效措施[9, 10, 11, 12]。2020年WHO发布《加速消除宫颈癌全球战略》,提出“到2030年70%的女性在35岁和45岁各接受一次高质量宫颈癌筛查”[13]。我国农村妇女宫颈癌检查项目的实施效果受到国内外广泛关注[14],十年来筛查地区和人群覆盖面不断扩大,辐射效应明显,截至2018年底,开展宫颈癌筛查的县(区、市)数量累计达到全国总数的87%[15]。尽管如此,赵方辉等学者指出我国距离普及规律性宫颈癌筛查的目标仍有较大差距[16]。本研究2016—2018年参与筛查的农村适龄妇女仅占我国同期适龄农村妇女的26%[17, 18, 19],与Mei等[20]及包鹤龄等[21]研究中30%左右的筛查覆盖率接近,距WHO提出的70%的筛查目标[22]仍有较大差距;较低的人群筛查覆盖率不能有效降低宫颈癌发病率[2,23]。因此,需要继续推进农村妇女宫颈癌筛查,同时也应关注城市女性宫颈癌负担问题;建议将城市低保人群纳入免费筛查,加强女性职工体检和机会性筛查以进一步扩大宫颈癌的早诊早治。
我国农村妇女宫颈癌前病变检出率和早期诊断比例总体呈上升趋势,特别在2012年后,上述两指标上升趋势显著,早期诊断比例已达到质量控制和绩效考核目标(≥90%)[24, 25],说明我国农村妇女宫颈癌筛查“早发现、早诊断”效果显著。分析其原因,可能与筛查方法不断完善、筛查质量逐步提高、阴道镜检查和病理诊断水平提高有关。2017年和2018年宫颈癌前病变检出率大幅度提升,可能与各地重点加大对贫困地区投入、实现贫困地区筛查全覆盖有关。
宫颈癌前病变检出率、早期诊断比例显示出东部高于中部和西部的特点,提示我国宫颈癌防控水平、服务公平性存在地区差异。建议加强中西部特别是西部地区宫颈癌防控工作,给予更多政策和经费倾斜;同时通过建立学科联盟、开展远程医疗、应用人工智能技术等多种措施提高西部地区宫颈癌防控水平。本研究结果显示,全国宫颈细胞学异常率近年来有下降趋势,阴道镜异常检出率明显低于质量控制要求(异常检出率≥70%)[24],组织病理学异常检出率仍然较低。各环节技术指标不高的可能原因有:(1)基层细胞学人员缺乏和能力不足;(2)项目初期部分地区将阴道镜作为初筛方法以及阴道镜过度转诊;(3)阴道镜检查医生水平较低、初筛假阳性率较高或基层病理人员能力不足等。本研究结果还显示,与细胞学检查比较,HPV检测方法可检出更多的宫颈癌和癌前病变,这与HPV检测技术具有相对高的灵敏度、阴性预测值及客观性有关[26, 27];随着当前HPV检测技术的不断发展、成本逐步降低,需结合不同初筛方法的特点因地制宜调整初筛方法和筛查策略,并加强基层细胞学、阴道镜和组织病理学专业人员配置、技能培训以及筛查各环节质量控制以保障筛查效果。
本研究存在一定局限性,资料仅来源于中央和地方经费共同支持的项目县,未纳入单独由地方经费支持的项目县数据,只能反映部分农村地区的现状。资料来源于项目季度统计表,对人群覆盖情况的准确估计存在一定难度,同时无法对筛查各环节质量进行精确评估。不同地区宫颈癌细胞学和HPV检测产品并不完全相同,良莠不齐,可能对数据分析结果产生影响。
各省(自治区、直辖市)、市(地、州、盟)、县(区、市)各级卫生健康行政部门及医疗保健机构中相关工作人员在农村妇女“两癌”检查工作中的辛苦付出;国家级项目领导组成员及技术指导组专家在项目开展过程中提供的支持与帮助;赵方辉教授对文章修改给予指导与帮助,魏丽惠教授、乔友林教授、陈汶教授、王燕教授及王海俊教授等审阅文章并提出宝贵意见
所有作者均声明不存在利益冲突



























