
探讨红细胞分布宽度与血小板计数比值(RPR)与多发性骨髓瘤(MM)患者临床特征和预后的关系。
收集徐州医科大学附属医院2013年4月至2019年7月收治的137例MM患者的临床资料。通过受试者工作特征(ROC)曲线确定RPR诊断MM的最佳截断值,依据最佳截断值分为高RPR组和低RPR组,分析两组患者临床特征和预后差异。
RPR诊断MM最佳截断值为0.10,据此分为高RPR组(RPR≥0.10)和低RPR组(RPR<0.10),分别有52、85例。高RPR组与低RPR组在不同Durie-Salmon(DS)分期(χ2=17.110,P<0.01)、国际分期系统(ISS)分期(χ2=10.817,P=0.001)、红细胞分布宽度标准差(χ2=26.937,P<0.01)、血红蛋白(χ2=17.140,P<0.01)、乳酸脱氢酶(χ2=7.926,P=0.005)、红细胞沉降率(χ2=9.513,P=0.002)、β2微球蛋白(χ2=7.726,P=0.005)、骨髓浆细胞比例(χ2=6.621,P=0.010)分层中的患者比例差异均具有统计学意义。低RPR组总有效率较高RPR组高[82.4%(70/85)比71.2%(37/52)],差异无统计学意义(χ2=2.366,P=0.124)。低RPR组深度缓解率较高RPR组高[56.5%(48/85)比19.2%(10/52)],差异有统计学意义(χ2=18.327,P<0.01)。多因素分析结果显示清蛋白、RPR、治疗缓解程度是初治MM患者总生存(OS)的独立影响因素(均P<0.05)。
外周血RPR升高的MM患者OS时间缩短,RPR可能是MM预后评价的指标之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
多发性骨髓瘤(MM)是骨髓中克隆型浆细胞异常增殖导致多系统损伤的疾病,约占血液系统恶性肿瘤的10%[1]。MM常合并高钙血症、贫血、肾功能异常及多发性溶骨性损害,发病以老年人为主。我国MM发病率呈逐年上升趋势。尽管在现有治疗方法下,MM患者的无进展生存(PFS)和总生存(OS)时间得到显著延长,但仍无法治愈[2,3]。MM具有高度异质性,一些炎症标志物,如C反应蛋白(CRP)、白细胞介素6(IL-6)、红细胞分布宽度(RDW)等,对MM预后判断有重要意义[4,5,6]。红细胞分布宽度与血小板计数比值(RPR)一定程度上反映机体炎症状态[7],可体现患者的全身炎症反应状态,但其在MM中的研究鲜见报道。本研究旨在探讨RPR在初治MM患者预后评估中的价值。
纳入标准:(1)所有患者均需满足中国MM诊治指南(2020年修订)诊断标准[8];(2)初次诊断的MM患者。排除标准:(1)合并其他恶性肿瘤;(2)合并重要器官功能障碍;(3)合并严重感染;(4)既往在外院接受过任何除激素之外的抗MM治疗。根据纳入、排除标准,收集我院血液科2013年4月1日至2019年7月1日收治137例初治MM患者临床资料。本研究经我院伦理委员会批准,所有患者均签署知情同意书。
收集患者性别、年龄、分型、临床分期、RDW、血红蛋白、血小板计数(Plt)、红细胞沉降率(ESR)、乳酸脱氢酶(LDH)、清蛋白、血肌酐、血钙、β2微球蛋白(β2-MG)、骨髓浆细胞比例(BMPC)和荧光原位杂交(FISH)检查等资料。
根据病情选择不同诱导治疗方案,包括BD(硼替佐米+地塞米松)方案、PAD(硼替佐米+表柔比星+地塞米松)方案、VAD(长春地辛+表柔比星+地塞米松)方案、CTD(环磷酰胺+沙利度胺+地塞米松)方案、RD(来那度胺+地塞米松)方案,化疗后行造血干细胞移植(HSCT)13例。化疗后未移植的124例患者中接受BD或PAD方案化疗76例(含硼替佐米方案组),接受VAD或CTD或RD方案48例(不含硼替佐米方案组)。
采用住院、门诊或电话随访,随访至2020年6月1日,中位随访时间30个月(4~77个月)。总生存(OS)时间定义为确诊MM至死亡或末次随访的时间。
参照国际骨髓瘤工作组(IMWG)疗效标准,分为完全缓解(CR)、非常好的部分缓解(VGPR)、部分缓解(PR)、疾病稳定(SD)及疾病进展(PD)[9]。其中总有效率(ORR)以CR+VGPR+PR计算,深度缓解率以CR+VGPR计算。缓解程度分为有效(治疗后达CR、VGPR和PR)、无效(治疗后为SD及PD)。
采用SPSS 22.0软件进行统计分析,通过受试者工作特征(ROC)曲线确定RPR诊断MM的最佳截断值,依据最佳截断值分为高RPR组和低RPR组。计数资料的组间比较采用χ2检验;采用Kaplan-Meier法进行生存分析,并行log-rank检验。采用Cox比例风险回归模型进行单因素及多因素生存分析。P<0.05为差异有统计学意义。
137例初治MM患者中,男性76例,女性61例。中位发病年龄62岁(28~84岁),年龄≥65岁49例(35.8%),年龄<65岁88例(64.2%)。M蛋白分型中IgG型最常见(63例,46.0%),其次为IgA型(42例,30.6%)、轻链型(32例,23.4%)。Durie-Salmon(DS)分期:Ⅰ期22例(16.1%),Ⅱ期29例(21.2%),Ⅲ期86例(62.7%)。国际分期系统(ISS)分期:Ⅰ期27例(19.7%),Ⅱ期45例(32.8%),Ⅲ期65例(47.5%)。137例患者中86例进行FISH检测,p53阳性患者2例(2.3%),因检出率低,未纳入后续分析。
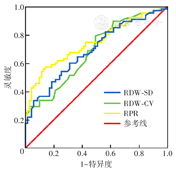
根据ROC曲线,RPR诊断MM最佳截断值为0.10[曲线下面积(AUC)0.747,灵敏度57.4%,特异度85.5%];红细胞分布宽度变异系数(RDW-CV)最佳截断值为14.15%(AUC 0.679,灵敏度79.4%,特异度49.3%);红细胞分布宽度标准差(RDW-SD)诊断MM最佳截断值为53.75 fl(AUC 0.690,灵敏度60.3%,特异度68.1%)(图1)。

137例MM患者按照RPR最佳截断值分为高RPR组(RPR≥0.10)和低RPR组(RPR<0.10),不同临床分期、RDW-SD、血红蛋白、LDH、ESR、β2-MG、BMPC分层的两组患者比例差异均具有统计学意义(均P<0.05)(表1)。
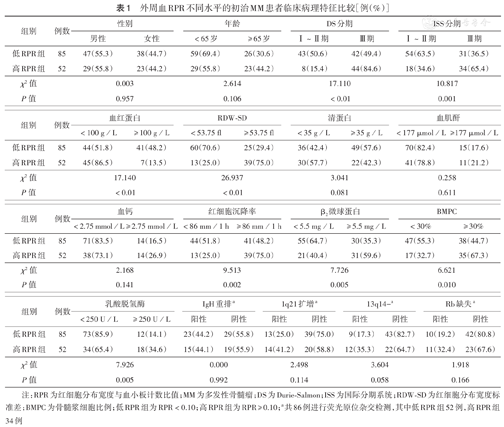
外周血RPR不同水平的初治MM患者临床病理特征比较[例(%)]
外周血RPR不同水平的初治MM患者临床病理特征比较[例(%)]
| 组别 | 例数 | 性别 | 年龄 | DS分期 | ISS分期 | ||||
|---|---|---|---|---|---|---|---|---|---|
| 男性 | 女性 | <65岁 | ≥ 65岁 | Ⅰ~Ⅱ期 | Ⅲ期 | Ⅰ~Ⅱ期 | Ⅲ期 | ||
| 低RPR组 | 85 | 47(55.3) | 38(44.7) | 59(69.4) | 26(30.6) | 43(50.6) | 42(49.4) | 54(63.5) | 31(36.5) |
| 高RPR组 | 52 | 29(55.8) | 23(44.2) | 29(55.8) | 23(44.2) | 8(15.4) | 44(84.6) | 18(34.6) | 34(65.4) |
| χ2值 | 0.003 | 2.614 | 17.110 | 10.817 | |||||
| P值 | 0.957 | 0.106 | <0.01 | 0.001 | |||||
| 组别 | 例数 | 血红蛋白 | RDW-SD | 清蛋白 | 血肌酐 | ||||
|---|---|---|---|---|---|---|---|---|---|
| <100 g/L | ≥ 100 g/L | <53.75 fl | ≥ 53.75 fl | <35 g/L | ≥ 35 g/L | <177 μmol/L | ≥177 μmol/L | ||
| 低RPR组 | 85 | 44(51.8) | 41(48.2) | 60(70.6) | 25(29.4) | 36(42.4) | 49(57.6) | 70(82.4) | 15(17.6) |
| 高RPR组 | 52 | 45(86.5) | 7(13.5) | 13(25.0) | 39(75.0) | 30(57.7) | 22(42.3) | 41(78.8) | 11(21.2) |
| χ2值 | 17.140 | 26.937 | 3.041 | 0.258 | |||||
| P值 | <0.01 | <0.01 | 0.081 | 0.611 | |||||
| 组别 | 例数 | 血钙 | 红细胞沉降率 | β2微球蛋白 | BMPC | ||||
|---|---|---|---|---|---|---|---|---|---|
| <2.75 mmol/L | ≥ 2.75 mmol/L | <86 mm/1 h | ≥ 86 mm/1 h | <5.5 mg/L | ≥ 5.5 mg/L | <30% | ≥ 30% | ||
| 低RPR组 | 85 | 71(83.5) | 14(16.5) | 44(51.8) | 41(48.2) | 55(64.7) | 30(35.3) | 47(55.3) | 38(44.7) |
| 高RPR组 | 52 | 38(73.1) | 14(26.9) | 13(25.0) | 39(75.0) | 21(40.4) | 31(59.6) | 17(32.7) | 35(67.3) |
| χ2值 | 2.168 | 9.513 | 7.726 | 6.621 | |||||
| P值 | 0.141 | 0.002 | 0.005 | 0.010 | |||||
| 组别 | 例数 | 乳酸脱氢酶 | IgH重排a | 1q21扩增a | 13q14-a | Rb缺失a | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| <250 U/L | ≥ 250 U/L | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | 阳性 | 阴性 | ||
| 低RPR组 | 85 | 73(85.9) | 12(14.1) | 23(44.2) | 29(55.8) | 13(25.0) | 39(75.0) | 9(17.3) | 43(82.7) | 10(19.2) | 42(80.8) |
| 高RPR组 | 52 | 34(65.4) | 18(34.6) | 15(44.1) | 19(55.9) | 14(41.2) | 20(58.8) | 12(35.3) | 22(64.7) | 11(32.4) | 23(67.6) |
| χ2值 | 7.926 | 0.000 | 2.498 | 3.604 | 1.918 | ||||||
| P值 | 0.005 | 0.992 | 0.114 | 0.058 | 0.166 | ||||||
注:RPR为红细胞分布宽度与血小板计数比值;MM为多发性骨髓瘤;DS为Durie-Salmon;ISS为国际分期系统;RDW-SD为红细胞分布宽度标准差;BMPC为骨髓浆细胞比例;低RPR组为RPR<0.10;高RPR组为RPR≥0.10;a共86例进行荧光原位杂交检测,其中低RPR组52例,高RPR组34例
137例患者均接受化疗,化疗3~6个周期进行疗效评估。低RPR组、高RPR组CR率分别为20.0%(17/85)、3.8%(2/52),VGPR率分别为36.5%(31/85)、15.4%(8/52),PR率分别为25.9%(22/85)、51.9%(27/52),(SD+PD)率分别为17.6%(15/85)、28.8%(15/52)。低RPR组ORR较高RPR组高,但差异无统计学意义[82.4%(70/85)比71.2%(37/52),χ2=2.366,P=0.124]。低RPR组深度缓解率较高RPR组高,差异有统计学意义[56.5%(48/85)比19.2%(10/52),χ2=18.327,P<0.01]。
化疗后未移植的124例患者,包括低RPR组75例(含硼替佐米方案组47例,不含硼替佐米方案组28例),高RPR组49例(含硼替佐米方案组29例,不含硼替佐米方案组20例),疗效分析见表2。低RPR患者中,含硼替佐米方案组ORR及深度缓解率均高于不含硼替佐米方案组,差异均有统计学意义[ORR:87.2%(41/47)比67.9%(19/28),χ2=4.118, P=0.042;深度缓解率:66.0%(31/47)比39.3%(11/28),χ2=5.066,P=0.024]。高RPR患者中,含硼替佐米方案组和不含硼替佐米方案组OR、深度缓解率比较差异均无统计学意义[ORR:75.9%(22/29)比65.0%(13/20),χ2=0.684,P=0.305;深度缓解率:20.7%(6/29)比15.0%(3/20),χ2=0.256,P=0.720]。采用含硼替佐米方案化疗的患者中,低RPR组深度缓解率优于高RPR组(χ2=14.71,P<0.01),而ORR比较差异无统计学意义(χ2=1.636,P=0.204)。采用不含硼替佐米方案化疗的患者中,低RPR组和高RPR组ORR及深度缓解率比较差异均无统计学意义(χ2=0.043,P=0.836;χ2=3.331,P=0.108)。
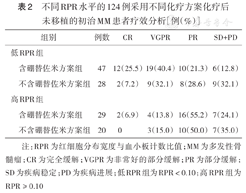
不同RPR水平的124例采用不同化疗方案化疗后未移植的初治MM患者疗效分析[例(%)]
不同RPR水平的124例采用不同化疗方案化疗后未移植的初治MM患者疗效分析[例(%)]
| 组别 | 例数 | CR | VGPR | PR | SD+PD | |
|---|---|---|---|---|---|---|
| 低RPR组 | ||||||
| 含硼替佐米方案组 | 47 | 12(25.5) | 19(40.4) | 10(21.3) | 6(12.8) | |
| 不含硼替佐米方案组 | 28 | 2(7.2) | 9(32.1) | 8(28.6) | 9(32.1) | |
| 高RPR组 | ||||||
| 含硼替佐米方案组 | 29 | 2(6.9) | 4(13.8) | 16(55.2) | 7(24.1) | |
| 不含硼替佐米方案组 | 20 | 0 | 3(15.0) | 10(50.0) | 7(35.0) | |
注:RPR为红细胞分布宽度与血小板计数比值;MM为多发性骨髓瘤;CR为完全缓解;VGPR为非常好的部分缓解;PR为部分缓解;SD为疾病稳定;PD为疾病进展;低RPR组为RPR<0.10;高RPR组为RPR≥0.10
至随访截止日期68例患者生存。高RPR组中位OS时间32个月,低RPR组为67个月。高RPR组OS低于低RPR组,差异有统计学意义(P<0.05)(图2)。
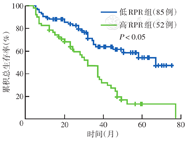

注:RPR为红细胞分布宽度与血小板计数比值;低RPR组为RPR<0.10;高RPR组为RPR≥0.10
单因素分析结果显示RPR≥0.10、年龄≥65岁、DS分期Ⅲ期、ISS分期Ⅲ期、血红蛋白<100 g/L,清蛋白<35 g/L、ESR≥86 mm/1 h、RDW-SD≥53.75 fl、β2-MG≥5.5 mg/L及无效缓解是初治MM患者OS不良因素(P<0.05)。多因素分析结果显示清蛋白<35 g/L、RPR≥0.10、无效缓解是初治MM患者OS的独立预后不良因素(P<0.05)(表3)。
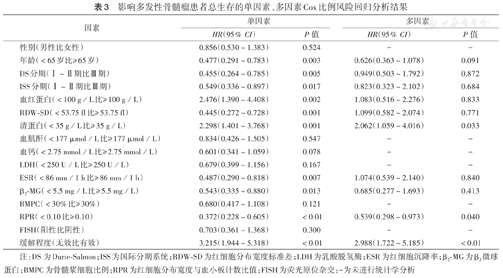
影响多发性骨髓瘤患者总生存的单因素、多因素Cox比例风险回归分析结果
影响多发性骨髓瘤患者总生存的单因素、多因素Cox比例风险回归分析结果
| 因素 | 单因素 | 多因素 | ||
|---|---|---|---|---|
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 性别(男性比女性) | 0.856(0.530~1.383) | 0.524 | - | - |
| 年龄(<65岁比≥ 65岁) | 0.477(0.291~0.783) | 0.003 | 0.626(0.363~1.078) | 0.091 |
| DS分期(Ⅰ~Ⅱ期比Ⅲ期) | 0.455(0.264~0.785) | 0.005 | 0.949(0.503~1.792) | 0.872 |
| ISS分期(Ⅰ~Ⅱ期比Ⅲ期) | 0.549(0.336~0.897) | 0.017 | 0.823(0.323~2.102) | 0.684 |
| 血红蛋白(<100 g/L比≥ 100 g/L) | 2.476(1.390~4.408) | 0.002 | 1.083(0.516~2.276) | 0.833 |
| RDW-SD(<53.75 fl比≥ 53.75 fl) | 0.445(0.272~0.728) | 0.001 | 1.099(0.582~2.074) | 0.771 |
| 清蛋白(<35 g/L比≥ 35 g/L) | 2.298(1.401~3.768) | 0.001 | 2.062(1.059~4.016) | 0.033 |
| 血肌酐(<177 μmol/L比≥ 177 μmol/L) | 0.834(0.426~1.505) | 0.547 | - | - |
| 血钙(<2.75 mmol/L比≥ 2.75 mmol/L) | 0.601(0.341~1.059) | 0.078 | - | - |
| LDH(<250 U/L比≥ 250 U/L) | 0.679(0.399~1.156) | 0.167 | - | - |
| ESR(<86 mm/1 h比≥ 86 mm/1 h) | 0.487(0.290~0.818) | 0.007 | 1.074(0.539~2.140) | 0.840 |
| β2-MG(<5.5 mg/L比≥ 5.5 mg/L) | 0.543(0.335~0.880) | 0.013 | 0.685(0.277~1.693) | 0.413 |
| BMPC(<30%比≥ 30%) | 0.680(0.417~1.108) | 0.121 | - | - |
| RPR(<0.10比≥ 0.10) | 0.372(0.228~0.605) | <0.01 | 0.539(0.298~0.973) | 0.040 |
| FISH(阳性比阴性) | 0.703(0.361~1.368) | 0.300 | - | - |
| 缓解程度(无效比有效) | 3.215(1.944~5.318) | <0.01 | 2.988(1.722~5.185) | <0.01 |
注:DS为Durie-Salmon;ISS为国际分期系统;RDW-SD为红细胞分布宽度标准差;LDH为乳酸脱氢酶;ESR为红细胞沉降率;β2-MG为β2微球蛋白;BMPC为骨髓浆细胞比例;RPR为红细胞分布宽度与血小板计数比值;FISH为荧光原位杂交;-为未进行统计学分析
慢性炎症与肿瘤之间联系密切。慢性炎症可以促进癌症的发展,肿瘤诱导的炎症会产生"雪球"效应,使肿瘤持续发展。癌细胞能表达一些细胞因子募集中性粒细胞和巨噬细胞,释放炎症分子,呈现放大效应。肿瘤细胞通过损伤正常组织,释放损伤相关分子模式,启动炎症修复机制,因此炎症反应可促进肿瘤进展[10]。
MM是来源于终末分化B淋巴细胞的恶性肿瘤。以患者骨髓中大量浆细胞的克隆性增生为显著特征[11]。MM是与骨髓微环境相关的恶性肿瘤之一[12]。炎症标志物已被确认与MM患者的预后相关,如淋巴细胞与单核细胞比值(LMR)与MM的不良预后相关。Dosani等[13]发现LMR降低的MM患者PFS和OS时间均较短,且大多携带del(17p)或t(4;14),认为LMR可作为判断预后的免疫生物标志物。
RDW是反映红细胞体积大小的指标,可反映红细胞体积的不均一程度,既往多被用于贫血的鉴别诊断。目前RDW被认为是炎症性疾病的预后因素,与肺癌、乳腺癌、淋巴瘤、骨髓瘤等肿瘤性疾病相关[14,15,16]。炎症通过干扰红细胞膜引起红细胞成熟的变化,导致RDW增加[17]。Lee等[18]首次发现高RDW的MM患者肿瘤负荷指标高,认为RDW升高可能与MM预后相关。低RDW组MM患者较高RDW组PFS、OS时间更长[19,20,21]。血小板是止血和血栓形成的关键因素,血小板可以通过与癌细胞之间的各种联系促进肿瘤的发生和转移。癌细胞和血小板维持着复杂的双向交流[22]。血小板对肿瘤患者预后具有重要意义。Plt减少在初诊MM患者中并不多见,Plt反映浆细胞浸润骨髓的严重程度。有研究证明,Plt降低的MM患者生存时间缩短[23]。
Chen等[24]提出用于预测乙型肝炎患者肝硬化和肝纤维化程度的新型无创复合参数RPR,将RDW与Plt综合起来,能够较准确地评估慢性乙型肝炎肝纤维化程度。RPR可有效反映患者炎症状态及其进展情况。有研究发现RPR与急性重症胰腺炎发病及严重程度相关,并且是心肌梗死患者短期和长期心血管风险事件的独立危险因素[25,26]。Takeuchi等[27]应用RPR进行恶性肿瘤预后评估,在299例乳腺癌患者中发现RPR升高与年龄和人类表皮生长因子受体2(HER2)状态相关,是影响乳腺癌预后的独立危险因素。有研究指出MM中RPR与D-二聚体及β2-MG呈正相关,与白蛋白球蛋白比值(A/G)和平均血小板体积呈负相关,认为RPR可同时反映炎症及出凝血状态,对MM临床分期及诊治有重要意义,但RPR对MM预后价值的评估尚鲜有研究。本研究结果显示RPR≥0.10是MM患者的独立危险因素。初诊时高RPR组MM患者其肿瘤负荷指标高,DS及ISS分期危险分层高,化疗后缓解程度较差,提示高水平RPR患者临床预后较差。与低RPR组MM患者相比,高RPR组患者OS时间短。本研究结果表明,治疗前外周血RPR是MM的一个独立预后因素,可能是一项能够反映MM预后状况的指标,临床简便易测;且RPR在预测MM预后的AUC为0.747(灵敏度为57.4%,特异度为85.5%),较RDW-CV、RDW-SD准确性高,联合其他预后指标可更准确地判断MM患者预后情况。
综上所述,外周血RPR作为一种用于评估疾病严重程度及预后评价的新炎症指标,对MM患者预后评估有一定的探索价值,有望成为指导个体化治疗、评估MM患者生存的预测因子。但本研究尚无法排除MM患者合并贫血性疾病及输血等继发混杂因素引起的RDW升高,使研究结果存在一定的偏差;本研究样本量较少,治疗方案不统一及细胞遗传学数据资料部分缺失,因而仍需大样本前瞻性研究。
所有作者均声明不存在利益冲突



























