
通过分析支气管肺发育不良(bronchopulmonary dysplasia,BPD)早产儿在纠正年龄0~6月龄的肺功能结果及临床特征,探讨BPD早产儿在婴儿期的肺功能变化特点。
回顾性研究2015年12月至2017年12月在汕头大学医学院第一附属医院新生儿科住院的85例患儿资料,其中患BPD早产儿25例(BPD组),未患BPD早产儿30例(早产儿对照组),无呼吸系统疾病足月儿30例(足月儿对照组),早产儿在纠正年龄37~41周、6月龄,足月儿在生后3 d~1周、6月龄时检测潮气呼吸肺功能,并随访6月龄内呼吸系统疾病情况。
(1)肺功能:早产儿在纠正年龄37~41周、足月儿在出生3 d~1周比较,BPD组达峰时间比(TPTEF/TE)和达峰容积比(VPTEF/VE)均低于早产儿对照组和足月儿对照组,差异均有统计学意义(均P<0.05),早产儿对照组与足月儿对照组比较差异无统计学意义(均P>0.05);BPD组和早产儿对照组的达峰容积(VPTEF)、呼气峰流量(PEF)、75%潮气量时呼气流量(TEF75%)、TEF50%、TEF25%均低于足月儿对照组(均P<0.05),BPD组与早产儿对照组比较差异无统计学意义(均P>0.05)。纠正年龄6月龄时,BPD组患儿TPTEF/TE、VPTEF/VE、呼气中期流量与吸气中期流量比值(TEF50%/TIF50%)比纠正年龄37~41周时降低,VPTEF、PEF、TEF75%、TEF50%、TEF25%比纠正年龄37~41周时升高,差异均有统计学意义(均P<0.05)。(2)呼吸系统疾病情况:BPD组纠正年龄6月龄内发生下呼吸道感染(43.3%,10/23)、喘息(21.7%,5/23)、再次住院率(39.1%,9/23)与早产儿对照组[16.7%(4/24)、8.3%(2/24)、16.7%(4/24)]相比差异无统计学意义(均P>0.05)。
BPD患儿在纠正年龄37~41周时存在小气道阻塞,并且可能持续至纠正年龄6月龄时无缓解。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
支气管肺发育不良(bronchopulmonary dysplasia,BPD)是发生于早产儿的一种严重慢性肺部疾病,其具有独特的临床表现、影像学及组织学特征。20世纪60年代首次报道经典型BPD[1],由于产前糖皮质激素、外源性肺表面活性物质及保护性通气策略等的应用,典型的严重BPD发生率减少,新型BPD病理改变以简单化的肺泡结构及肺微血管发育不良为主要特征[2]。我国一项统计数据显示早产儿的BPD发病率为1.26%,胎龄<28周早产儿BPD发病率近20%[3]。而BPD患儿远期可能存在不同程度呼吸系统后遗症,如肺功能异常、哮喘、成年期慢性肺疾病等[4]。尽管对BPD的研究日益深入,但迄今仍缺乏对其有效治疗和逆转的手段[5],近些年强调预防的重要性。肺功能检测是评估呼吸功能的重要方法,目前国内研究多是对不同程度BPD患儿以及与未患BPD早产儿进行肺功能比较,缺乏与足月儿对比及自身远期肺功能对比。本文通过对BPD早产儿0~6月龄肺功能情况随访跟踪,总结BPD对早产儿婴儿期肺功能的影响。
2015年12月至2017年12月在汕头大学医学院第一附属医院新生儿科住院患儿,征得家长同意并签署知情同意书。患BPD早产儿25例(BPD组),其中轻度21例,中度3例,重度1例。选取早产儿30例(早产儿对照组),无呼吸道疾病足月儿30例(足月儿对照组)。
排除标准:严重血流动力学改变的先天性心脏病、严重上呼吸道梗阻、咽喉部先天性畸形、先天性膈疝、开放性胸部伤口、癫痫发作、颜面部畸形、活动性肺出血等。
BPD诊断标准:采用美国国立儿童健康与人类发育研究院(National Institute of Child Health and Human Development)的BPD诊断标准[6]:出生后任何氧依赖[吸入氧浓度(FiO2)>0.21]超过28 d。胎龄<32周根据纠正年龄36周或出院时需氧疗,胎龄≥32周根据生后56 d或出院时FiO2进行分度:(1)轻度:未用氧;(2)中度:FiO2<0.30;(3)重度:FiO2≥0.30和(或)持续正压通气或机械通气。
(1)一般情况:胎龄、性别、母亲妊娠合并症、出生史(分娩方式、出生体重、复苏情况等)、氧疗情况、住院并发症、住院时间、肺功能检查时体重和身长。(2)随访:电话或门诊随访:纠正年龄6月龄内下呼吸道感染、喘息和再次住院次数。
(1)时间:早产儿在纠正年龄37~41周,足月儿在生后3 d~1周行第1次肺功能检查。早产儿在纠正年龄6月龄,足月儿在6月龄行第2次肺功能检查。所有患儿均病情稳定,吸空气下能建立良好的自主呼吸、经皮血氧饱和度维持在90%以上。(2)检查方法:参照2016年我国儿童肺功能系列指南中潮气呼吸肺功能章节[7]和2008年欧洲呼吸学会与美国胸科学会制定的婴幼儿肺功能检测指南[8]。(3)肺功能指标:达峰时间比(time to peak tidal expiratory flow as a proportion of expiratory time,TPTEF/TE)、达峰容积比(volume to peak tidal expiratory flow as a proportion of exhaled volume,VPTEF/VE)、达峰时间(time to peak tidal expiratory flow,TPTEF)、达峰容积(volume to peak tidal expiratory flow,VPTEF)、公斤体重潮气量(tidal volume per kilogram,TV/kg)、吸气时间与呼气时间比值(the ratio of inspiratory time and expiratory time,Ti/Te)、呼气峰流量(peak expiratory flow,PEF)、75%潮气量时呼气流量(TEF75%)、50%潮气量时呼气流量(TEF50%)、25%潮气量时呼气流量(TEF25%)、呼气中期流量与吸气中期流量比值(TEF50%/TIF50%)。
采用SPSS 24.0软件分析处理,计数资料以例数(%)表示,比较采用卡方检验。计量资料以均数±标准差(Mean±SD)表示,3组患儿肺功能指标比较采用方差分析,各组在不同年龄段肺功能指标比较采用配对t检验。P<0.05为差异有统计学意义。
3组患儿出生体重、胎龄比较差异有统计学意义(均P<0.05),BPD组出生体重和胎龄最低,早产儿对照组次之,足月儿对照组最高。第1次肺功能检测时,BPD组和早产儿对照组的身长、体重均明显小于足月儿对照组,差异均有统计学意义(均P<0.05),BPD组和早产儿对照组体重差异无统计学意义(P>0.05),见表1。
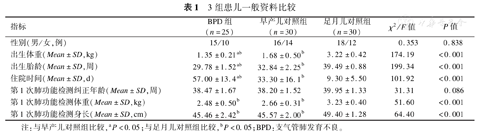
3组患儿一般资料比较
3组患儿一般资料比较
| 指标 | BPD组(n=25) | 早产儿对照组(n=30) | 足月儿对照组(n=30) | χ2/F值 | P值 |
|---|---|---|---|---|---|
| 性别(男/女,例) | 15/10 | 16/14 | 18/12 | 0.353 | 0.838 |
| 出生体重(Mean±SD,kg) | 1.35±0.21ab | 1.68±0.50b | 3.22±0.42 | 174.19 | <0.001 |
| 出生胎龄(Mean±SD,周) | 29.78±1.52ab | 32.84±2.25b | 39.49±0.88 | 199.34 | <0.001 |
| 住院时间(Mean±SD,d) | 57.00±13.4ab | 33.30±16.1b | 9.30±5.50 | 101.92 | <0.001 |
| 第1次肺功能检测纠正年龄(Mean±SD,周) | 38.47±1.67 | 38.20±1.52 | 39.95±1.33 | 31.31 | 0.086 |
| 第1次肺功能检测体重(Mean±SD,kg) | 2.48±0.50b | 2.66±0.31b | 3.23±0.40 | 51.60 | <0.001 |
| 第1次肺功能检测身长(Mean±SD,cm) | 45.46±2.42b | 45.57±2.00b | 49.40±1.28 | 64.40 | <0.001 |
注:与早产儿对照组比较,aP<0.05;与足月儿对照组比较,bP<0.05;BPD:支气管肺发育不良。
第2次肺功能检测时,BPD组23例、早产儿对照组24例、足月儿对照组21例完成检测,3组患儿体重分别为(7.43±0.44)kg、(7.5±0.67)kg、(7.75±0.52)kg,身长分别为(65.22±1.49)cm、(66.33±1.66)cm、(67.5±0.71)cm,3组患儿体重、身长差异均无统计学意义(均P>0.05)。
BPD组患儿复苏时正压通气、住院期间机械通气、使用肺表面活性物质、院内感染性肺炎和动脉导管未闭(patent ductus arteriosus,PDA)发生比例均高于早产儿对照组,差异有统计学意义(均P<0.05),而两组产前使用糖皮质激素、剖宫产分娩、FiO2>30%的比例差异均无统计学意义(均P>0.05)。见表2。
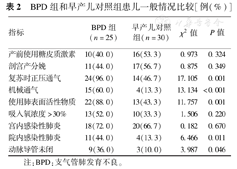
BPD组和早产儿对照组患儿一般情况比较[例(%)]
BPD组和早产儿对照组患儿一般情况比较[例(%)]
| 指标 | BPD组(n=25) | 早产儿对照组(n=30) | χ2值 | P值 |
|---|---|---|---|---|
| 产前使用糖皮质激素 | 10(40.0) | 16(53.3) | 0.973 | 0.324 |
| 剖宫产分娩 | 11(44.0) | 17(56.7) | 0.875 | 0.349 |
| 复苏时正压通气 | 24(96.0) | 14(46.7) | 17.105 | 0.001 |
| 机械通气 | 15(60.0) | 4(13.3) | 13.134 | <0.001 |
| 使用肺表面活性物质 | 22(88.0) | 13(43.3) | 11.757 | 0.001 |
| 吸入氧浓度>30% | 13(52.0) | 10(33.3) | 1.506 | 0.220 |
| 宫内感染性肺炎 | 18(72.0) | 20(66.7) | 0.182 | 0.670 |
| 院内感染性肺炎 | 11(44.0) | 4(13.3) | 6.466 | 0.011 |
| 动脉导管未闭 | 9(36.0) | 3(10.0) | 3.987 | 0.046 |
注:BPD:支气管肺发育不良。
随访两组早产儿在纠正年龄6月龄内呼吸系统疾病情况,BPD组患儿共随访23例,其中10例(43.4%)下呼吸道感染,5例(21.7%)有喘息,9例(39.1%)患儿再次住院;早产儿对照组共随访24例,其中4例(16.7%)下呼吸道感染,2例(8.3%)有喘息,4例(16.7%)患儿再次住院。两组比较差异均无统计学意义(均P>0.05)。
第1次肺功能检测结果显示,BPD组TPTEF/TE、VPTEF/VE均低于早产儿对照组和足月儿对照组(均P<0.05),早产儿对照组和足月儿对照组差异无统计学意义(均P>0.05)。BPD组和早产儿对照组VPTEF、PEF、TEF75%、TEF50%、TEF25%均低于足月儿对照组(均P<0.05),BPD组和早产儿对照组差异无统计学意义(均P>0.05)。见表4。
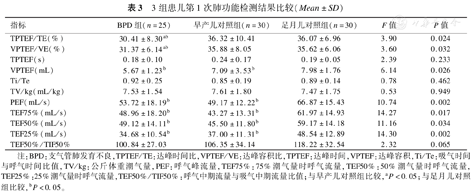
3组患儿第1次肺功能检测结果比较(Mean±SD)
3组患儿第1次肺功能检测结果比较(Mean±SD)
| 指标 | BPD组(n=25) | 早产儿对照组(n=30) | 足月儿对照组(n=30) | F值 | P值 |
|---|---|---|---|---|---|
| TPTEF/TE(%) | 30.41±8.30ab | 36.32±10.41 | 36.07±6.96 | 3.90 | 0.024 |
| VPTEF/VE(%) | 31.37±6.14ab | 35.88±8.05 | 35.62±6.06 | 3.60 | 0.032 |
| TPTEF(s) | 0.18±0.10 | 0.24±0.17 | 0.19±0.05 | 2.39 | 0.233 |
| VPTEF(mL) | 5.67±1.23b | 7.09±3.53b | 7.98±1.76 | 6.14 | 0.026 |
| Ti/Te | 0.92±0.25 | 0.85±0.19 | 0.89±0.14 | 0.78 | 0.462 |
| TV/kg(mL/kg) | 7.53±1.54 | 7.61±1.80 | 7.47±1.75 | 0.53 | 0.949 |
| PEF(mL/s) | 53.72±18.19b | 49.17±12.22b | 66.87±15.43 | 10.74 | 0.002 |
| TEF75%(mL/s) | 48.96±18.20b | 43.27±13.31b | 61.97±14.93 | 14.27 | 0.017 |
| TEF50%(mL/s) | 49.12±14.11b | 45.50±11.80b | 59.17±14.18 | 11.16 | 0.034 |
| TEF25%(mL/s) | 34.68±10.54b | 37.00±11.31b | 48.54±12.89 | 14.30 | 0.002 |
| TEF50%/TIF50% | 100.84±27.03 | 106.35±34.14 | 118.22±32.54 | 2.32 | 0.065 |
注:BPD:支气管肺发育不良,TPTEF/TE:达峰时间比,VPTEF/VE:达峰容积比,TPTEF:达峰时间,VPTEF:达峰容积,Ti/Te:吸气时间与呼气时间比值,TV/kg:公斤体重潮气量,PEF:呼气峰流量,TEF75%:75%潮气量时呼气流量,TEF50%:50%潮气量时呼气流量,TEF25%:25%潮气量时呼气流量,TEF50%/TIF50%:呼气中期流量与吸气中期流量比值;与早产儿对照组比较,aP<0.05;与足月儿对照组比较,bP<0.05。
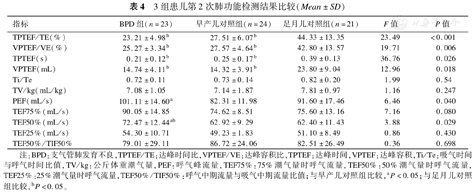
3组患儿第2次肺功能检测结果比较(Mean±SD)
3组患儿第2次肺功能检测结果比较(Mean±SD)
| 指标 | BPD组(n=23) | 早产儿对照组(n=24) | 足月儿对照组(n=21) | F值 | P值 |
|---|---|---|---|---|---|
| TPTEF/TE(%) | 23.21±4.98b | 27.51±6.07b | 44.33±13.35 | 23.49 | <0.001 |
| VPTEF/VE(%) | 25.27±3.34b | 27.57±4.64b | 42.80±13.57 | 19.71 | 0.006 |
| TPTEF(s) | 0.21±0.12b | 0.25±0.17b | 0.39±0.13 | 36.76 | 0.026 |
| VPTEF(mL) | 14.74±4.11b | 14.32±3.91b | 23.80±9.04 | 12.96 | 0.018 |
| Ti/Te | 0.72±0.11 | 0.73±0.14 | 0.82±0.20 | 1.99 | 0.54 |
| TV/kg(mL/kg) | 7.08±1.05 | 7.14±1.87 | 7.81±0.97 | 1.16 | 0.247 |
| PEF(mL/s) | 101.11±14.60a | 82.31±11.98 | 91.60±17.46 | 6.46 | 0.040 |
| TEF75%(mL/s) | 90.05±14.85 | 74.62±8.51 | 75.60±13.16 | 7.16 | 0.080 |
| TEF50%(mL/s) | 72.47±12.44ab | 62.92±9.29 | 62.40±11.43 | 3.88 | 0.029 |
| TEF25%(mL/s) | 54.30±10.71 | 49.23±1.83 | 51.10±8.49 | 0.86 | 0.430 |
| TEF50%/TIF50% | 79.01±29.11 | 86.72±24.06 | 82.51±26.49 | 0.36 | 0.698 |
注:BPD:支气管肺发育不良,TPTEF/TE:达峰时间比,VPTEF/VE:达峰容积比,TPTEF:达峰时间,VPTEF:达峰容积,Ti/Te:吸气时间与呼气时间比值,TV/kg:公斤体重潮气量,PEF:呼气峰流量,TEF75%:75%潮气量时呼气流量,TEF50%:50%潮气量时呼气流量,TEF25%:25%潮气量时呼气流量,TEF50%/TIF50%:呼气中期流量与吸气中期流量比值;与早产儿对照组比较,aP<0.05;与足月儿对照组比较,bP<0.05。
第2次肺功能检测结果显示,BPD组和早产儿对照组TPTEF/TE、VPTEF/VE、TPTEF、VPTEF均低于足月儿对照组(均P<0.05),BPD组与早产儿对照组差异无统计学意义(均P>0.05)。BPD组PEF、TEF50%均高于早产儿对照组和足月儿对照组(均P<0.05),早产儿对照组与足月儿对照组差异无统计学意义(均P>0.05)。见表5。
BPD组患儿两次肺功能检测比较,第2次(纠正年龄6月龄)TPTEF/TE(P=0.001)、VPTEF/VE(P<0.001)、Ti/Te(P<0.001)、TEF50%/TIF50%(P=0.016)比第1次(纠正年龄37~41周)降低,VPTEF(P<0.001)、PEF(P<0.001)、TEF75%(P<0.001)、TEF50%(P<0.001)、TEF25%(P<0.001)比第1次升高,差异均有统计学意义(均P<0.05)。早产儿对照组两次肺功能检测比较,第2次TPTEF/TE(P=0.001)、VPTEF/VE(P<0.001)比第1次降低,VPTEF(P=0.001)、PEF(P<0.001)、TEF75%(P<0.001)、TEF50%(P<0.001)、TEF25%(P=0.002)比第1次升高,差异均有统计学意义(均P<0.05)。足月儿对照组两次肺功能检测比较,第2次(6月龄)TPTEF/TE(P=0.015)、VPTEF/VE(P=0.026)、TPTEF(P<0.001)、VPTEF(P<0.001)、PEF(P=0.023)比第1次(生后3 d~1周)升高,TEF50%/TIF50%(P=0.002)比第1次降低,差异均有统计学意义(均P<0.05)。
随着围生期医学救治水平的提高,超未成熟早产儿生存率提高,然而BPD并未减少[9,10],美国一项5年的统计调查中,胎龄<28周的极低出生体重儿BPD发生率可达42%[11]。BPD是多因素导致的一种复杂慢性肺部疾病,在遗传易感性的基础上,宫内和围生期感染以及胎盘功能不全引起肺生长受限,早产导致肺发育中断,机械通气导致的气道损伤和氧疗诱发肺部炎症反应,以及生后肺生长进一步受到体液超负荷和营养缺乏等影响[12]。
BPD的病理基础是肺泡结构简单化、毛细血管发育不良[2],当早产发生在肺发育的小管形成阶段和囊泡早期阶段,此时本应形成支气管树末端分支、腺泡的过程被中断,随后囊泡形成阶段形成原始肺泡、血气屏障进一步形成以及肺表面活性物质产生均受影响,最终导致肺部发育中断和分隔障碍[12]。在此基础之上,机械通气时高气道压或高潮气量可能导致肺过度膨胀引起气压伤,这与BPD的发生密切相关[13]。尹燕丹等[14]研究发现机械通气的使用、使用时间≥7 d等是BPD的危险因素。本研究中发现BPD组复苏使用正压通气及机械通气比例比早产儿对照组高,这与机械通气引起肺泡过度扩张导致血管和肺泡机械性损伤,伴液体渗漏和炎症因子释放有关。Gien和Kinsella[15]研究提示PDA可能与BPD发生有关,有症状的PDA引起肺血流和肺组织间液增多,进一步发展导致肺水肿,影响肺部通换气功能,从而导致患儿所需吸入氧浓度升高、机械通气平均气道压增高和机械通气时间延长,引起肺机械性损伤、氧化应激等,这与本研究结果相符,但是Gien和Kinsella[15]的研究也提出积极治疗PDA尚未显示出能降低BPD发生率,甚至有负面结果,PDA与BPD的发生关系需更多研究探讨。本研究中BPD发生院内感染性肺炎较非BPD早产儿多,考虑除了与BPD患儿机械通气时间长、住院时间长导致感染风险升高以外,感染本身可引起连锁炎症反应造成肺损伤,国外有研究提示院内感染发生率与BPD发生率呈正相关[16]。
Islam等[17]研究发现,BPD患儿远期可能存在不同程度呼吸系统后遗症,如肺功能异常、哮喘、成年期慢性肺疾病。BPD早产儿在婴幼儿时期存在肺功能异常,特别是小气道功能受损,肺部的影像学表现可能存在异常如肺气肿等,另外喘息、再住院率、呼吸系统疾病发生率及呼吸系统药物需求量更高,运动耐量降低[18]。姚丽平等[19]随访BPD早产儿在3岁内支气管炎、喘息发生率均高于非BPD早产儿,而肺炎、再入院率无明显差异。本研究中BPD与非BPD早产儿纠正年龄6月龄内下呼吸道感染、喘息、再入院率差异无统计学意义,这可能是由于本研究中BPD组入组患儿多为轻度BPD,且与随访时间较短、例数少有关。BPD远期呼吸系统预后需要更多样本观察及更长时间追踪。
肺功能检测是确定及量化呼吸系统功能缺陷和异常的一项无创性诊断技术,是描述呼吸功能的重要方法之一[20]。适合婴幼儿肺功能检测的方法常见有潮气呼吸法、体积描记法、胸腹腔挤压法、阻断法、六氟化硫测功能残气等。其中潮气呼吸法操作简单、无创,结果较直观,无需配合,可操作性强,已在我国开展20余年,国内婴幼儿肺功能检测常使用潮气呼吸法。
潮气呼吸法各项指标中,TPTEF/TE、VPTEF/VE等提示呼气气流受限程度,其降低提示阻塞性通气障碍[7],阻塞程度越重,上述指标越低。本研究中,BPD组在纠正年龄37~41周时TPTEF/TE、VPTEF/VE较早产儿对照组和足月儿对照组降低,提示BPD组患儿与早产儿及足月儿相比,存在小气道阻塞、呼气气流受限可能。有学者认为BPD患儿小气道阻塞是由于其因早产导致肺部发育中断导致小气道发育不良、肺泡结构简单化、数量少的基础之上,加之高氧引起氧化应激反应,肺间质纤维化、气管平滑肌增厚[21],机械通气导致大、小气道平滑肌肥大,气道上皮增厚,导致管腔狭窄,气道阻力增大[22],同时因抑制肺泡分隔和血管生成,并增加细胞凋亡和肺弹性蛋白,肺弹性组织增多[23],肺泡、气道顺应性减低限制呼气时气道的正常扩张,最终表现为呼气气流受限。卫敏超等[24]研究显示,各程度BPD患儿TPTEF/TE均较非BPD早产儿组低,VPTEF/VE随BPD程度加重而降低,提示BPD患儿小气道阻塞明显,阻塞程度与BPD严重程度有关。本研究由于中、重度BPD样本少,未进行BPD分度比较,在多数为轻度BPD的情况下仍存在TPTEF/TE、VPTEF/VE显著降低,同样提示BPD患儿存在小气道阻塞。
而纠正年龄6月龄时,BPD组TPTEF/TE、VPTEF/VE结果无升高,可能提示小气道阻塞情况无改善。Bentsen等[25]对BPD患儿肺功能纵向随访研究发现,BPD患儿肺功能生后1年内仍存在持续小气道阻塞,且可能预测呼吸系统疾病发生。Sanchez-Solis等[26]的研究显示,BPD患儿在纠正年龄6月龄和12月龄时肺功能低于非BPD早产儿,提示存在气道阻塞,两组早产儿均无肺功能追赶,但是发现身长的增长与肺功能增加密切相关。Balinotti等[27]通过结合生理技术测量肺泡体积来评估肺实质增长情况,发现BPD患儿气体扩散能力下降,但肺泡容积基本正常,提示1岁时BPD患儿肺泡发育受限仍持续存在。
PEF、TEF50%/TIF50%反映大气道阻塞情况[7]。本研究发现BPD组纠正年龄6月龄时PEF较早产儿对照组高,考虑存在大气道阻塞可能。潮气呼吸时,呼气流速取决于肺和胸廓的弹性回缩力和气道阻力。在肺部发育的关键时期,高氧、机械通气、感染等因素导致气管平滑肌肥大、纤维增生,气管重塑,气道炎症合并气道高反应性[11],增加呼吸道感染风险,大气道水肿、分泌物增多、平滑肌增生,使得大气道狭窄、气流通过时流速增快。卫敏超等[24]研究显示,中重度BPD在婴儿时期存在持续的大气道气流受限,这可能与气道平滑肌增生、气道纤维化、气道水肿、结构改变有关。而本研究中多数为轻度BPD,随访中BPD患儿的PEF较非BPD早产儿高,但与足月儿无明显差异,这可能由于本研究样本量小,造成结果偏倚。
潮气量在限制性肺疾病或中重度阻塞性疾病时可能出现下降[7]。本研究中BPD患儿TV/kg在纠正年龄37~41周及纠正年龄6月龄时均正常,与非BPD早产儿、足月儿相比无明显差异。Bentsen等[25]研究则显示BPD患儿在纠正年龄足月时的肺功能TV/kg较足月儿高,可能与BPD患儿肺泡少而大、生理性无效死腔较大,需要更多潮气量以满足正常气体交换有关,此研究未使用面罩测量。而Schmalisch等[28]则发现BPD患儿与足月儿潮气量无差异,不过每分钟潮气量增加,可能与增加呼吸频率有关。本研究中未纳入每分钟潮气量指标,而3组患儿TV/kg差异无统计学意义,考虑与纳入的轻度BPD患儿为多,也可能与本研究使用面罩测量影响受试者呼吸模式,未检测到可能增加的潮气量有关。
综上所述,BPD作为早产儿常见并发症之一,对其远期肺功能影响主要表现为小气道阻塞,并可能持续至整个婴儿期。然而,目前BPD仍缺乏行之有效的治疗方法,优化早产儿呼吸及营养管理策略,避免肺损伤,减少BPD发生,以改善早产儿远期预后及生活质量。
所有作者均声明不存在利益冲突



























