
立体定向脑电图引导射频热凝毁损(SEEG RF-TC)是一种针对药物难治性癫痫的微创治疗手段,近年来在国内外逐步开展。为了进一步规范该临床治疗的应用,邀请了该领域的国内知名专家进行讨论,就该治疗的适应证、禁忌证、治疗方案、治疗的安全性和有效性等方面形成了中国专家共识。共识认为,SEEG RF-TC适应证应分为两类,其中一类以治疗为目的,另一类主要以定位致痫灶为目的兼顾治疗,其电极设计方案也要依据手术目的而具体设计。其安全性较好,对致痫灶局限的如下丘脑错构瘤、脑室旁灰质异位结节等效果较好,对其他类型的局灶性癫痫如海马硬化、局灶性皮质发育不良(FCD)等亦有一定疗效,或起到预测手术切除疗效的目的。

癫痫是以脑神经元反复过度异常同步放电导致的脑功能网络障碍疾病。在我国,癫痫的患病率为0.4%~0.7%[1]。尽管约2/3的患者通过合理的服用抗癫痫药物能够有效地控制癫痫发作,仍有1/3的患者使用药物控制效果不佳[2]。大部分药物难治性癫痫患者为局灶性起源,其中部分患者经术前综合评估可以定位致痫区(epileptogenic zone,EZ),通过手术切除有望获得治愈。但对于一些位于脑功能区、脑深部区域的致痫灶,开颅手术切除的创伤和风险相对较大,并有潜在导致神经功能缺损的风险[3]。
发展微创疗法,在缓解癫痫发作同时尽可能减少手术创伤和保护脑功能是癫痫外科治疗的长期目标。难治性癫痫致痫区射频热凝毁损(radiofrequency thermocoagulation,RF-TC)起源于20世纪50年代,有学者初步尝试了使用立体定向技术将射频装置置入致痫区中,通过射频电流加热而毁损致痫区[4]。近年来,随着脑影像学和癫痫术前评估手段的快速进展,特别是立体定向脑电图(stereotactic-electroencephalogram,SEEG)技术的进展,能够更精确定位颅内致痫区[5]。而在应用SEEG定位致痫区的同时,置入的记录电极可通过射频电流发生器,进行SEEG引导下的射频热凝毁损(SEEG RF-TC),从而治愈或减少癫痫发作[6, 7]。尽管SEEG RF-TC近年来在我国得到了越来越多的关注和应用,目前仍缺乏对该治疗方法的适应证、禁忌证、电极设计方案、工作流程和治疗参数等方面的标准,不同医院或者癫痫中心之间也缺乏一致性。因此,鉴于目前国内缺乏SEEG RF-TC的规范化指导性文件,中国医师协会神经外科分会功能神经外科学组、中国抗癫痫协会和国家神经外科手术机器人应用示范项目专家指导委员会组织相关专家,在国内外临床证据的基础上,结合我国各中心专家经验和实际情况,讨论并撰写《立体定向脑电图引导射频热凝毁损治疗药物难治性癫痫的中国专家共识》,力图规范SEEG RF-TC在我国的临床应用,为神经内科、神经外科和神经电生理科等医师的工作提供参考。证据和推荐意见的评价方法采用推荐分级的评估、制定与评价(Grading of recommendations assessment,development and evaluation,GRADE)分级系统[8]。
针对药物难治性癫痫患者,通过无创手段评估后,形成完善的致痫区和癫痫网络传导理论假设,对于符合SEEG置入适应证的患者,将适当数量的SEEG电极精准置入可能的致痫区以及癫痫传播网络区域,并行SEEG监测[9, 10]。在明确癫痫起源基础上,基于SEEG引导,通过射频仪在相近电极触点间施加一定功率的射频电流,继而产生热效应,其核心温度达78~82 ℃[11],导致局部神经元和胶质细胞的蛋白质变性和凝固性坏死[7],起到毁损致痫区或破坏癫痫网络传导的作用。
单根电极相邻触点间可以形成毁损灶[12]。考虑到SEEG电极直径较细,触点长度有限,过高的功率会产生局部脑组织碳化粘连情况,不利于RF-TC的安全进行,因此,使用不同电极相邻触点之间毁损增大毁损范围具有合理性[7]。近年来以我国团队在单根电极相邻触点间毁损的基础上,通过离体实验证实两根不同电极间同样可形成毁损灶[13]。经过基础研究和临床研究验证,发现在组织中距离5~7 mm的电极触点之间可以形成稳定毁损灶,从而提出了3D交叉RF-TC技术,即通过相对密集的电极置入,在空间中相邻电极之间触点进行毁损产生更理想的毁损效果[11,14]。
SEEG RF-TC首先要满足SEEG置入的适应证,即按照药物难治性癫痫一阶段无创评估后认为需要进行SEEG置入,用于明确致痫区部位,同时兼顾该脑区的射频毁损治疗。
随着临床经验的不断积累和研究的深入,在对癫痫起源和癫痫网络充分认识的基础上,针对一些手术难以完全切除、手术风险高、创伤大、或者可能引起严重神经功能缺损的癫痫患者,SEEG RF-TC已经逐渐成为一种临床治疗方法,而不仅仅是诊断工具,这类疾病列为“A类适应证”。另外,针对一些类型的癫痫患者,SEEG RF-TC则为经典切除性手术之外的补充性治疗方式:针对致痫区位于功能区无法进行切除性手术(或拒绝进行切除性手术)的患者,SEEG RF-TC是姑息性治疗选择;以及在经过SEEG监测后,对于高度怀疑但不能完全确定致痫区的患者,SEEG RF-TC可以考虑在切除手术前进行诊断性治疗,这类疾病列为“B类适应证”。
1.下丘脑错构瘤(hypothalamus hamartoma,HH)。
2.脑室旁结节状灰质异位(periventricular nodular heterotopia,PNH)。
1.影像学较为局限的局灶皮质发育不良(主要为Ⅱ b型局灶皮质发育不良)(focal cortical dysplasia typeⅡb,FCD Ⅱb)。
2.单侧内侧颞叶癫痫伴海马硬化(优势侧、神经心理检测基本正常或不接受手术治疗的患者)(mesial temporal lobe epilepsy,MTLE)。
3.致痫区较为局限的岛叶癫痫(insular lobe epilepsy)。
4.致痫区明确且局限的结节性硬化症(tuberous sclerosis complex,TSC)。
5.累及脑功能区,无法手术切除的患者。
6. MRI阴性患者应慎重选择:基于临床症状学、SEEG记录和皮质电刺激结果,高度怀疑局灶性起始的癫痫患者可以尝试。不推荐大范围“撒网式”毁损。
1.局部颅骨厚度<2.0 mm无法牢固固定导向螺钉的患者。
2.全身麻醉手术禁忌的患者。
3.严重认知障碍、表达障碍,难以保证电极置入后安全性的患者。
4.年龄没有特殊限制,但2岁以下婴幼儿因颅骨厚度薄、依从性差等原因需要特别慎重选择。
5.置入部位皮肤和皮下软组织感染或有植入物的患者。
6.MRI扫描禁忌的患者。
7.致痫区为可疑富血供的病变,如脑动静脉畸形(AVM)等。
专家推荐:
1.SEEG RF-TC可作为下丘脑错构瘤(HH)推荐治疗方式(1C)。
2.对于不合并其他病变的单纯灰质异位结节,可推荐选用SEEG RF-TC(1C)。
3.体积局限,位于脑沟沟底或脑功能区的FCDⅡB患者,可尝试选用SEEG RF-TC(2C);定位相对明确、体积较大的FCD不推荐使用SEEG RF-TC(3C)。
4.对拒绝切除性手术的患者,特别是在致痫区位于优势侧,术前神经功能良好,且患者对认知和记忆功能要求较高时可以尝试使用SEEG RF-TC(2C)。
5.对于致痫区较为局限,位于功能区的患者,可以设计SEEG置入,确认致痫区范围后在清醒状态下观察患者肢体或语言功能同时进行SEEG RF-TC,以期达到治疗癫痫同时保护脑功能的目的(2C)。
专家推荐意见说明:
1.HH导致的药物难治性癫痫,传统的开颅或内镜手术损伤下丘脑、穹隆、垂体柄的风险较大,而癫痫缓解率偏低(15%~54%)[15, 16],SEEG RF-TC相对安全性较好[17, 18]。
2.脑室旁灰质异位结节引起药物难治性癫痫,可以行颅内电极置入明确致痫区起始和传导[19, 20, 21]。对于不合并其他病变的单纯灰质异位结节SEEG RF-TC 效果较好[21, 22]。
3.体积较小的FCD可能通过SEEG RF-TC获得治愈[23, 24]。
4.内侧颞叶癫痫伴同侧海马硬化患者,尽管目前临床观察显示SEEG RF-TC癫痫治愈率低于前颞叶海马切除[12,25, 26, 27],但对于术后认知和记忆功能影响轻微[25,28],对同侧前伸的视放射Meyer′s环影响较小[29]。
5.对于不可切除的致痫灶,如功能区病变,SEEG RF-TC治疗后近半数患者获得50%的癫痫缓解[30],且相对安全[26]。
SEEG RF-TC诊疗流程见图1。
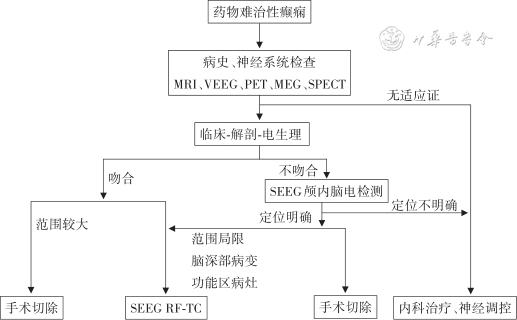

注:MRI为磁共振成像;VEEG为视频脑电图;PET为正电子发射型计算机断层显像;MEG为脑磁图;SPECT为单光子发射计算机断层成像术;SEEG为立体定向脑电图;SEEG RF-TC为立体定向脑电图引导射频热凝毁损
符合药物难治性癫痫(2010年国际抗癫痫联盟ILAE诊断标准)[2],经过综合评估以及认知测评[5],神经内科、神经外科、影像科和电生理团队等多学科共同讨论后,提出患者癫痫惯常发作的“解剖-电生理-临床表现”的假说。如满足SEEG RF-TC治疗适应证,应和患者和家属充分沟通后决定手术方案,并完善术前检查[5]。在电极置入手术前完善头颅增强MRI、CT或CT血管造影等检查(用以制定电极置入计划,避开血管)[5]。
SEEG RF-TC的电极设计需要遵循下列原则:(1)电极置入部位尽可能覆盖癫痫网络相关脑区,有利于明确发作起始脑区、早期传导脑区、传播区、症状产生区和邻近的脑功能区[31];(2)电极置入路径距离所有血管安全距离≥2~5 mm[32];(3)设计路径尽量避开脑室和脉络丛;(4)电极计划与颅骨入点处垂线成角度不应过大[32];(5)置入部位颅骨厚度≥2.0 mm[5];(6)对于以治愈为目标的患者,应在安全的前提下增加致痫区内的电极数量,以期达到完全毁损致痫区的目的[14]。
专家推荐:
1.下丘脑错构瘤患者靶点应覆盖瘤蒂(1C);
2.内侧颞叶癫痫伴同侧海马硬化患者可设计经枕置入和海马长轴平行的电极联合经颞的垂直电极,垂直电极靶点间距离不应过远(不超过5~7 mm)(2C);不是单纯内侧型颞叶癫痫,不建议按毁损方案密集置入(3C);
3.岛叶癫痫可增加斜插电极数量来增大毁损容积(2C);
4.其他类型药物难治性癫痫SEEG RF-TC则需要兼顾定位致痫区,并在致痫区中置入一定数量的电极(2C)。
专家推荐意见说明:
1.HH蒂为异常放电的传导通路,应为SEEG RF-TC的重点靶区,同时应尽可能增加瘤体内毁损容积[17,33];
2.对于内侧颞叶癫痫患者,单纯使用垂直电极毁损效果不佳[25,34],使用海马长轴电极结合垂直电极的立体交叉毁损能增加毁损容积,提高癫痫治疗效果[29];
3.对于岛叶癫痫,斜插电极可以增加在岛叶中电极触点的数量,同时适当增加垂直电极以扩大岛叶毁损容积[35];
4.对于其他类型癫痫患者,SEEG置入计划应先满足定位致痫区的需要,如拟行毁损但致痫区内部电极数量不够可以在充分权衡利弊情况下再次置入一定数量的电极,以期达到充分毁损致痫区域的目的[36]。
SEEG电极置入的简要步骤:全身麻醉,连接头架,使用机器人注册或使用立体定向框架,消毒铺巾,切开皮肤,使用单极止血,颅骨钻孔,使用柱状单极或克氏针等刺破硬膜,置入导向螺钉,使用钝头探针穿刺,形成隧道,最后按计算长度置入电极,并依次重复置入全部电极。手术需要注意下列事项:(1)可预防性使用抗生素;(2)SEEG RF-TC可能需要某些特殊置入角度和部位置入电极,如海马长轴电极,建议使用手术机器人辅助;(3)所有钻孔、灼烧硬膜、探针进入和置入电极等都需要测量置入深度后进入;(4)钻孔后快速置入电极,尽量减少脑脊液流失和空气进入引起颅内结构的移位;(5)电极置入完毕后评估神经功能状态,复查颅脑CT。
复查CT确定无颅内出血,融合图像明确电极触点确切位置后,术后24 h内开始监测,通常需要记录3~5次以上的惯常发作,并综合癫痫发作症状学和脑电图分析明确发作起始。发作间期呈现典型FCD的放电特征(如部位恒定的近持续性的癫痫样放电或者间断的快节律或多棘波节律爆发)[37],发作期在临床症状开始前出现典型放电模式和演变规律,例如低波幅快节律或伴直流电漂移,节律性尖波/棘波的皮质区域[38, 39]均具有比较可靠的定位价值,可以作为毁损目标区域[40, 41]。当致痫灶邻近或位于感觉、运动及语言等功能区时,可行皮质电刺激进行功能定位[42]。在电刺激过程中,如果在较低的电流强度刺激即出现惯常发作,而且这些关键的电极触点与颅内电极记录到的发作起始区一致,则可进一步证实为致痫区,可以作为毁损的靶区[43]。如果SEEG结果无法精确定位的患者,则不推荐做“撒网式”毁损。
SEEG RF-TC通过将相应SEEG电极触点和射频仪连接后进行,需要注意下列事项:(1)通常对于配合的患者可在清醒状态下完成毁损,对于低龄儿童、不能配合或电刺激易诱发全面性发作的患者可在全身麻醉下毁损;(2)毁损之前需要再次确定所需毁损电极触点的位置;(3)预毁损:先进行小功率(1~3 W)、时间较短的预毁损(30~50 s),并不断观察患者语言、运动等功能的变化;(4)毁损:预毁损未出现神经功能缺损的患者,可适当增加功率(3~6 W)和时间(60 s内)进行永久性毁损,过程中同时不断观察患者语言、运动等功能;(5)致痫灶内不同电极触点之间,距离较近者(≤7 mm)均可以两两成对毁损[44];(6)开放静脉通路,并准备静脉用抗癫痫药物,毁损过程中如果出现癫痫先兆或癫痫发作则应暂缓该部位毁损,如果出现癫痫持续状态,则应参照《临床诊疗指南·癫痫病分册》(2015年修订版)处理;(7)毁损后可继续进行SEEG脑电监测,观察毁损区域放电情况;(8)毁损后继续监测一段时间,可根据结果直接拔除或再次热凝后拔除电极[30];(9)毁损结束后评估神经系统功能并复查CT或MRI确认毁损部位及毁损范围。
术后1年内可在每3~6个月进行随诊,内容包括:发作缓解情况、磁共振、脑电图。1年以后可以每6~12个月随诊一次。建议患者或监护人规律记录癫痫发作日志。
因致痫区容积和形态不同,以及癫痫传导途径不同,因此不同类型癫痫患者预后差异较大[26,45]。SEEG RF-TC对癫痫的长期控制情况通常可分为完全缓解(术后1年无发作),有效(术后1年癫痫发作频率减少50%或更多)和效果不佳(术后1年癫痫发作频率减少不足50%)[26]。根据目前国内外的研究资料分析,以下不同类型的癫痫预后供参考:(1)HH:经SEEG RF-TC治疗后有55.6%~82.1%患者癫痫完全缓解,44.4%的患者癫痫发作减少超过90%[18,46]。有研究报道[47]近30%的患者在使用射频电极毁损后可能出现发热、低钠血症、食欲亢进、近期记忆损伤等表现,但通常能在2~4周缓解,SEEG RF-TC后可能出现短期的体重增加等情况[18]。(2)PNH:SEEG RF-TC后患者癫痫长期缓解率为38%~56%[12,21, 22,45,48]。(3)MTLE:SEEG RF-TC后患者发作的长期缓解率为21%~76.2%[26,29,48],术后远期认知多改善或无明显受损[49]。(4)体积较小的FCD[23,50]、结节性硬化等:可以尝试SEEG RF-TC,但治愈率尚无大宗报导。(5)岛叶癫痫:SEEG RF-TC后患者长期完全缓解率为53%,获得50%以上缓解率为89%[51]。(6)MRI阴性癫痫:如果患者脑磁图(MEG)显示为丛集型偶极子者,毁损后1年完全缓解率可达30%[52]。(7)SEEG RF-TC可帮助预测手术效果。毁损后显效组,切除术后预后较好者占93.2%。毁损后效果不佳组,切除术后预后较好者占55.3%[52, 53]。
2.5%的经治疗的患者在SEEG RF-TC后出现一过性的神经功能损害,其中多数患者在术后2~10个月后完全恢复功能[53],不到0.5%的患者会出现永久、严重的后遗症[54]。
SEEG RF-TC治疗后癫痫发作缓解不满意可以考虑再次手术评估,根据致痫区定位情况可以采取再次毁损、MRI引导激光消融,也可根据SEEG定位结果进行切除性手术。特别是,如果RF-TC术后2个月癫痫缓解>50%则高度提示毁损区域为致痫区,可以按评估范围进行切除性手术[53]。
近年来的临床实践显示,对于致痫区较为局限的药物难治性癫痫患者,SEEG RF-TC具有接近于切除性手术的有效性,同时具有更高的安全性并能够更大限度地保留脑功能。对于HH和PNH患者,SEEG RF-TC有望成为其“一线”的治疗方式。因此,在设计电极置入方案时要考虑电极靶点、路径和需要毁损部位。对于其他类型癫痫,SEEG RF-TC仍然只是一种微创化的尝试,在临床应用时需要严格把握其适应证。证实SEEG RF-TC在各类型癫痫中的有效性和安全性的相关临床研究还需进一步开展。随着研究的不断深入,SEEG RF-TC这种精准、微创的治疗方法有可能会部分取代传统的切除性外科手术,使更多药物难治性癫痫患者获益。
共同执笔:单永治(首都医科大学宣武医院神经外科);任连坤(首都医科大学宣武医院神经内科);周健(首都医科大学三博脑科医院神经外科);梁树立(首都医科大学附属北京儿童医院神经外科);赵国光(首都医科大学宣武医院神经外科)
共识专家组成员(按姓氏汉语拼音排序):蔡立新(北京大学第一医院神经外科);陈述花(首都医科大学附属北京儿童医院神经内科);崔志强(中国人民解放军总医院神经外科);邓艳春(空军军医大学西京医院神经内科);丁晶(复旦大学附属中山医院神经内科);丁美萍(浙江大学医学院附属第二医院神经内科);窦万臣(北京协和医院神经外科);方方(首都医科大学附属北京儿童医院神经内科);樊晓彤(首都医科大学宣武医院神经外科);傅先明(中国科学技术大学附属第一医院/安徽省立医院神经外科);关宇光(首都医科大学三博脑科医院神经外科);郭强(广东三九脑科医院神经外科);韩雄(河南省人民医院神经外科);洪震(复旦大学附属金山医院神经内科);康德智(福建医科大学附属第一医院神经外科);李少一(中国医科大学附属盛京医院神经外科);李世绰(中国抗癫痫协会);李云林(首都儿科研究所附属儿童医院神经外科);连亚军(河南医科大学附属医院神经内科);梁树立(首都医科大学附属北京儿童医院神经外科);林华(首都医科大学宣武医院神经内科);林卫红(白求恩医科大学神经内科);林元相(福建医科大学附属第一医院神经外科);刘仕勇(重庆新桥医院神经外科);刘学伍(山东大学齐鲁医院神经内科);卢洁(首都医科大学宣武医院放射科);卢强(北京协和医院神经内科);陆卫风(郑州大学附属第一医院神经外科);栾国明(首都医科大学三博脑科医院神经外科);马久红(山西省人民医院神经外科);孟祥红(深圳大学总医院神经外科);钱若兵(中国科学技术大学附属第一医院/安徽省立医院神经外科);秦炯(北京大学人民医院儿科);任连坤(首都医科大学宣武医院神经内科);单永治(首都医科大学校宣武医院神经外科);邵晓秋(首都医科大学附属北京天坛医院神经内科);陶英群(北部战区总医院神经外科);田宏(中日友好医院神经外科);王梦阳(首都医科大学三博脑科医院神经内科);王群(首都医科大学附属北京天坛医院神经内科);王爽(浙江大学附属第二医院神经内科);王湘庆(解放军总医院神经内科);王学峰(重庆医科大学附属第一医院神经内科);王玉平(首都医科大学宣武医院神经内科);魏鹏虎(首都医科大学宣武医院神经外科);吴逊(北京大学第一医院神经内科);于炎冰(中日友好医院神经外科);张建国(首都医科大学附属天坛医院神经外科);张华(西安交通大学第一附属医院神经外科);赵国光(首都医科大学宣武医院神经外科);赵瑞(复旦大学附属儿科医院神经外科);周东(四川大学华西医院神经内科);周健(首都医科大学三博脑科医院神经外科);周文静(清华大学玉泉医院神经外科);朱丹(广东三九脑科医院神经外科);邹丽萍(中国人民解放军总医院儿科)
所有作者均声明不存在利益冲突



























