
小肠克罗恩病(CD)临床症状隐匿,早期诊断困难,准确有效地对小肠CD进行全面评估和监测也是难点。目前临床上常用影像学检查、内镜检查、生物学标记物等手段和指标评估小肠CD的病变范围、病情活动度、治疗效果等。本文对几种评估方法近年来的研究进展进行综述,并提出适合临床应用的小肠CD诊断和评估流程。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
克罗恩病(Crohn′s disease,CD)患者中多达70%存在小肠受累,而1/3以上的CD患者单纯小肠受累[1]。小肠CD的临床症状隐匿,早期诊断困难,可并发肠腔狭窄,易合并肠梗阻及穿孔等并发症,CD患者小肠腺癌的发生风险也高于一般人群[2]。根据小肠的解剖部位和结构特点,临床上常用影像学、内镜检查、生物学标记物等评估小肠病变,上述评估方法存在各自的优势与局限性。如何通过无创手段、经济有效地评估小肠CD是疾病监测过程中的难点。现对近年来小肠CD评估方式的研究进展进行综述。
影像学检查在小肠CD的诊断和监测评估中发挥重要作用,尤其是诊断阶段对病变部位、范围、肠道并发症的全面评估。目前磁共振小肠造影(magnetic resonance enterography,MRE)与计算机断层扫描小肠造影(computed tomography enterography,CTE)是评估小肠炎性病变的标准影像学检查[3],肠道超声(intestinal ultrasound,IUS)也由于其自身优势受到越来越多的关注。
MRE无电离辐射,组织分辨率较高,对小肠CD病变及透壁性并发症有良好的分辨度和检出率。Taylor等[4]的前瞻性研究显示以内镜检查为参考标准,MRE检出小肠病变的敏感性和特异性分别为97%和96%。
现有多种MRE指数评估CD疾病活动性,回顾性研究显示简化磁共振活动指数(magnetic resonance index of activity score,MaRIA)可用来准确评估CD活动性及严重程度,敏感性88%,特异性97%。MaRIA还可准确监测药物治疗后溃疡愈合情况,CD患者经激素或抗肿瘤坏死因子(tumor necrosis factor,TNF)药物治疗后,内镜检查示溃疡愈合的患者中平均MaRIA可有显著改善。MRE与术后Rutgeerts评分高度吻合,可替代内镜检查作为评估术后复发的可靠工具。Rimola等[5]以手术切除的组织病理为标准,通过病变部位在MRE的不同特征表现,发现MRE增强模式是区分肠道炎症性和纤维性狭窄的有效方法。但也有研究显示增强MRE区分小肠炎症性和纤维性狭窄的能力有限。近年的报道提示磁化传递MRI对小肠狭窄性质的判断与组织学纤维化指数相关,优于对比增强MRI和弥散加权MRI。MRE的局限性在于成本较高,检查时间长,对运动伪影更敏感,时间分辨率、空间分辨率低于CTE,发现微小病变及早期黏膜变化的能力有限,但特殊成像条件MRI对于小肠狭窄性质的判断有一定优势。
CTE评价小肠病变的优势与MRE相当,可用于评估小肠CD疾病活动度、肠壁和肠壁外病变及并发症等。研究结果显示以回结肠镜检查及病理或手术标本及病理为参考标准,CTE诊断CD的敏感性为81%,特异性为82%[6]。电离辐射的暴露限制CTE的应用,单次CTE有效剂量可通过剂量长度乘积乘以转换因子K来计算,平均约为9.23 mSv,频繁CTE检查(每年累积辐射剂量≥50 mSv)显著增加癌症发生风险,因此CT通常应用在初诊或急性发病患者中(疑为重度梗阻、穿孔、脓肿等),常规评估尽可能选用MRE。
随着新图像重建技术如滤波反投影、迭代重建等的发展,低剂量辐射CTE(较全剂量标准CTE低25%甚至60%的剂量,平均约9.23 mSv)的出现可能成为一种替代方法。能谱CT近年来也成为评估CD疾病活动性的研究热点,可通过能谱曲线斜率来定量分析病灶内物质差异,有研究表明CD活动期曲线斜率高于缓解期。总之,CTE由于普及性高、检查时间短,仍是目前评估小肠CD的重要影像学手段,低剂量CTE用于常规评估值得进一步探索。
IUS是一种无辐射并且患者接受度高的成像技术。IUS可通过增厚的肠壁来识别小肠CD的病变部位及范围,在评估脓肿、瘘管等并发症方面也有较高的临床应用价值。IUS还可通过监测肠壁厚度、血流信号等评估CD活动性,监测治疗反应,预测术后复发。
目前存在多种评估疾病活动度的超声评分系统,其中Limberg评分应用最广泛,分为4级,Ⅰ:肠壁增厚(>4 mm);Ⅱ:肠壁增厚伴短条状血流;Ⅲ:肠壁增厚伴长条状血流;Ⅳ:肠壁增厚,显示长条状血流并向邻近肠系膜延伸。其中Ⅰ、Ⅱ为静止期,Ⅲ、Ⅳ为活动期。一项研究以内镜检查结果为参考标准,分析IUS评估CD患者治疗后黏膜愈合的准确性,结果显示肠壁厚度<3 mm是超声参数中判断黏膜愈合的最好指标,灵敏度88.1%,特异度94.1%[7]。最近Allocca等[8]的研究以MRE联合结肠镜检查做对照,IUS评估疾病活动度的准确度达96%,灵敏度和特异度分别为92%、100%。IUS同时受限于操作者的经验以及病变部位、腹壁脂肪厚度,对于盆腔深部肠管的评估作用有限。
黏膜愈合(mucosal healing,MH)作为CD的治疗目标,影像学检查对黏膜炎症的评估不够敏感,而胶囊内镜(capsule endoscopy,CE)和气囊辅助小肠镜(balloon assisted enteroscopy,BAE)可直视小肠黏膜,极大地提高了对小肠CD黏膜炎症的评估能力。
CE诊断黏膜病变的敏感性高,在检测近端小肠受累中更具优势,可用于诊断早期CD和监测治疗反应,评估黏膜愈合。研究表明以共识小组成员间达成一致的临床诊断为诊断标准,CE检出小肠CD的敏感性较高,达83%,但特异性仅为53%,明显低于其他检查[9]。相反,另一项研究的数据以回结肠镜检查和(或)手术为标准,显示其特异性与MRE和CTE相当。目前应用Lewis评分系统及胶囊内镜克罗恩病活动指数(CECDAI)来定量评估CD患者小肠的疾病活动度及预后。小肠CE可检出结肠镜及影像学检查未发现的小肠病变,改变CD分型,优化治疗策略。CE也可以预测疾病进展或复发的短期和长期风险,有研究表明小肠CE与MRE在评估CD术后的内镜复发上具有相似的敏感性,分别达100%、97%[10]。CE在儿童中也表现出良好的耐受度及安全性,其对CD患儿的诊断、疗效及预后评估均能提供重要线索。CE也存在局限性,例如依赖于肠道自身蠕动、不能选择观察病灶的距离和视角、不能获得病理组织标本等。针对这些问题,各种新型CE如磁控CE、超声CE、显微CE等正处于积极研发阶段,且由于存在胶囊滞留的风险,CE仅适用于临床症状和影像学表现上无肠腔狭窄的患者。
BAE在小肠CD诊断中有较高的特异性、灵敏性及阴性预测值,是小肠CD诊断的有效工具,主要包括双气囊小肠镜及单气囊小肠镜,两者在诊断和治疗方面的作用相当。一项回顾性研究的结果显示,BAE对已确诊和疑似CD患者的诊断率分别为87%和79%[11]。BAE可直视小肠黏膜病变并取活检,有助于鉴别诊断小肠病变,评估小肠CD活动程度以及黏膜愈合情况。BAE在诊治小肠CD合并狭窄方面,可预测合并小肠狭窄的CD患者的手术风险,可进行内镜下狭窄球囊扩张或成形术。但BAE为侵入性检查,检查耗时、费用高,经肛小肠镜操作难度高,并发症发生风险大,较少作为一线方法评估小肠CD。
目前内镜检查被认为是评估CD黏膜炎症及愈合程度的金标准,但其具有侵入性且费用高,不宜用于严密监测疾病的活动度。因此,敏感性高、简便易行的非侵入性生物标记物可用于动态评估小肠CD疾病活动度,减少不必要的内镜和影像学检查,降低并发症发生风险。本文将生物学标记物分为血清学标记物和粪便标记物,详述如下。
血清学标记物包括C-反应蛋白(C-reactive protein,CRP)、内镜/黏膜愈合指数(endoscopic/mucosal healing index,EHI/MHI)、白细胞介素(interleukin,IL)及其他血清标记物。
CRP是临床上应用最广泛的评估炎症的血清学标记物。荟萃分析显示,CRP≥5 mg/L用于评估CD内镜下活动的特异性较高(92%),敏感性只有49%,提示血清CRP水平与内镜下疾病活动有一定相关性。然而,在活动性CD患者尤其是以回肠病变为主的患者中[12],CRP水平可不升高,因此CRP水平正常不能排除炎症活动。对小肠CD来说,研究表明,CRP升高评估中至重度CD活动的敏感性、特异性分别为73%、69%[13]。另一项小肠CD患者的回顾性研究中,CRP升高与CE检测的炎性病变相关性较差[14]。CALM试验是一项针对CD患者的3期开放性、多中心、随机、对照试验,该试验表明,与单纯根据患者症状进行治疗升级相比,结合CRP或粪便钙卫蛋白(fecal calprotectin,FC)对CD活动度的严密监测,及时调整治疗决策,可以达到更好的临床和内镜结果[15]。另外,CRP水平可预测复发及预后,无症状或停药患者的CRP升高预示CD复发。临床缓解期间CRP升高与随后CD相关的住院及手术风险增加呈显著独立相关。CRP在评估小肠CD疾病活动度方面优于临床症状,但其诊断黏膜病变的敏感性低于内镜检查。
最近D′Haens等[16]通过多中心国际协作,在13种血清生物标记物基础上开发了一项复合指标,称为EHI。13种标记物包括血管生成素-1(angiopoietin-1,ANG1)、ANG2、CRP、血清淀粉样蛋白A1(serum amyloid A protein-1,SAA1)、白细胞介素-7(interleukin-7,IL-7)、细胞外基质金属蛋白酶诱导因子(extracellular matrix metalloproteinase inducer,EMMPRIN)、基质金属蛋白酶1(matrix metalloproteinase-1,MMP1)、MMP2、MMP3、MMP9、转化生长因子α(transforming growth factor alpha,TGFα)、癌胚抗原相关细胞黏附分子-1(carcinoembryonic antigen-related cell adhesion molecule-1,CEACAM1)和血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM1)。以上标记物参与肠黏膜损伤与修复,其中CEACAM1及VCAM1介导细胞粘附,CRP及SAA1与炎症相关,ANG1及ANG2参与血管生成,EMMPRIN、MMP1、MMP2、MMP3及MMP9则与基质重塑相关,TGFα为生长因子,IL-7参与免疫调节;EHI的诊断准确性良好,并且在疾病不同部位和表型之间保持一致,表明EHI能准确地评估CD患者内镜下疾病活动度和严重程度。研究显示MHI对评估小肠CD黏膜愈合优势明显,其预测回肠黏膜愈合的准确率为95%,敏感性和特异性分别为86%和98%[17]。另一项研究则评估其在术后复发预测中的价值,发现MHI与术后Rutgeerts评分显著相关[18]。未来需要将其与影像学检查下的疾病活动进行比较,并了解EHI/MHI在连续监测黏膜愈合方面的作用。
IL-6是判断CD疾病活动度的良好指标。陈丹等[19]的回顾性分析表明CD患者血清IL-6水平与克罗恩病疾病活动指数(CDAI)及疾病活动度呈正相关,当血清IL-6临界值为7.50 pg/ml时,判断疾病活动的灵敏性及特异性分别为80%、85.7%。血清IL-6水平对治疗反应及术后早期复发方面也有较好的预测能力。血清IL-35、IL-37、IL-9、IL-22水平均与疾病严重程度紧密相关,未来有希望成为新的生物学标记物。然而IL具有多效性,其血清水平在其他各种急慢性炎症中也可发生改变,且在个体间存在差异,仍需大样本量的前瞻性研究对IL评估CD治疗、预后的能力加以验证。
粪便标记物可以更准确地反映肠道黏膜炎症,因此越来越多地被用于筛查和评估CD活动性。有研究表明评估CD小肠受累应首选粪便钙卫蛋白(fecal calprotectin,FC)、粪便乳铁蛋白(fecal lactoferrin,FL)等粪便标记物[21]。
FC可有效评估CD患者的疾病活动程度,FC水平升高与内镜及影像学检查的炎症活动有良好相关性,然而相关性是否受病变部位的影响还未达成共识。有小样本研究发现,与结肠相比,FC在小肠病变中的灵敏度较差[22],而另一项小肠CD的研究则认为,FC水平与小肠炎症的内镜活动性显著相关,是可靠的内镜缓解替代标志物[23],因此需要更多前瞻性研究来评估FC监测小肠CD患者疾病活动度的价值。在Ye等[24]的研究中,FC预测小肠CD黏膜愈合有较高灵敏度(80%)和特异度(70%)。监测FC水平可指导优化CD临床决策,Dreesen等[25]发现FC浓度联合IFX药物血清谷浓度可指导药物剂量的调整并增加内镜下应答和缓解的可能性。FC还是预测停药后或术后复发及预后的敏感标志物。在一项前瞻性临床试验中,FC水平大于100 μg/g表示内镜复发,敏感性为89%,特异性为58%,由于其阴性预测值高,达91%,连续监测FC水平可对术后随访是否需行内镜检查提供参考[26]。FC是较敏感但特异性较低的标志物,不同研究中FC临界值波动较大(50~250 μg/g),在50 μg/g灵敏度最佳;而随着临界值增高,特异性增加。目前对于FC监测的理想临界值还没有达成共识,仍需进一步深入研究。在内镜监测小肠CD疾病相对受限、影像学频繁评估受限的情况下,粪便标记物可作为一线的疾病监测手段之一。
FL可有效监测CD患者肠道活动性炎症,是筛查CD患者小肠炎症的标记物。有研究结果显示,在评估小肠CD活动性方面,FL灵敏度为69%,特异度为79%;FC灵敏度为69%,特异度为82%;两者的价值相近[23]。研究表明FL与内镜活动性指数及炎性指标CRP之间相关性较高[27]。通过测定FL含量可以预测CD预后,FL水平持续升高亦是提示术后CD患者复发的良好预测指标,Wright等[28]的研究以内镜下复发为标准,发现CD术前FC、FL浓度较高,术后6个月浓度下降,且复发组浓度高于缓解组,证实FC(r=0.42,P<0.001,敏感性为0.87,特异性为0.66)、FL(r=0.306,P=0.008,敏感性为0.70,特异性为0.68)与CD复发相关;然而与FC相比,FL与CD复发相关性较弱。FL是评估药物治疗后黏膜愈合的可靠替代标志物。
在评估单纯回肠受累的CD时,粪便MMP9与内镜活动的相关性较FC更高[29],但研究样本量有限,需要对更大的患者队列进行深入研究。粪便免疫化学检测(fecal immunochemical test,FIT)是应用人血红蛋白的特异性抗体检测粪便中血红蛋白的含量,FIT和FC具有相似的识别黏膜愈合的功能,但与CD小肠病变相关性差[30],FIT和FC结合可提高预测黏膜愈合的诊断效能,敏感性为83%,特异性75%。S100A12是监测黏膜炎症的有用标记物,是由炎症组织本身产生的1种钙颗粒蛋白,有研究表明其在预测黏膜愈合方面,与FC相比具有更高的特异性(87%比70%)和等效敏感性(91%比90%)[31],在预测黏膜愈合方面具有较高的特异性和敏感性。粪新喋呤(neopterin,NP)、粪便CHI3L1、S100B等标记物目前研究较少,还需要大样本前瞻性研究进一步证明效果。
正确选择评估手段并采用适当的顺序可经济有效地评估小肠CD活动度,及时调整治疗策略,现提出适合临床实践的小肠CD评估指导流程。
出现可疑CD临床症状时,应首先行常规内镜检查(结肠镜、上消化道内镜),疑诊CD应通过影像学手段评估小肠是否受累;对于结肠镜检查阴性但炎性标记物异常的患者,可根据有无梗阻症状进行影像学或CE检查;对于病变局限在小肠者,可考虑BAE检查及活检。见图1。
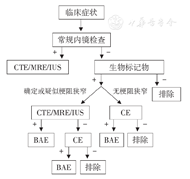

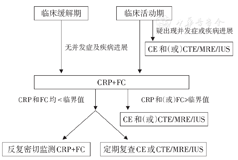
对于确诊小肠CD患者,需监测疾病活动度。首先考虑非侵入性评估方式,定期行CRP、FC评估。若FC和(或)CRP水平持续高于临界值且动态升高,应使用适当的影像学技术或内镜检查重新评估疾病活动性,优化治疗策略。对于儿童和年轻患者,多优先选择MRE或IUS。由于辐射暴露,CTE不是首选方法。见图2。

综上,小肠CD有其自身特点及诊治难点,准确及时的评估对患者的治疗和管理至关重要。除临床症状外,近年来影像学检查(IUS、CTE及MRE)、内镜检查(CE及BAE)、生物标记物等的发展提高临床医生对小肠病变的评估能力。结合每种评估方式的优势,制定合理的诊断和评估流程,可以准确评估小肠CD的疾病活动性,密切监测药物疗效,预测复发与缓解,从而制定适当的治疗策略,实现更好的患者管理。
所有作者均声明不存在利益冲突



























