
比较CT引导经皮与电磁导航引导经支气管微波消融治疗肺磨玻璃结节的有效性。
回顾性收集2018年1月至2020年10月首都医科大学附属北京朝阳医院胸外科及呼吸科收治的无法耐受手术的22例肺磨玻璃结节患者资料,男6例,女16例,年龄57~86(70.5±9.0)岁。患者经病理确诊为非小细胞肺癌(ⅠA期)。根据结节所在位置以及结节是否位于小气道旁选择给予CT引导经皮微波消融(CT组,17例)或电磁导航引导经支气管微波消融(电磁导航组,5例)。通过复查胸部CT评价病灶近期局部控制率,从而判定治疗的有效性,并对气胸、咯血、术后疼痛等手术并发症进行比较,评估其安全性。
两组患者的年龄、性别、病灶的大小、实性成分及病灶所在区域等基本情况差异均无统计学意义(均P>0.05)。两组在术后疼痛、气胸及咯血等常见手术并发症方面差异均无统计学意义(均P>0.05)。近期疗效评价方面,术后1个月复查胸部CT,电磁导航组病灶缩小的患者比例较CT组高(4/5比2/17),差异具有统计学意义(P=0.003);术后3个月复查胸部CT,两组病灶缩小的患者比例差异无统计学意义[15/17(88.2%)比5/5(100.0%),P=0.420]。
两种路径的微波消融治疗方法均可对已确诊的ⅠA期恶性肺磨玻璃结节达到良好的局部控制,电磁导航组治疗可以在术后1个月更早地判定治疗效果,常见并发症两组差异无统计学意义。

肺癌是世界范围内最常见的恶性肿瘤之一,其发病率及死亡率居恶性肿瘤之首。近年来通过使用低剂量胸部CT有效地对肺磨玻璃结节进行了筛检,推动了肺恶性肿瘤的早期发现、早期诊断及治疗,使其死亡率明显降低约20%[1],有效地提高了肺癌的总体治疗效果。但是目前Ⅰ~ⅢA期非小细胞肺癌(NSCLC)推荐的首选治疗手段仍是肺叶切除术,但是当今社会已经进入老龄化,出现了更多高龄、心功能不全等无法耐受手术的患者,他们需要更加微创的治疗。近年来越来越多的微创手段用于治疗ⅠA期NSCLC(T1N0M0)并取得了良好的效果,如立体定向体放疗[2]、近距离放疗[3]、光动力治疗[4]以及热消融治疗[5, 6]等。其中CT引导的微波消融治疗与胸腔镜肺叶切除在1~2年生存期及无疾病进展生存期上相似[7]。但在临床中开展的CT引导下经皮穿刺微波消融依然存在疼痛、气胸、胸腔积液、针道种植等并发症风险。近年来随着电磁导航支气管镜(ENB)的广泛应用,实现了电磁导航引导经支气管微波消融治疗技术的开展,不适症状及并发症有望进一步减低。本研究通过分析两种路径微波消融手段在患者病灶的局部控制效果及常见并发症,旨在评估这两种治疗方式的临床价值,为今后治疗选择提供有效参考。
本文为随访研究,回顾性分析2018年1月至2020年10月于首都医科大学附属北京朝阳医院胸外科及呼吸科经胸部CT发现的112例肺磨玻璃结节患者资料,其中51例从影像学方面考虑为早期肺癌,但因高龄、低心肺功能等无法耐受手术者给予了随诊观察、活检、局部干预等不同治疗手段。最终22例患者[男6例,女16例,年龄57~86(70.5±9.0)岁]在病理明确为非小细胞肺癌(ⅠA期)后分别接受了CT引导经皮(CT组,17例)或电磁导航引导经支气管(ENB组,5例)微波消融治疗。本次试验分组方法主要考虑操作技术因素并通过影像学评价。胸部CT可见明显小气道穿过瘤体或通过瘤旁且更靠近中心区域时选用ENB引导;胸部CT影像未见明显小气道穿过瘤体或通过瘤旁且更靠近外周三分之一时选用经皮CT引导。术前完善必要检查(血常规、凝血功能、心脏彩超等)。近期疗效评价主要通过影像学评价,患者术后行胸部高分辨CT观察肺结节大小变化。本研究通过首都医科大学附属北京朝阳医院伦理委员会审查和批准(2021-科-69)。
1. CT引导经皮微波消融治疗肺磨玻璃结节组:主要利用大孔径CT进行引导操作,微波消融利用水循环冷却系统微波电极天线,天线包括15 cm长针以及1.1 cm发射前极,控制2 450 MHz发射频率以及40~60 W输出功率。操作流程:患者术前行胸部薄层CT扫描,层厚为0.625 mm,根据病灶位置、大小、形态、其与叶间裂胸膜的关系以及肺内合并基础疾病(包括肺气肿和肺大泡等),设计胸壁至病灶的合理进针路径和进针点。根据预设穿刺路径给予患者适当体位并放置定位栅栏,行标准胸部CT扫描以确定穿刺层面,层厚3~5 mm。根据栅栏格确定穿刺点,常规消毒铺巾,行局部麻醉,穿刺针达到病变远端,再次扫描确认消融天线位于病灶远端,引导针向后2 cm为消融范围。根据病灶大小采用功率40~60 W进行6~9 min消融,结束消融后行全胸部CT扫描。
2.电磁导航引导经支气管微波消融治疗肺磨玻璃结节组:在ENB引导下利用导航外鞘管引导水循环冷却系统微波电极导管,导管总长1.2 m,控制2 450 MHz发射频率以及80 W输出功率。操作流程:规划术前导航路径,患者术前行胸部薄层CT扫描,层厚0.625 mm,在电磁导航系统上将患者的胸部CT以DICOM格式导入,重建形成虚拟支气管图像,根据CT上磨玻璃结节作为靶目标,在相应的虚拟支气管树图像中标示确定气道路径。手术需要在预设带有电磁导航系统的手术室内进行,给予单腔气管插管或喉罩全身麻醉。麻醉后行气管内导航。注册校正需要7个点位(主气管、隆突以及各叶开口),依据术前预设路径放置电磁导管到达靶目标近端,退出磁探头留置鞘管,经C型臂模拟CT(Xper CT)确认电磁导管套管定位已完成,放置消融导管,再次经Xper CT确认病灶位于消融天线探头范围之内,随即根据病灶大小采用功率80 W进行8~10 min消融,结束消融后行Xper CT确认。
1.并发症:两组治疗结束后严密观察患者各项生命体征及所出现的并发症。常见并发症及程度分级包括咯血(少量咳血:咳血量≤10 ml,仅痰中带血;大量咳血:咳血量>10 ml,可见整口鲜血),气胸,胸痛(疼痛分级表示0~10级)。
2.近期疗效评价:给予患者术后1、3个月复查胸部CT,确定治疗效果。
3.病理活检方式:主要有穿刺活检、ENB下活检钳活检或细胞刷检,组织或细胞学病理结果提示为至少非典型腺瘤样增生(AAH)不除外原位腺癌、原位腺癌以及微浸润腺癌(AAH~MIA)。
采用SPSS 22.0软件进行数据统计分析,符合正态分布的计量数据资料以表示,组间两两比较采用t检验;计数资料以例(%)的形式表示,组间两两比较采用χ²检验。双侧检验,检验水准α=0.05。
两组患者中胸部CT提示纯磨玻璃结节(pGGO)15例,混合结节(mGGO)7例;其中8 mm<肺结节≤10 mm者3例,10 mm<肺结节≤20 mm者17例,20 mm<肺结节≤30 mm者2例。本组6例病理结果提示至少AAH不除外原位腺癌,考虑病理获取量主要是依靠刷检的细胞学诊断,不能完全除外原位癌可能,由此临床上按照原位癌处理。
本组患者的年龄、性别、病灶的大小、实性成分及病灶所在区域等基本数据两组差异无统计学意义(均P>0.05)。全组14例患者术后存在疼痛感,多为轻度疼痛;11例患者术后出现气胸,其中6例放置引流管;7例患者手术出现痰中带血,均为少量血丝,未出现咯整口鲜血。手术后对患者进行近期疗效评价:术后1个月复查胸部CT,电磁导航组病灶缩小的患者比例较CT组高(4/5比2/17),差异具有统计学意义(P=0.003);术后3个月复查胸部CT,两组病灶缩小的患者比例差异无统计学意义[15/17(88.2%)比5/5(100.0%),t=0.057,P=0.420](表1)。
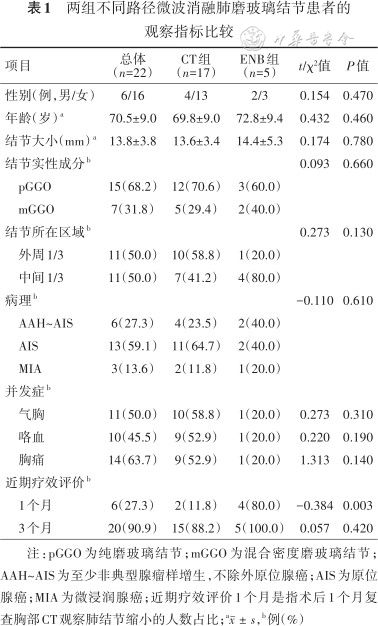
两组不同路径微波消融肺磨玻璃结节患者的观察指标比较
两组不同路径微波消融肺磨玻璃结节患者的观察指标比较
| 项目 | 总体(n=22) | CT组(n=17) | ENB组(n=5) | t/χ²值 | P值 |
|---|---|---|---|---|---|
| 性别(例,男/女) | 6/16 | 4/13 | 2/3 | 0.154 | 0.470 |
| 年龄(岁)a | 70.5±9.0 | 69.8±9.0 | 72.8±9.4 | 0.432 | 0.460 |
| 结节大小(mm)a | 13.8±3.8 | 13.6±3.4 | 14.4±5.3 | 0.174 | 0.780 |
| 结节实性成分b | 0.093 | 0.660 | |||
pGGO | 15(68.2) | 12(70.6) | 3(60.0) | ||
mGGO | 7(31.8) | 5(29.4) | 2(40.0) | ||
| 结节所在区域b | 0.273 | 0.130 | |||
外周1/3 | 11(50.0) | 10(58.8) | 1(20.0) | ||
中间1/3 | 11(50.0) | 7(41.2) | 4(80.0) | ||
| 病理b | -0.110 | 0.610 | |||
AAH~AIS | 6(27.3) | 4(23.5) | 2(40.0) | ||
AIS | 13(59.1) | 11(64.7) | 2(40.0) | ||
MIA | 3(13.6) | 2(11.8) | 1(20.0) | ||
| 并发症b | |||||
气胸 | 11(50.0) | 10(58.8) | 1(20.0) | 0.273 | 0.310 |
咯血 | 10(45.5) | 9(52.9) | 1(20.0) | 0.220 | 0.190 |
胸痛 | 14(63.7) | 9(52.9) | 1(20.0) | 1.313 | 0.140 |
| 近期疗效评价b | |||||
1个月 | 6(27.3) | 2(11.8) | 4(80.0) | -0.384 | 0.003 |
3个月 | 20(90.9) | 15(88.2) | 5(100.0) | 0.057 | 0.420 |
注:pGGO为纯磨玻璃结节;mGGO为混合密度磨玻璃结节;AAH~AIS为至少非典型腺瘤样增生,不除外原位腺癌;AIS为原位腺癌;MIA为微浸润腺癌;近期疗效评价1个月是指术后1个月复查胸部CT观察肺结节缩小的人数占比;a,b例(%)
CT引导经皮微波消融病例:患者男,81岁,体检发现右肺上叶磨玻璃结节3年,近3个月增大,于2018年10月入院。查胸部CT提示:右肺上叶磨玻璃结节大小约10 mm×9 mm,既往高血压、冠心病、脑梗死病史,一侧肢体活动不利,低肺功能。考虑患者手术风险较高,建议微波治疗。术前行CT引导下肺穿刺活检,病理提示:肺原位癌。进一步给予患者CT引导下经皮微波消融,给予60 W进行6 min消融治疗。术中复查CT提示少量气胸,肺压缩约为10%,未予处理。术后1天复查胸片气胸已吸收,医嘱出院。术后3个月复查胸部CT,可见病灶瘢痕挛缩(图1、2)。


电磁导航引导经支气管微波消融病例:患者女,65岁,体检发现右肺上叶磨玻璃结节1年,近3个月增大,于2020年7月入院。查胸部CT提示:右肺上叶前段磨玻璃结节大小约11 mm×10 mm,既往高血压病史。病灶位于右肺上叶前段亚段开口,考虑病灶位置及切缘需要切除右肺上叶,由此会导致肺功能损失较大,患者故拒绝手术。笔者团队决定给予患者电磁导航引导经支气管微波消融治疗。患者行ENB,在电磁导航下经支气管行细胞刷检,术中快速病理提示:至少AAH不除外原位腺癌,再次活检钳抓检术后病理进一步证实。进一步在电磁导航下经支气管放置消融电极导管,术中经Xper CT确认病灶位于消融天线探头范围之内,给予80 W进行8 min。复查Xper CT未见明显气胸及胸腔积液。术后一天复查胸片未见异常,医嘱出院。术后1个月复查胸部CT,可见病灶缩小明确(图3、4)。
随着低剂量胸部计算机断层扫描(LDCT)在健康检查中的应用越来越广泛,更多的无症状人群中发现肺结节。结节≥8 mm、复查CT结节增大、结节内实性成分增加等可疑为早期肺癌的结节,手术切除病灶并行淋巴结清扫仍是首选的治疗方法。但是随着人口老龄化的出现越来越多的NSCLC患者由于高龄、心肺功能差等原因不能耐受手术。
局部热消融作为一种局部治疗手段,具有对周围正常组织损伤小、术后恢复快等优点[8],在ⅠA期NSCLC治疗中可以达到和手术相同的效果[9]。微波消融治疗是近几年兴起的肺肿瘤局部微创治疗技术之一。由于时间短以及热沉降效应等因素使得周围正常组织受到的损伤非常小,从而可以治疗更邻近较大血管肺肿瘤,在临床上有效提高了治疗的稳定性和安全性[10],针对较大肿瘤扩大消融面积可以有效降低消融不足的风险,并降低肿瘤消融后的复发率,因此在肺恶性肿瘤消融治疗中更具优势[11]。此外有观点认为热消融导致大量抗原的释放,从而触发各种免疫细胞的聚集、分化和激活[12],进而诱发下游免疫反应产生肿瘤特异性免疫,进一步消除在消融后存活下来的残余肿瘤细胞。
本组病例疗效评价主要采集术后影像复查结果进行评估。本次试验术后1个月复查胸部CT存在差异,ENB组病灶缩小更加明确,3个月复查胸部CT两组治疗后缩小已无明显差异。考虑可能原因如下,首先,术后1个月患者治疗部位通常存在局部水肿,CT组由于穿刺针对针道及病灶周围的穿刺损伤加重局部组织水肿,在胸部平扫CT不易鉴别,由此导致疗效评价时部分肺结节未出现缩小,而3个月复查时水肿造成的影响已经基本消失;此外,ENB组是通过导航令消融天线沿气道进入,消融治疗结束后此通道可以便于分泌物等由此快速排出,可以使局部水肿快速消失,影像可见更早地看到明确的瘢痕挛缩。本组中部分随访超过1年的患者的胸部CT病灶瘢痕已经固定。由于随访时间较短,本组病例没有对无疾病进展生存期以及总生存期进行统计学分析,将在随后的报道中进一步总结。
肺肿物热消融的并发症较常见的并发症包括气胸、胸腔积液、咯血和肺炎等;此外还有一些少见并发症,部分可引起死亡,须引起重视[13]。本组中出现最多的并发症是胸痛,约占63%,与其他文献报道相似。胸痛患者主要出现在CT组,可能由两种原因导致。首先,CT引导穿刺是在局部麻醉下完成,而ENB组是全身麻醉进行,患者的治疗体验完全不同。之前在临床中尝试给予CT引导穿刺患者在消融时静脉麻醉辅助镇痛,但临床中由于需要选择穿刺点及入路需要改变体位时则无法辅助镇痛。其次,疼痛的另一因素是患者出现气胸后刺激胸膜引起,对于需要放置引流的患者引流管会加重刺激。本组中给予部分出现气胸的患者放置胸腔闭式引流,全部选用了细引流管(深静脉导管),其主要优势在于此导管较细,于穿刺点应用导丝放入,不再给患者增加新的创面;且导管较软,在胸腔内减少刺激引发的疼痛。
本组中出现的另一并发症是气胸。气胸是肺肿瘤射频消融最常见的并发症,发生率10%~61.1%[13]。本组发生率同样较高约50%,其中CT组出现的例数较多,但多为少量气胸,患者临床症状较轻,多数未予特殊处理。仅有2例症状较重者与另外3例气胸较多者术后放置细引流管(深静脉导管18 G)给予引流,连接胸腔闭式引流瓶2~5 d好转后拔除。发生气胸与穿刺针穿破胸膜有关,通常由于肺压缩较小无需干预,临床症状和气胸较重者考虑与患者自身存在肺基础疾病有关,临床上多见慢性阻塞性肺疾病和间质纤维化等。此外ENB组出现的1例气胸,考虑可能是病灶距离叶间裂胸膜较近、消融损伤叶间裂胸膜导致,经放细引流后好转。此外需要注意两点,其一对于同期进行活检的患者建议使用同轴套管技术,减少反复穿刺造成的胸膜创伤增加气胸发生风险;其次需要注意术后1 d复查胸片,避免迟发性气胸的出现。
本组中出现的另一并发症是咯血,均出现在术后,且均为痰中带血丝,未见大咯血患者。咯血主要考虑穿刺损伤导致,也存在局部消融之后出现的局部组织渗出导致。也有专家认为咯血与穿刺针在肺内穿行的距离有关。因此在制定路径时需要注意缩短在正常肺组织中穿行的距离,同时规避血管,减少损伤。如果术中出现咯血或术后出现大咯血需要复查CT,必要时给予介入或外科手术积极干预。
本研究也存在一定的局限性:ENB组病例数较少;由于开展时间相对较短,病例选择上可能存在一定的偏倚。随着技术的成熟、病例的累积,将会继续对两种技术方法做进一步的评价。
综上,本研究的初步结果显示,两种路径的微波消融治疗方法均可对已确诊ⅠA期恶性肺磨玻璃结节达到良好的减瘤效果,两组手术均出现了相似的并发症。ENB组治疗结果显现更早(术后1个月),但是由于术后观察时间较短尚未得出生存期的对比数据。
所有作者均声明不存在利益冲突



























