
评述了目前在全世界范围内被批准紧急使用的几种新型冠状病毒肺炎(新冠肺炎)疫苗的安全性、免疫原性和有效性,以及疫苗研发和接种可能面临的挑战。新冠肺炎疫苗采用的技术有基于mRNA,腺病毒载体的基因工程疫苗和传统的灭活病毒疫苗。疫苗的有效性从60%~95%左右。由于疫苗急迫的开发和匆促的批准使用,疫苗的安全性、保护作用持续的时间,免疫学机制,对病毒变异株感染的保护作用等都还需要更多的研究和观察。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
2019年底开始爆发的新型冠状病毒肺炎(新冠肺炎)已经在全球大流行超过1年。这场对全球人类社会导致巨大健康、生命和经济影响的传染性疾病,在全球范围内仍没有被有效地控制。由于目前仍没有针对新冠肺炎有效的治疗药物。疫苗成为了控制新冠肺炎流行的唯一希望。研发疫苗是当前全球应对新冠肺炎大流行的急迫需要。目前已有多种疫苗在我国及全球范围内批准紧急授权使用。疫苗的研发和使用甚至成为国家之间的竞争,成为了新闻的热搜词。但是在一些自媒体上充满着许多不客观、不科学的信息。这里将公开发表在国际著名学术期刊上的疫苗研发进展综述如下,以飨读者。
新冠肺炎病毒被世卫组织(WHO)命名为"严重急性呼吸系统综合征冠状病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)"。SARS CoV-2通过其刺突蛋白(S蛋白)与宿主细胞的乙酰胆碱酯酶2(acetylcholinesterase 2,ACE2)受体结合进入人体,感染人体发病。因此,病毒的S蛋白是目前开发疫苗的关键靶点。
过去,一种新的疫苗研发包括动物实验(临床前实验)、Ⅰ、Ⅱ、Ⅲ期临床和审批等阶段,通常需要数年,甚至10年以上。鉴于新冠肺炎大流行的严重危害,全球迫切需要有效的疫苗。过去的常规研发流程已经不能满足形势的需要,研发进度被极大地提速。现将世界上主要的几种疫苗研发的过程和进展介绍如下。
2020年6月中国康希诺生物公司与军事医学科学院陈薇院士团队合作研究开发的Ad5-nCoV疫苗1期试验结果发表[1]。这是全球最早发表的新冠病毒疫苗临床研究结果。随后,中国、英国和美国等国家的多种疫苗临床研究结果陆续在国际顶级的学术期刊发表[2,3,4,5]。
当大家把目光聚焦中美英的疫苗研究开发竞争之时。俄罗斯卫星疫苗Ⅴ在2020年8月被俄罗斯政府批准紧急使用,成为全球首款被批准紧急使用的SARS-CoV-2疫苗。2020年12月11日美国FDA批准辉瑞疫苗紧急使用授权,1周后又批准了莫德纳疫苗mRNA-1273紧急使用授权。同月,英国阿斯利康疫苗和我国国药集团的疫苗也得到有关当局批准紧急使用。2021年2月强生公司和我国科兴和康希诺疫苗也被批准有条件地使用。
如此密集地批准一种疫苗的使用,前所未有。鉴于形势所迫,各国药品监管机构,普遍采用滚动跟进的方式审批,允许药企一边申报,一边试验和补充数据,极大地缩短了疫苗的审批时间。
疫苗研究开发的1~2期试验为验证安全性和免疫原性(即疫苗在健康受试者产生免疫反应的情况)。3期试验则是验证疫苗的有效性,即观察疫苗保护接种者免于新冠病毒感染的效力。在这场疫苗竞赛中,辉瑞公司最快发表了他们的3期临床试验结果[6]。紧随其后,莫德纳、阿斯利康、俄罗斯的疫苗3期试验结果也相继发表[7,8,9,10]。我国最早发表1/2期数据,但是3期试验则落后于国外。其原因是国内疫情已经基本控制,无法开展3期临床试验,只能到国外进行,拖延了3期试验的进度。
目前被批准使用的SARS-CoV-2疫苗采用的技术主要有4类,即RNA、腺病毒载体、灭活病毒和重组蛋白。
这是全新的疫苗技术,采用了脂质纳米颗粒包裹病毒的S蛋白mRNA。疫苗将S蛋白mRNA带入接种者体内,转录和产生病毒的S蛋白,诱导机体的免疫反应,特异性地阻断病毒S蛋白与人体内的ACE2受体结合,保护人体免于病毒感染。这类疫苗的代表为辉瑞和莫德纳疫苗。在1/2期试验中,辉瑞和莫德纳疫苗接种者体内产生的保护抗体水平都可以达到或超过作为对照的新冠肺炎患者恢复期血清抗体水平[5]。莫德纳疫苗3期数据显示疫苗有效率为94.1%[8]。
辉瑞疫苗1~3期试验的数据[4,5,6]显示,疫苗的有效率为95%。2021年2月还发表了在以色列真实世界中应用的结果[11],该研究有1 163 534例接种者参与,疫苗有效率达90%以上。客观地讲,辉瑞疫苗技术最为先进,发表的研究数据最多。此外,辉瑞疫苗也是第一个得到WHO紧急使用认可的疫苗。
该技术利用腺病毒作为载体将SARS-CoV-2的S蛋白基因导入人体,诱导人体对SARS-CoV-2产生免疫。埃博拉疫苗就是腺病毒载体技术成功的范例。目前已获批的腺病毒载体疫苗有中国康希诺、阿斯利康/牛津、俄罗斯卫星Ⅴ、强生公司等几种。
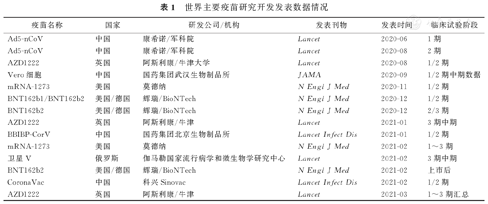
世界主要疫苗研究开发发表数据情况
世界主要疫苗研究开发发表数据情况
| 疫苗名称 | 国家 | 研发公司/机构 | 发表刊物 | 发表时间 | 临床试验阶段 |
|---|---|---|---|---|---|
| Ad5-nCoV | 中国 | 康希诺/军科院 | Lancet | 2020-06 | 1期 |
| Ad5-nCoV | 中国 | 康希诺/军科院 | Lancet | 2020-08 | 2期 |
| AZD1222 | 英国 | 阿斯利康/牛津大学 | Lancet | 2020-08 | 1/2期 |
| Vero细胞 | 中国 | 国药集团武汉生物制品所 | JAMA | 2020-09 | 1/2期中期数据 |
| mRNA-1273 | 美国 | 莫德纳 | N Engl J Med | 2020-11 | 1/2期 |
| BNT162b1/BNT162b2 | 美国/德国 | 辉瑞/BioNTech | N Engl J Med | 2020-12 | 1/2期 |
| BNT162b2 | 美国/德国 | 辉瑞/BioNTech | N Engl J Med | 2020-12 | 2/3期 |
| AZD1222 | 英国 | 阿斯利康/牛津 | Lancet | 2021-01 | 3期中期 |
| BBIBP-CorV | 中国 | 国药集团北京生物制品所 | Lancet Infect Dis | 2021-01 | 1/2期 |
| mRNA-1273 | 美国 | 莫德纳 | N Engl J Med | 2021-02 | 1~3期 |
| 卫星V | 俄罗斯 | 伽马勒国家流行病学和微生物学研究中心 | Lancet | 2021-02 | 3期中期 |
| BNT162b2 | 美国/德国 | 辉瑞/BioNTech | N Engl J Med | 2021-02 | 上市后 |
| CoronaVac | 中国 | 科兴Sinovac | Lancet Infect Dis | 2021-02 | 1/2期 |
| AZD1222 | 英国 | 阿斯利康/牛津 | Lancet | 2021-03 | 1~3期汇总 |
腺病毒载体疫苗的缺点是人类大多感染过腺病毒,体内存在抗腺病毒抗体,有所谓的"预存免疫"。接种这种疫苗后预存免疫会攻击疫苗、降低疫苗的作用。为了减少人体预存免疫的影响,阿斯利康使用改良的黑猩猩腺病毒载体,俄罗斯卫星疫苗Ⅴ则用重组缺陷型腺病毒rAd 26和rAd 5型两组病毒作为载体,将其分别用于初免-加强免疫接种,这样可以使接种人预存免疫效应最小化。中国康希诺和强生公司则采用传统的人腺病毒载体技术。
我国康希诺疫苗在巴基斯坦等多国进行3期临床试验。最近,巴基斯坦卫生官员宣布,Ad5-nCoV在巴国进行的3期临床试验中期分析结果显示,单针接种后,该疫苗总体保护效力为74.8%。强生公司疫苗的技术方法与我国康希诺相似,疫苗对中度和重度Covid-19联合终点的保护效力为66%。
俄罗斯卫星疫苗Ⅴ的3期临床试验的中期数据显示[7],疫苗组和安慰剂组新冠肺炎感染率分别为0.1%(16/14 964例)和1.3%(62/4 902),总保护效力为91.6%。卫星疫苗Ⅴ良好的保护效力可能与其新颖的疫苗技术有关。
阿斯利康疫苗还有一组让科学家们疑惑不解的临床试验结果。阿斯利康疫苗有一项两种不同剂量方案临床试验数据。接种方案都是两剂注射,一组为半量/全量,另一组为全量/全量方案。结果让人大跌眼镜,前者的疫苗保护效力为90%,后者则仅为60%[12]。此外,阿斯利康疫苗一项单剂量注射标准剂量90 d内的有效率为76.0%,也高过两次标准剂量注射的有效性。当然,同一种疫苗在不同国家、不同时期有效性的差异是可以理解的。但是,半量/全量方案显著优于全量/全量方案则很难解释其原因,推测可能与其使用的独特的腺病毒载体有关[12]。
阿斯利康疫苗采用新设计的病毒载体,试验中没有发现接种者产生抗病毒载体的抗体,这是阿斯利康疫苗的"亮点"。但是,阿斯利康疫苗接种后极少数人发生了血小板减少和血栓形成的致死性严重不良事件,给这款疫苗的应用蒙上了阴影。
因为疫情肆虐,疫苗的研究开发也受到政治因素的影响,迫于各种压力,疫苗的研究开发进展被大大提速,一些常规的研究开发环节被省略,1~2期合并进行,3期试验尚没有完成,就匆忙批准疫苗使用等等。这些行动都是保护人类健康和生命的需要,新冠肺炎导致全球的生命逝去已经超过300万。权衡利弊,急迫地将候选疫苗投入使用是可以理解的。不过,快速投入使用的疫苗带来潜在的隐患也不可忽视。
关于疫苗的安全性是比较热门的话题。从正式发表的临床试验数据看,轻中度的不良反应比较常见,发生率最高的报道可达80%的接种者,严重的不良事件发生率较低(1%~10%)。通常年轻人比老年人不良反应更常见。这可能与年轻人的免疫应答更强烈有关。
最受关注的是阿斯利康疫苗接种后发生的血栓和出血严重不良事件。根据Greinacher等[18]报道,在接种疫苗后5~16 d,有11例发生了严重的血栓和出血的不良事件。其中致命性颅内出血1例、脑静脉血栓9例,内脏静脉血栓3例,肺栓塞3例,其他血栓4例、弥散性血管内凝血5例(相同患者可有多种事件),共6例死亡。这些患者呈抗血小板因子4抗体阳性,他们体内存在血小板因子4依赖性的血小板活化。这种疫苗导致的血栓性血小板减少,其临床特征类似于自身免疫性肝素诱导的血小板减少症,被称为"免疫血栓性血小板减少(immune thrombotic thrombocytopenia,ITT)综合征。美国强生疫苗也发生了1例ITT,强生疫苗也采用的腺病毒载体疫苗。阿斯利康疫苗接种后的ITT发生率大约为1/100万。为什么极少数人会发生这种严重的不良事件,疫苗的什么成分导致ITT发生目前还不清楚。新近,欧盟已经认定ITT为阿斯利康疫苗接种后的罕见不良事件,但并没有禁用阿斯利康疫苗,只是提醒如果接种该疫苗后发生类似症状的患者应该尽早就医。
接种疫苗后的死亡事件曾经被一些媒体大肆炒作。从学术期刊正式发表的结果看,辉瑞疫苗试验中发生疫苗组2例、安慰剂组4例死亡。莫德纳疫苗试验中疫苗组2例死亡,安慰剂组3例。阿斯利康疫苗试验中发生对照组3例,疫苗组1例死亡。从整体上看,疫苗组的死亡与安慰剂对照组没有明显差别。对疫苗被批准使用后发生的接种后死亡事件,仅阿斯利康疫苗被认定与发生的ITT死亡有关。因此,对接种疫苗发生的死亡也应该客观、科学地看待,让专业权威机构去对死亡原因下结论。
SARS CoV-2疫苗作用机制仍不完全清楚。产生中和抗体是疫苗保护人群免受病毒感染的重要机制,但并不是其全部机制。目前疫苗产生的保护抗体可以在体内存在多长时间仍不清楚。因为研究开发疫苗的急迫性,所有试验观察的时间都不长。阿斯利康疫苗在探索性分析中,观察了单一标准疫苗剂量接种后90天内的有效性为76.0%。辉瑞疫苗仅观察了2个月的有效率。从免疫学角度讲,细胞免疫产生的保护作用比体液免疫更长久,但是对SARS CoV-2疫苗产生的保护性细胞免疫作用还所知甚少。
新的疫苗开发技术,尤其是RNA基因工程技术疫苗带来了更高的免疫保护效应,但这些技术是否诱导机体有害的附加免疫反应,例如腺病毒载体疫苗接种后发生的ITT等仍需要更多研究。
目前SARS CoV-2正在以很快的速度发生变异,发生在病毒S蛋白上的变异已经增强了病毒的感染性。当人类用疫苗对抗病毒之时,SARS CoV-2对疫苗产生免疫逃逸的突变也随时可能发生,新近报道,在美国417例接种过2剂辉瑞或莫德纳疫苗的人之中发现2例所谓"突破性感染"[19]。称为"突破性感染",是因为被感染者已经接种了疫苗,而且体内也产生了高滴度的抗体水平,但仍然被感染。
有人预言新冠肺炎病毒可能会像流感病毒一样与人类长期共存,疫苗的作用有限。这种观点有些悲观。从美国、英国等国家接种疫苗后感染人数的大幅减少,看到了疫苗的作用。但是,我们也不应该盲目乐观,认为"苗到疫止"。人类与新冠病毒的斗争不会嘎然截止,抗疫仍需努力。
所有作者均声明不存在利益冲突



























