
胃癌在我国的发病率和死亡率均居高不下,免疫治疗有望改善其预后。胃癌分子分型作为胃癌分子诊疗的重要组成内容,是根据基因、免疫微环境等多个层面对胃癌患者进行精准分类,有助于筛选免疫治疗获益人群。本文就胃癌的分子诊断与免疫治疗的相关内容作一评述。

胃癌是最常见的消化道恶性肿瘤之一,在全球肿瘤死亡原因中排名第3位[1]。我国胃癌发病率和死亡率均位居前3位,2015 年新发胃癌40.3万,占全世界的45%以上[2]。胃癌具有高度异质性,手术、放化疗等传统手段对胃癌的疗效有限,且多数胃癌初诊时已处于中晚期,预后极差[3]。胃癌分子分型作为胃癌分子诊断的重要内容,根据其基因、肿瘤免疫微环境(TiME)等特征,可对胃癌免疫治疗优势人群的界定和筛选提供指导意义。本文就胃癌的分子诊断与免疫治疗的相关内容展开述评。
1.经典病理分型:经典的胃癌病理分型主要依据大体及组织学形态,以及细胞生物学特性进行分类,包括Borrmann分型、Lauren分型和世界卫生组织(WHO)分型。Borrmann分型将胃癌分为息肉型、局限溃疡型、浸润溃疡型和弥漫浸润型;Lauren分型是目前国际上广泛应用的病理分型体系,从形态学上将胃癌分为肠型、弥漫型和混合型,其中弥漫型预后最差[4]。WHO分型将胃癌分为乳头状腺癌、管状腺癌、黏液腺癌、印戒细胞癌、鳞腺癌、鳞状细胞癌、小细胞癌和未分化癌。但对于指导精准化免疫治疗或靶向药物仍需结合进一步的分子特征。
2.美国国家癌症研究所(TCGA)分子分型:近年来随着分子诊断技术的发展,特别是高通量测序和基因芯片技术的发展,提出了一些新的胃癌分子分型策略。2014年根据癌症基因组图谱(TCGA)计划工作的研究成果[5],利用包括全外显子测序(WES)等6种技术平台,分析了来自全球多中心的从未接受过放疗或化疗的295例患者的新鲜冰冻组织及血液样本,提出4种分子亚型:EB病毒感染型(EBV)、微卫星不稳定型(MSI)、染色体不稳定型(CIN)以及基因组稳定型(GS)。其中,EBV型和MSI型是免疫治疗可能获益类型,而CIN和GS型对免疫治疗发生反应的可能性较小。
(1)EBV型:约占8.8%,男性多见(82%),主要见于胃底和胃体(62%);PIK3CA是最常见的突变基因(80%),其他常见的突变基因包括:ARID1A和BCOR,而TP53突变罕见。此外,DNA超甲基化水平非常高,且在所有EBV感染的病例中都发现了CDKN2A启动子高甲基化导致p16失活,而CDKN2A被认为是胃癌中最重要的抑癌基因之一。此外,JAK2、CD274[即细胞程序性死亡-配体1(PD-L1)]、PDCD1LG2(即PD-L2)和酪氨酸激酶受体(ERBB)2即人表皮生长因子受体(HER-2)扩增,以及PTEN、SMAD4、CDKN2A和ARID1A缺失也常发生。
(2)MSI型:TCGA中第二常见亚型,约占21.7%,多见于老年女性,好发于胃窦或幽门,具有较高的突变率,主要为PIK3CA、ERBB2、ERBB3和表皮生长因子受体(EGFR),以及在其他肿瘤常见的热点基因。富含DNA超甲基化,包含MLH1基因启动子超甲基化,导致MLH1错配修复蛋白沉默表达,被认为是造成MSI型病例的主要原因。
(3)CIN:TCGA研究中的大部分胃癌属于此类,约占50%,常见于胃食管交界处和贲门,多属Lauren分型中的肠型,老年人多见。最为常见的基因变异为TP53突变(73%),此外,具有大量ERBB扩增,包括血管内皮生长因子 A (VEGFA)、EGFR、ERBB2、ERBB3、c-Met和编码细胞周期相关的基因,如CCNE1、CCND1和CDK6等,为靶向治疗提供了潜在靶点。
(4)GS:约占20%,初诊年龄偏低,多属Lauren分型中的弥漫型;CDH1(26%~37%)和RHOA(15%)基因突变频率高。此外,与RHOA活性相关的RHO家族GTP酶活化蛋白基因融合现象(CLDN18-ARHGAP融合)也较为常见,约占30%,通常RHOA突变和CLDN18-ARHGAP融合互相排斥。GS型一般缺少免疫原性和可靶向的驱动基因突变,主要以细胞毒化疗作为治疗手段。
3. 亚洲癌症研究组织(ACRG)分子分型:2015年发表于Nature Medicine上的由ACRG发起的一项共纳入300例胃癌患者的分子分型研究,根据MSI状态、TP53功能和上皮-间充质转化(EMT)分为4个亚型:MSI-H、MSS/TP53+、MSS/TP53-和MSS/EMT[6]。ACRG与TCGA分类有部分交叉(表1),不同之处在于ACRG不同亚型与临床结果更为相关,各型特征如下:(1) MSI-H(22.7%):该型多发于胃窦(75%),>60%为肠型,诊断时多为早期,预后最佳。有过度甲基化,尤其是编码KRAS、PI3K-PTEN-mTOR途径、ARID1A、ERBB2、ERBB3和ALK基因,该型患者预后最好;(2)微卫星稳定(MSS)/TP53+(26.3%):此型有更高EBV感染率,除有TP53途径活化,还有抗原呈递细胞(APC)、ARID1A、KRAS、PI3KCA和SMAD4突变,该型患者预后较好;(3) MSS/TP53-(35.7%):该型TP53突变率最高(60%),可能是TP53功能缺失的主要原因。有更多的非整体改变和再现性MDM2、ROBO2、GATA6、MYC、ERBB2、EGFR、CCNE1和CCND1扩增,该型患者预后较差;(4) MSS/EMT(15.3%):多为弥漫型,此型的基因改变与细胞黏附和活动性有关。多发于年轻患者,诊断时多为进展期,复发概率高,腹膜传播率高预后最差。
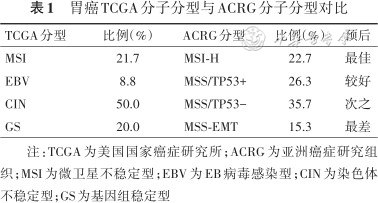
胃癌TCGA分子分型与ACRG分子分型对比
胃癌TCGA分子分型与ACRG分子分型对比
| TCGA分型 | 比例(%) | ACRG分型 | 比例(%) | 预后 |
|---|---|---|---|---|
| MSI | 21.7 | MSI-H | 22.7 | 最佳 |
| EBV | 8.8 | MSS/TP53+ | 26.3 | 较好 |
| CIN | 50.0 | MSS/TP53- | 35.7 | 次之 |
| GS | 20.0 | MSS-EMT | 15.3 | 最差 |
注:TCGA为美国国家癌症研究所;ACRG为亚洲癌症研究组织;MSI为微卫星不稳定型;EBV为EB病毒感染型;CIN为染色体不稳定型;GS为基因组稳定型
4.基于蛋白组学的分子分型:近年来,对于蛋白组学应用于胃癌分子分型的研究也有新的突破。Ge等[7]研究发现对84 对胃癌与癌旁组织蛋白组学表达谱进行分析,可将弥漫型胃癌分为3个分子亚型,分别是细胞周期型(PX1)、上皮-间充质转化型(PX2)和免疫通路富集型(PX3),这3个亚型与生存预后和化疗敏感性密切相关。(1)PX1型,富含细胞周期调控蛋白的异常表达,基因突变数目最少,总生存时间最长;(2) PX2 型,表现出上皮-间充质转化的蛋白质调控异常,生存预后介于PX1 和PX3 之间;(3) PX3,肿瘤组织高表达的蛋白富集在免疫相关和EMT 相关通路,总生存时间最短,并且该组患者对化疗不敏感。PD-L1/PD-1在弥漫型胃癌中鲜有表达,免疫疗效的预测价值有限。然而,IDO1、ARG1和CD47/SIRPA等在内的多种免疫相关蛋白在弥漫型胃癌中表达较高,尤其在PX3肿瘤组织中显著高表达,且表达量与生存时间显著负相关,或可成为免疫治疗的候选靶标。
本期报道的钾电压门控通道亚家族C成员3 (KCNC3)在胃癌组织中高表达可作为胃癌患者预后差的独立影响因素,也可为靶向治疗提供潜在的标志物[8]。本期的另一研究也显示整合素5在胃癌中高表达并作为促癌因子发挥作用,也为寻找胃癌潜在治疗靶点提供了理论依据[9]。
5.基于肿瘤微环境的免疫分型:TiME是免疫治疗发挥疗效的基础[10],肿瘤浸润性淋巴细胞(TILs)作为主要的效应系统,大体可以分为两种,一种是可以发挥杀伤肿瘤作用的免疫细胞,如:CD8+T、自然杀伤细胞(NK)和NKT细胞;另一类则是发挥抑制免疫细胞杀伤肿瘤功能的细胞,如:Treg和 M2型巨噬细胞。其中,研究最多也广泛被认可的是CD8+T细胞的浸润,可依据其浸润程度将TiME分为三大免疫表型[11]:免疫浸润型、免疫排斥型以及免疫沙漠型。在免疫浸润型肿瘤中,CD8+T细胞可以浸润到肿瘤内部;免疫排斥型肿瘤中,虽然也有较高的CD8+T细胞浸润程度,但都是集中在肿瘤外围;而免疫沙漠型肿瘤中很少有CD8+T细胞的浸润。进一步的研究发现,免疫浸润型肿瘤内部可表达较高的组织相容性复合物(MHC)-Ⅰ类分子,而另外两种类型的肿瘤中却MHC-Ⅰ类分子的表达明显降低;因此,免疫浸润型被认为是免疫治疗发挥抗肿瘤效应的优势亚型。
然而,仅应用TILs的浸润而不考虑PD-L1表达可能会降低疗效预测的准确性,Sanmamed和Chen[12]结合TILs和B7-H1 (PD-L1)表达水平,将TiME分为4类免疫亚型:(1)Ⅰ型是PD-L1-/TILs-的肿瘤,由于免疫细胞不聚集在肿瘤部位,被认为是没有免疫治疗获益基础的。(2)Ⅱ型具有PD-L1+/TILs+的肿瘤,拥有阻断的靶点以及效应的细胞,是免疫治疗最有效的亚型。(3)Ⅲ型是PD-L1-/TILs+的肿瘤,有TILs的存在,IFN-γ的产生在TiME中不能诱导PD-L1的表达,那么阻断PD-1/PD-L1通路并不能恢复TILs杀伤肿瘤的能力。(4)Ⅳ 型是PD-L1+/TILs-分子亚型,肿瘤细胞固有PD-L1的表达,或可能通过其他的通路诱导肿瘤细胞中PD-L1的表达,若肿瘤细胞周围没有TILs的浸润,这一类型的肿瘤如果仅仅加用PD-1抑制剂获益可能性比较小。具有Ⅱ型TiME的肿瘤是真正意义上的“热肿瘤”,其比率在所有癌种中占24%左右,与PD-1单药治疗晚期恶性肿瘤的有效率相当。是否可以通过不同的策略,如联合其他不同机制的治疗,将其他免疫类型从“冷肿瘤”转化为“热肿瘤”,提高免疫治疗的疗效,让更多的患者获益,是目前研究的热点方向之一。
相较于免疫治疗在其他瘤种中的迅猛发展,胃癌的免疫治疗之路历经坎坷,从三线治疗中免疫单药不尽如人意的结果,到如今直接进入一线治疗,诠释着胃癌免疫治疗仍然有探索的巨大前景。KEYNOTE-12首先证实了帕博利珠单抗治疗进展期胃癌的有效性[13]。纳武利尤单抗在ATTRACTION-2研究中三线治疗进展期GC或胃食管结合部(GEJ)腺癌取得生存获益[14],抗PD-L1单抗Avelumab在JAVELIN研究中也显示了治疗前景,然而在JAVELIN Gastric 300研究中却未得出阳性结果。抗CTLA4抑制剂的治疗结果并不如意,伊匹单抗、Tremelimumab研究均以失败告终。随着CheckMate-649研究的成功,纳武利尤单抗联合化疗在胃癌一线治疗领域获得突破,不仅为胃癌患者带来了生存获益,更是打破了胃癌领域PD-1单抗治疗的瓶颈。在2021年美国癌症研究学会(AACR)上报道的中国人群的数据与全组人群的一致性获益也为我国胃癌患者带来福音。对于HER-2阳性的胃癌一线免疫治疗能否取得类似的结果,在2021年刚刚结束的世界胃肠道肿瘤大会(ESMO World GI)中披露的KEYNOTE-811研究结果回答了这个问题,帕博利珠单抗联合治疗组将客观有效率(ORR)提高了20%多,并因此获得了美国FDA的批准,用于局部晚期不可切除或转移性HER-2阳性GC或GEJ腺癌患者的一线治疗。面对这些不同的研究带来的免疫治疗的截然不同的结果,探索生物标志物预测免疫获益人群尤为重要。
目前在胃癌免疫治疗中,除了PD-L1及肿瘤突变负荷(TMB),与免疫治疗疗效密切正相关的还有EBV和MSI[15]。该研究对患者的组织和循环肿瘤 DNA (ctDNA)进行了分子表征的检测,其中MSI占11.5%(7/61),EBV型占9.8%(6/61)。结果显示EBV型患者ORR为100%,MSI-H为85.7%,TMB-H为88.9%,而PD-L1阳性的患者为50%。结合敏感性和特异性的评估指标,EBV型的阳性预测值和特异性均是100%,EBV型预测免疫治疗疗效的准确率最高。MSI是由于错配修复功能缺陷导致遗传物质在复制过程中,不能正常修复DNA的损伤而使肿瘤细胞的DNA突变增多,体现为微卫星序列(MS)的异常。MSI-H亚型也具有较高的阳性预测价值,归因于MSI型胃癌具有更高突变负荷、高新抗原频率以及较高水平的淋巴细胞浸润,为免疫治疗创造了机会。此外,MSI-H与TMB-H有明显的相关性,遗传或获得性的MSI-H往往是导致TMB-H的原因[16]。大量的研究也已经证实了PD-1/PD-L1以及CTLA-4等免疫检查点抑制剂在TMB-H的肿瘤中更容易取得好的疗效,而TMB-L或者TMB-M的肿瘤往往对其不敏感。因此,MSI-H与TMB-H相继被FDA批准为免疫治疗实体瘤泛癌种适应证。
所有作者均声明不存在利益冲突



























