
探讨三维可视化技术在肾上腺静脉采血(AVS)中的应用价值。
回顾性分析2017年12月至2020年5月在贵州省人民医院行AVS的76例患者的临床资料。所有患者均行肾上腺薄层增强CT检查并行双侧AVS。其中46例在双侧AVS前由专业工程师将肾上腺薄层增强CT数据进行三维可视化处理,30例未进行三维可视化处理。比较两组患者导管在位率、采血成功率、采血时间、造影剂用量、手术并发症等指标。
76例患者中,男、女各38例,平均年龄45(25~57)岁。与非三维可视化组相比,三维可视化组右肾上腺静脉插管成功率(78%比43%)和AVS成功率(83%比53%)均较高,术中造影剂用量[M(Q1,Q3)为28(16,51)比78(59,89) ml]较低,采血所用时间[M(Q1,Q3)为44(22,61)比70(66,88) min]较短(均P<0.05)。与非三维可视化组相比,三维可视化组左侧肾上腺静脉插管导管在位率由97%提高至98%,AVS成功率由97%升至98%,采血时间及造影剂用量两组差异均无统计学意义(均P>0.05)。所有患者中,仅非三维可视化组有1例患者发生造影剂外渗,其余无明显并发症。
AVS前将肾上腺薄层增强CT的数据进行三维可视化处理,可提高右侧AVS的成功率,减少造影剂的使用量,并缩短AVS的手术时间,具有较高的临床应用价值。

原发性醛固酮增多症(primary aldosteronism,PA)是继发性高血压最常见的原因之一,肾上腺静脉采血(adrenal vein sampling,AVS)通过直接获得双侧肾上腺静脉血标本,对其分泌功能进行判断,已被公认为PA分型诊断的“金标准”[1, 2, 3]。AVS采血的难点主要是寻找右侧肾上腺静脉开口的位置,采血成功率为55%~98%[4]。目前,仅依据CT或MRI扫描结果对PA进行分型诊断约有38%的患者被误诊而制定不合适的治疗方案[5]。右侧AVS前需行造影了解导管位置,研究表明,右肾上腺静脉造影形态包括腺体型、三角型等多种形态[6, 7, 8]。三维可视化技术是指在CT、MRI二维图像的基础上,根据不同的重建算法进行的个性化立体模型重建,让解剖结构全息直观、立体、准确地展示。本中心自2017年12月开始开展AVS术,自2019年4月起在进行AVS术前将患者的肾上腺薄层增强CT数据进行三维可视化处理。本研究通过回顾性分析行肾上腺静脉患者的临床料,探讨三维可视化技术在AVS中的价值。
横断面研究。回顾性分析2017年12月至2020年5月于贵州省人民医院就诊、根据中华医学会内分泌学分会PA诊断治疗的专家共识[9]确诊为PA并行AVS的76例患者的临床资料。所有患者均行肾上腺薄层增强CT检查并行双侧AVS。其中46例在双侧AVS前由专业工程师将肾上腺薄层增强CT数据进行三维可视化处理,30例未进行三维可视化处理。本研究符合《赫尔辛基宣言》原则及相关伦理要求。
1. 肾上腺薄层增强CT扫描:肾上腺薄层增强 CT 扫描采用德国西门子公司Somatom Force CT 机,扫描管电压 120 kV,管电流 200 mAs,准直 0.625 mm。所有患者均行平扫、动脉期(使用Bolus-tracking跟踪技术,在腹主动脉 CT 值达到100 HU后6 s开始扫描)、门静脉期(动脉期结束后15 s)3期扫描。扫描范围:膈面至髂棘上方。造影剂用非离子碘造影剂(350 mg I/ml),总量 70~75 ml。造影剂注射方式:采用自动高压注射器经前臂静脉以3~4 ml/s 的速度进行注射。
2. 肾上腺薄层增强CT数据的三维可视化处理:本环节由专业工程师完成。大体过程为:患者应用多层螺旋CT行肾上腺薄层增强扫描,将扫描的CT数据保存为“DICOM”格式文件。临床医生与工程师沟通重建注意事项(重建内容为:肾上腺、肾脏、肝脏、椎体、肋骨、肾上腺中央静脉、肾静脉、腔静脉、肝脏静脉肾上腺周围静脉)。将“DICOM”格式文件导入Mimics Research软件(比利时Materialise公司)。重建工程师在所对应的项目中对需重建组织进行三维绘制。
3. AVS手术过程:AVS手术由1名介入科医生完成。采血均在8∶00~12∶00进行,整个手术过程在数字减影血管造影(DSA)引导下进行。患者仰卧位,右侧腹股沟区常规消毒铺巾,予以2%利多卡因3 ml局部浸润麻醉。按SELDINGER技术穿刺入右股静脉,置入5F血管鞘,0.035英寸导丝导引下送入5F“COBRA、YASHIRO”导管至下腔静脉造影并采血。左侧AVS导管应置于左侧膈下静脉与左肾上腺静脉交汇处,右侧插管至右侧肾上腺中央静脉。造影明确后,0.18英寸微导丝导引下同轴置入2.7F微导管将导管进入双侧AVS位置并采血。如反复寻找约1 h后仍未能造影明确,则于肾上腺中央静脉可疑开口位置采血。两侧肾上腺静脉及下腔静脉采血各3 ml,采血结束拔出导管鞘,加压包扎后压迫穿刺点。所有标本均立即送实验室检查皮质醇、血浆肾素活性、醛固酮。记录造影剂用量、采血所用时间、并发症等信息。
4. 结果判断:取血成功评价方法:以肾上腺静脉与下腔静脉血浆皮质醇浓度的比值[即选择指数(SI)]判断采血是否成功,如SI≥2则为取血成功。
数据的录入统一采用EpiData 3.1软件,采用 SPSS 19.0软件进行统计学分析。符合正态分布的计量资料以表示,不符合正态分布者以M(Q1,Q3)表示,采用独立样本t检验进行两组间比较;采用率和频数描述定性资料,采用χ²检验比较不同组间的差异。双侧检验,检验水准α=0.05。
纳入研究的76例患者中,男、女各38例,平均年龄45(25~57)岁,患者的一般资料见表1,两组各指标差异均无统计学意义(均P>0.05)。
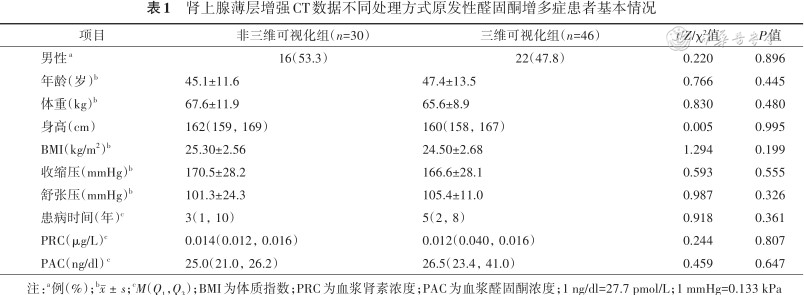
肾上腺薄层增强CT数据不同处理方式原发性醛固酮增多症患者基本情况
肾上腺薄层增强CT数据不同处理方式原发性醛固酮增多症患者基本情况
| 项目 | 非三维可视化组(n=30) | 三维可视化组(n=46) | t/Z/χ²值 | P值 |
|---|---|---|---|---|
| 男性a | 16(53.3) | 22(47.8) | 0.220 | 0.896 |
| 年龄(岁)b | 45.1±11.6 | 47.4±13.5 | 0.766 | 0.445 |
| 体重(kg)b | 67.6±11.9 | 65.6±8.9 | 0.830 | 0.480 |
| 身高(cm) | 162(159, 169) | 160(158, 167) | 0.005 | 0.995 |
| BMI(kg/m2)b | 25.30±2.56 | 24.50±2.68 | 1.294 | 0.199 |
| 收缩压(mmHg)b | 170.5±28.2 | 166.6±28.1 | 0.593 | 0.555 |
| 舒张压(mmHg)b | 101.3±24.3 | 105.4±11.0 | 0.987 | 0.326 |
| 患病时间(年)c | 3(1, 10) | 5(2, 8) | 0.918 | 0.361 |
| PRC(μg/L)c | 0.014(0.012, 0.016) | 0.012(0.040, 0.016) | 0.244 | 0.807 |
| PAC(ng/dl)c | 25.0(21.0, 26.2) | 26.5(23.4, 41.0) | 0.459 | 0.647 |
注:a例(%);b;cM(Q1,Q3);BMI为体质指数;PRC为血浆肾素浓度;PAC为血浆醛固酮浓度;1 ng/dl=27.7 pmol/L;1 mmHg=0.133 kPa
AVS采血的评价包括导管在位评估及取血成功。右肾上腺静脉造影形态包括腺体型、三角型、“△”型、蜘蛛型、不规则型(图1)。术中如右侧肾上腺静脉造影符合上述形态则认为右侧肾上腺静脉插管成功。左侧肾上腺静脉置管位置为左侧肾上腺中央静脉与左膈下静脉会合静脉或左侧肾上腺中央静脉,根据肾上腺静脉解剖位置可判断是否插管准确(图2)。
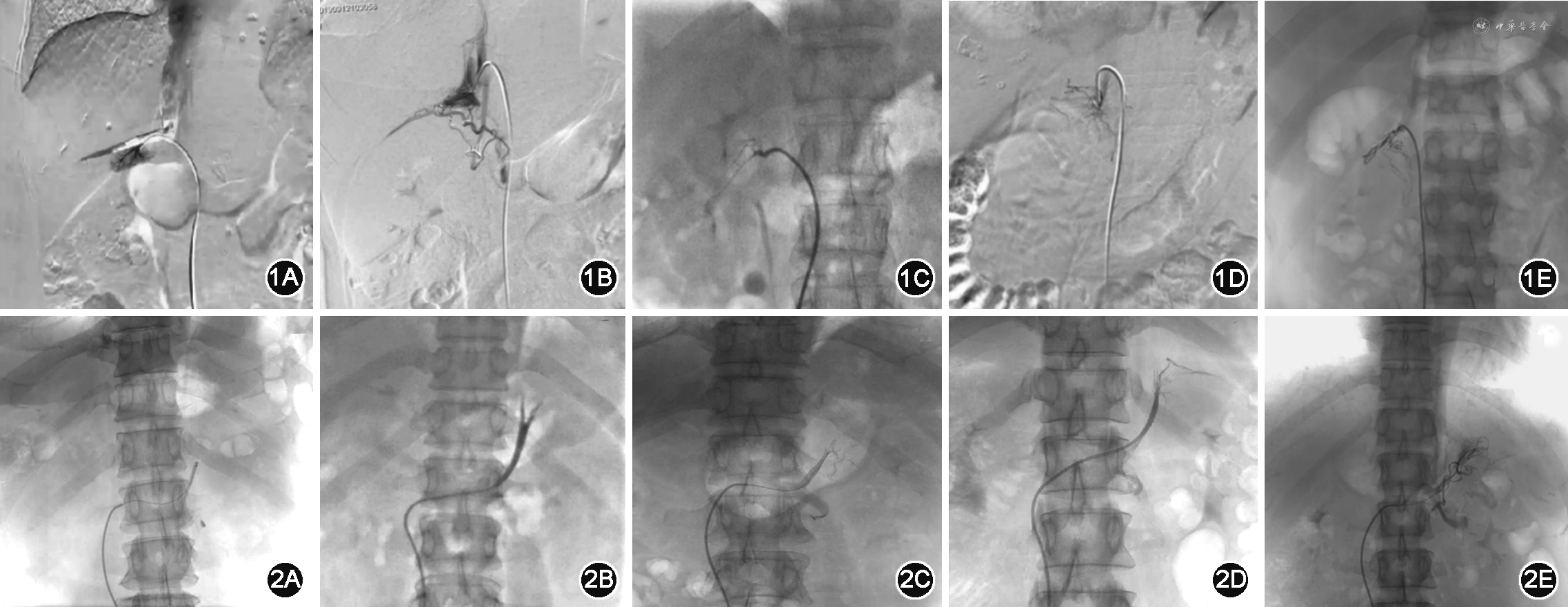

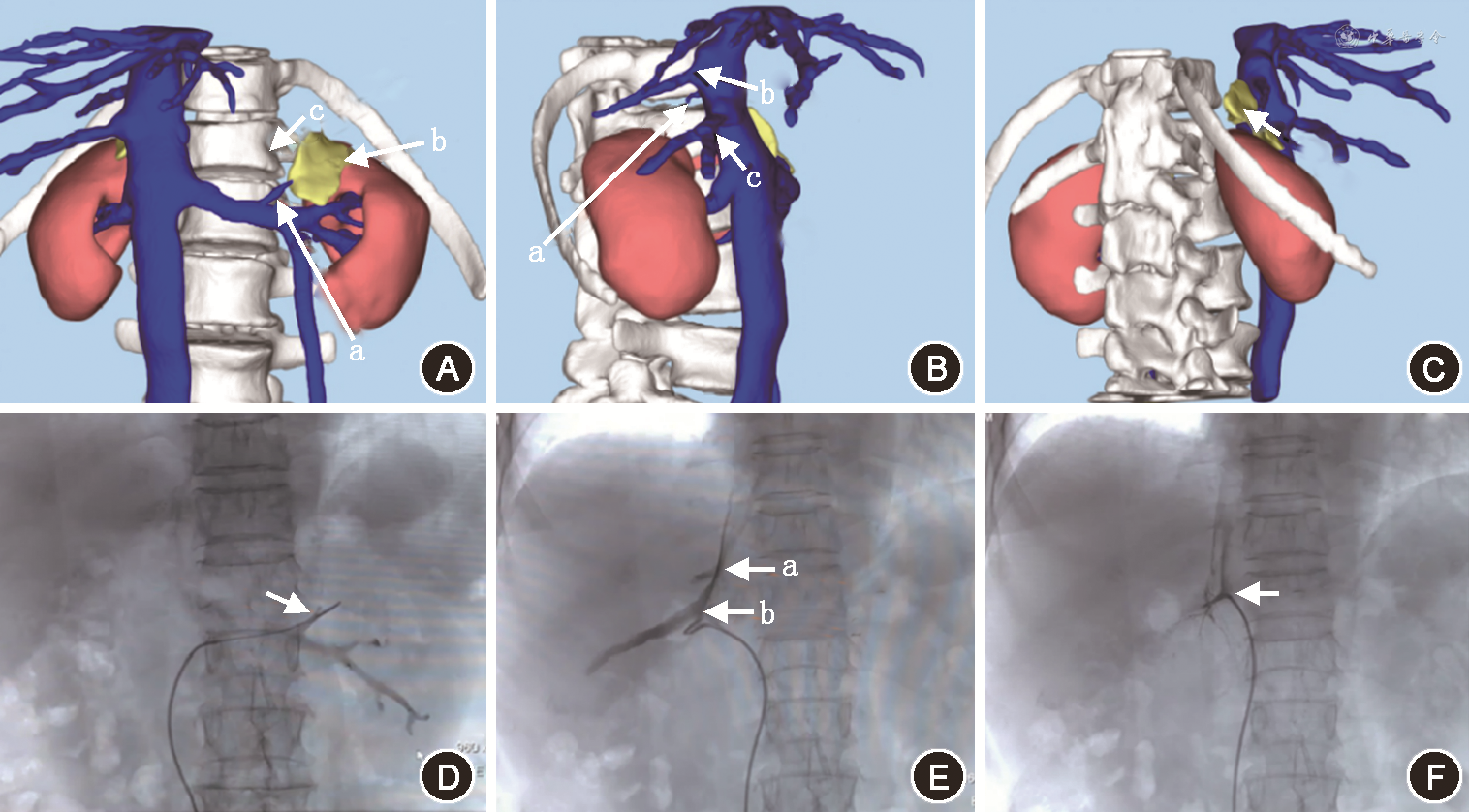
图3A~C示1例患者术前肾上腺增强CT经三维可视化处理后形成的图像,可见清晰的脊柱相应椎体、腔静脉、双侧肾上腺静脉及肾上腺静脉周围静脉血管的形态;D~F为肾上腺静脉采血术中造影的影像表现,双侧肾上腺静脉位置及肾上腺静脉周围血管形态均符合术前三维可视化处理所形成的图像。

30例非三维可视化患者中,左侧肾上腺静脉有29例患者插管成功。插管成功率为97%(29/30),采血成功率为97%(29/30);右侧肾上腺静脉仅有13例患者插管成功,插管成功率为43%(13/30),采血成功率为53%(16/30)。46例三维可视化组患者,左侧肾上腺静脉插管成功45例,插管成功率为98%(45/46),采血成功率为98%(45/46);右侧肾上腺静脉36例患者插管成功,插管成功率为78%(36/46),采血成功率为83%(38/46)。与非三维可视化组相比左侧插管成功率及采血成功率差异均无统计学意义(χ²=0.095,P>0.05);右侧肾上腺静脉插管成功率(χ²=9.671,P=0.007 9)及取血成功率(χ²=7.566,P=0.022 8)均较高。采血成功者两组腔静脉、右侧肾上腺、左侧肾上腺皮质醇差异均无统计学意义(均P>0.05)
非三维可视化组所用的造影剂剂量左侧为11(9,15) ml,右侧为78(59,89) ml,三维可视化组的造影剂剂量左侧为10(8,15) ml,右侧为28(16, 51) ml;与非三维可视化组相比,右侧较低(t=4.359 0,P<0.000 1), 左侧差异无统计学意义(t=0.397 2,P>0.05)。AVS采血的所用时间对比显示,与非三维可视化组[70(66, 88) min]相比,三维可视化组[44(22,61) min]较低(t=5.118 0,P<0.000 1),左侧AVS所用的时间分别为8(5, 9) min和7(5, 9) min,差异无统计学意义(t=0.576 1,P>0.05)。
非三维可视化组有1例患者采血过程中发现造影剂渗漏至肾上腺周围,发生率为1/30,该患者3个月后随访无明显不适;三维可视化组未发现AVS相关并发症。
目前AVS常用3种方法:非同步或同步双侧AVS以及负荷剂量促肾上腺皮质激素(ACTH)注入后非同步或同步双侧AVS以及ACTH持续静脉输注下非同步双侧AVS。本研究中,患者AVS均采用非ACTH激发序贯采血。Park等[10]利用C臂CT扫描辅助AVS,使双侧AVS的比例从40.6%增加到88.7%。此方法增加了患者的辐射损伤和费用,且对设备要求高,难以推广。Auchus等[11]利用术中快速皮质醇测定,使AVS采血成功率从73%升高到97%,此方法有较高的临床价值,但耗时长,目前AVS领域需要解决问题是如何才能快速准确地完成采血。董徽等[8]根据右侧肾上腺静脉的特点,选择经肘正中静脉入路进行采血,使右侧AVS采血成功率达到90%,但此技术目前仅在个别中心开展,尚缺乏大量的数据验证其有效性。张家欣[12]将患者的肾上腺CT数据进行三维可视化处理,获得患者骨骼的三维图像,再通过阅片将肾上腺静脉开口的位置标记于骨骼的三维图像上,提高了右侧AVS的成功率(由23.1%升至 87.5%),减少了采血时间,但其研究仅仅在三维重建的骨骼图像上标志肾上腺静脉开口位置,不能排除呼吸运动造成肾上腺静脉开口位置改变的影响,其对AVS的帮助有限,未能实现推广应用。本研究在AVS术前将患者的肾上腺薄层增强CT数据进行三维可视化处理,获得患者骨骼、肾上腺静脉、腔静脉、肾静脉及周围静脉的三维图像。使AVS进行时,操作者可视化的肾上腺静脉开口位置、锥体以及肝脏静脉等信息,明显地提高了AVS采血的准确率,减少了造影剂的用量以及减少了手术时间。
应用三维可视化技术处理患者的肾上腺薄层增强CT数据,可视化展示肾上腺静脉开口位置、锥体以及肝脏静脉等信息,免去了操作者在脑海中进行复杂图像综合和空间想象过程。通过系统自带的透明化处理,可以从多角度旋转观察静脉及骨骼信息。其对AVS的帮助有:(1)术前评估AVS难度和选择合适导管:通过三维可视化图像可以了解肾上腺静脉、腔静脉走行、粗细、角度等信息,评估手术难度,制定更好的插管策略;(2)术中快速找到肾上腺静脉的大体位置:三维可视化图像提供肾上腺静脉开口位置与椎体的相对位置关系,便于寻找肾上腺静脉,如术中利用造影明确了肾静脉、肝短静脉等的位置,可以根据其与肾上腺静脉的相对位置关系进一步寻找肾上腺中央静脉;(3)减少呼吸运动对肾上腺静脉开口寻找的影响:肾上腺及肾上腺静脉随着呼吸运动会有上下摆动的情况,利用椎体定位会有一定程度的影响,但肾上腺静脉与肝脏静脉、肾静脉及附近静脉等的相对位置关系较为固定;(4)对于部分采血困难的患者,需要改变C臂的角度,可以同步通过电脑旋转三维可视化的图像,了解在相应角度的对应解剖关系,增加采血的成功率。
AVS后的并发症除了由血管穿刺导致的外周血管并发症外,主要有肾上腺静脉破裂出血、血肿、夹层形成、栓塞等。文献报道AVS后并发症发生率为1%~13%[6]。本研究仅非三维可视化组有1例患者采血过程中发现造影剂渗漏至肾上腺周围,发生率为3.3%,三维可视化组未见AVS相关并发症。
本研究表明,三维可视化技术可以一定程度上提高AVS的成功率、缩短手术时间以及减少造影剂的用量。但因本中心AVS开展时间较短,样本量有限,故仍需进一步完善研究设计,扩大样本量,验证其在广泛人群中的有效性。
所有作者均声明不存在利益冲突



























