
探讨Hedgehog信号通路和上皮-间充质转化(epithelial-mesenchymal transition, EMT)在胆道闭锁(biliary atresia, BA)肝纤维化进展中的作用,为BA肝纤维化发生机制提供实验依据。
选取2019年1月至2020年1月天津市儿童医院普外科12例BA患儿肝组织和4例先天性胆管扩张症(congenital biliary dilatation,CBD)患儿肝组织,通过免疫组织化学观察Hedgehog信号通路配体SHH、效应转录因子GLI2蛋白表达分布情况,并通过蛋白质印迹法、实时荧光定量聚合酶链反应检测其蛋白及mRNA表达情况;通过免疫荧光染色观察EMT标记物神经钙粘蛋白(N-cadherin)及CK19表达分布情况。培养人肝内胆管上皮细胞,使用人重组SHH蛋白(r-SHH)和Hedgehog信号通路抑制剂环巴胺(Cyclopamine)进行外源性干预后,检测Hedgehog信号通路激活水平、EMT标记物E钙黏素(E-cadherin)、N-cadherin蛋白及mRNA表达水平。
免疫组织化学实验结果显示,SHH表达于BA胆管上皮细胞胞质中,GLI2表达于BA胆管上皮细胞胞核中。蛋白印迹法实验结果显示,BA组SHH、GLI2蛋白相对表达量分别为2.09±0.43、1.94±0.17,CBD组SHH、GLI2蛋白相对表达量为1.00±0.05、1.00±0.37,组间比较,差异均有统计学意义(P均<0.05)。实时荧光定量聚合酶链反实验结果显示,BA组SHH、GLI2 mRNA的相对表达量分别为2.89±0.96、2.35±0.78,CBD组SHH、GLI2 mRNA的相对表达量分别为1.00±0.34、1.00±0.22,组间比较,差异均有统计学意义(P均<0.05)。免疫荧光染色结果显示,EMT标记物N-cadherin与CK19共表达于BA胆管上皮细胞。使用r-SHH处理激活Hedgehog信号通路效应转录因子GLI2后,促进了EMT(抑制了E-cadherin,增强了N-cadherin),阻断该通路后,EMT被阻断。
Hedgehog信号通路在BA中高表达,是促进肝内胆管上皮细胞发生EMT的重要诱导通路,其在BA肝纤维化进程中起重要作用,为BA肝纤维化发生机制提供实验依据。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胆道闭锁(biliary atresia, BA)是小儿肝移植的主要指征,肝内外胆管的硬化和闭塞是其常见的组织病理学特征,可诱发胆汁淤积、炎症反应与胆管增生,最终导致肝进行性纤维化的发生[1,2]。Kasai手术可以重新建立胆汁引流通路,但仅是暂时性解决肝外胆道梗阻的问题,术后仍有约50%的患儿肝纤维化持续进展最终出现肝衰竭[3,4]。BA上皮-间充质转化(epithelial-mesenchymal transition, EMT)是肝纤维化的一个重要表型,与肝纤维化的发生发展密切相关。该过程一般表现为上皮标志物E钙黏素(E-cadherin)表达减少,间质标记物神经钙粘蛋白(N-cadherin)表达增多[5]。Hedgehog信号通路与EMT的关系近年来倍受重视。研究发现,Hedgehog信号通路在肝发育中起着关键作用,包括肝纤维化、肝祖细胞的生长、肌成纤维细胞的积累、修复相关炎症反应、血管重建等[6]。本研究拟通过患儿肝组织研究及体外人肝内胆管上皮细胞培养,探讨Hedgehog信号通路在BA肝纤维化EMT中的作用机制。
选取天津市儿童医院普外科2019年1月至2020年1月收治的黄疸手术患儿16例,其中BA患儿12例(BA组),先天性胆管扩张症(congenital biliary dilatation, CBD)患儿4例(CBD组)。本研究纳入患儿一般资料如表1所示,各组间性别与年龄比较,差异无统计学意义(P均>0.05)。所有纳入研究对象均获取监护人知情同意。本研究也已通过天津市儿童医院伦理委员会审核并批准(KY2020-05)。
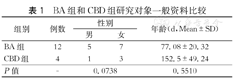
BA组和CBD组研究对象一般资料比较
BA组和CBD组研究对象一般资料比较
| 组别 | 例数 | 性别 | 年龄(d,Mean±SD) | |
|---|---|---|---|---|
| 男 | 女 | |||
| BA组 | 12 | 5 | 7 | 77.08±20.32 |
| CBD组 | 4 | 1 | 3 | 152.5±49.24 |
| P值 | - | 0.0738 | 0.5510 | |
留取12例BA患儿Kasai手术肝组织标本(取肝右叶前缘约0.5 cm×0.5 cm×0.3 cm楔形组织1块)和4例CBD患儿手术肝组织标本(取肝右叶前缘约0.5 cm×0.5 cm×0.3 cm楔形组织1块),冻存于-80℃。人肝内胆管上皮细胞购于BNCC公司,冻存于本研究室液氮。RPMI-1640不完全培养基(SH30809.01)购买于江苏凯基生物技术股份有限公司;人重组r-SHH(100-45)购自派普泰克生物科技(苏州)有限公司;环巴胺(Cyclopamine)(HY-17024)购自MedChemExpress(美国);SHH(20697-1-AP)、GLI2(18989-1-AP)抗体均购自proteintech(美国);CK19免疫组织化学工作液购买于中杉公司;E-cadherin(3195T)、N-cadherin(13116T)抗体购买于Cell Signaling Technology(美国);β-ACTIN(A01010)抗体购买于亚科因公司。
肝组织用福尔马林进行固定,石蜡包埋,将蜡块标本连续4 μm切片,80℃烤片90 min。切片脱蜡置于pH 6.0的柠檬酸钠溶液中微波炉高温15 min,进行抗原修复,恢复室温后用pH 7.3的磷酸盐缓冲液(PBS)震荡冲洗3次,5 min/次,封闭抗原30 min,免疫组织化学滴加一抗SHH(1∶150)、GLI2(1∶200),免疫荧光滴加CK19工作液、N-cadherin(1∶100),置于4℃冰箱过夜。次日所有切片恢复室温后再次PBS冲洗,免疫组织化学滴加辣根过氧化物酶二抗,免疫荧光染色滴加荧光二抗结合30 min,PBS冲洗后显微镜下观察显色,苏木精染核,固定后透明封片。
肝组织经裂解、测定浓度后定量提取总蛋白;细胞加入适量RIPA裂解液重悬,其中裂解液中含有1×Cock Tail(蛋白酶抑制剂混合物),反复吹打几次混合均匀,在冰上静置10 min。将混合物于4℃、12 000转/min条件下离心10 min,离心半径为13.5 cm,取上清物于新的离心管中获得总蛋白。将获得的蛋白进行SDS-PAGE电泳(60 V跑至分离胶,120 V跑至边缘),湿转法将蛋白转移至PVDF膜上(250 mA恒流90 min),封闭液孵育70 min,4℃一抗SHH(1∶1 000)、GLI2(1∶1 000)、E-cadherin(1∶1 000)、N-cadherin(1∶1 000)、β-ACTIN(1∶10 000)孵育过夜,洗膜后37℃孵育二抗(1∶5 000)50 min,采用化学发光法显色。
肝组织总RNA经Trizol法提取,细胞总RNA通过RNA提取试剂盒提取,严格按照试剂盒说明书进行操作,使用酶标仪检测总RNA浓度。按照逆转录试剂盒说明,取500 ng RNA进行10 μl体系逆转录。将获得cDNA稀释10倍,用SYBGreen10 μl体系在LightCycler 96实时荧光定量PCR仪上得出CT值。实验所用引物序列见表2。

引物序列表
引物序列表
| 基因 | 序列(5'→3') |
|---|---|
| SHH | F:CCGAGCGATTTAAGGAACTCACC |
| R:AGCGTTCAACTTGTCCTTACACC | |
| GLI2 | F:GTCAGAGCCATCAAGACCGAGA |
| R:GTCAGAGCCATCAAGACCGAGA | |
| GAPDH | F:TTGTTGCCATCAATGACCCCTT |
| R:GACTCCACGACGTACTCAGC | |
| CDH1 | F:GCCTCCTGAAAAGAGAGTGGAAG |
| R:GCCTCCTGAAAAGAGAGTGGAAG | |
| CDH2 | F:CCTCCAGAGTTTACTGCCATGAC |
| R:CCTCCAGAGTTTACTGCCATGAC |
在37.0℃恒温,CO2浓度为5%条件下用RPMI-1640不完全培养基培养人肝内胆管上皮细胞,加入10%胎牛血清FBS、1%双抗液体(100 U/ml青霉素与100 U/ml链霉素混合液)。取适量细胞悬浮液铺于6孔板细胞培养皿和24孔板细胞培养皿中,将rTGF-β用PBS溶解,分装稀释为5、10、20 ng/ml三组,分别处理6孔及24孔细胞培养皿;将r-SHH用PBS溶解,分装稀释为10、50、100 ng/ml三组,分别处理6孔及24孔细胞培养皿;将Cyclopamine用二甲基亚砜溶解并稀释为10μmol/l,与r-SHH 100 ng/ml一起处理6孔及24孔细胞培养皿。
采用SPSS 22.0软件进行统计分析。本研究涉及的符合正态分布计量资料数据以Mean±SD表示,多组间差异分析采用单因素方差分析。P<0.05为差异有统计学意义。使用Image J软件进行灰度值分析,使用Graphpad prism 8统计软件绘图,采用Adobe Photoshop CC 2017软件进行图像处理。
免疫组织化学染色显示SHH在BA组胆管上皮细胞胞质呈阳性表达,在CBD组不表达;GLI2在BA组胆管上皮细胞胞核呈阳性表达,在CBD组不表达(图1A)。蛋白质印迹法灰度分析结果显示肝组织SHH蛋白在BA组、CBD组相对表达量分别为2.09±0.43和1.00±0.05,差异有统计学意义(P=0.043);GLI2蛋白在两组相对表达量分别为1.94±0.17和1.00±0.37,差异有统计学意义(P=0.0261,图1B)。
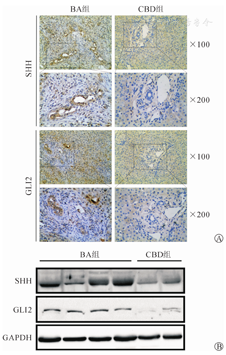

实时荧光定量聚合酶链反应(real time fluorescence quantity polymerase chain reaction,RT-qPCR)检测结果显示,肝组织SHH mRNA在BA组、CBD组相对表达量分别为2.89±0.96和1.00±0.34,差异有统计学意义(P=0.0028);GLI2 mRNA在BA组、CBD组相对表达量分别为2.35±0.78和1.00±0.22,差异有统计学意义(P=0.0063)。
对肝组织进行CK19与N-cadherin免疫组织荧光双重染色,结果显示,BA组肝组织汇管区中存在的增生胆管可表达EMT间质细胞标记物N-cadherin,而CBD组未发现这一现象(图2)。
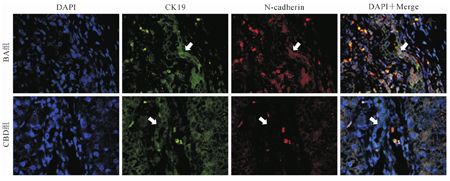

注:箭头所示为胆管结构
经r-SHH干预后,通过蛋白质印迹法和RT-qPCR检测Hedgehog通路GLI2、EMT标记物E-cadherin、N-cadherin表达水平。结果发现随着r-SHH浓度逐渐增高,与0 ng/ml r-SHH组(对照组)相比,GLI2、N-cadherin蛋白及mRNA表达呈浓度依赖性增高,在r-SHH浓度为100 ng/ml时,表达最高;而E-cadherin呈浓度依赖性降低,在r-SHH浓度为100 ng/ml时,E-cadherin表达最低(图3、表3)。与仅给予r-SHH相比,同时给予100 ng/ml r-SHH与10 μmol/L Cyclopamine时GLI2、N-cadherin蛋白与mRNA表达下调,E-cadherin蛋白及mRNA表达上调(图4、表3)。上述结果表明Hedgehog信号通路的激活可以促进体外人肝内胆管上皮细胞发生EMT。
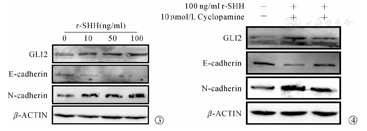

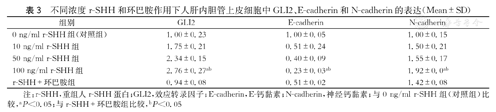
不同浓度r-SHH和环巴胺作用下人肝内胆管上皮细胞中GLI2、E-cadherin和N-cadherin的表达(Mean±SD)
不同浓度r-SHH和环巴胺作用下人肝内胆管上皮细胞中GLI2、E-cadherin和N-cadherin的表达(Mean±SD)
| 组别 | GLI2 | E-cadherin | N-cadherin |
|---|---|---|---|
| 0 ng/ml r-SHH组(对照组) | 1.00±0.23 | 1.00±0.05 | 1.00±0.15 |
| 10 ng/ml r-SHH组 | 1.75±0.21 | 0.51±0.24 | 1.50±0.21 |
| 50 ng/ml r-SHH组 | 2.34±0.15 | 0.40±0.09 | 1.55±0.17 |
| 100 ng/ml r-SHH组 | 2.76±0.27ab | 0.23±0.03ab | 1.92±0.0ab |
| r-SHH+环巴胺组 | 0.94±0.08 | 0.51±0.02 | 1.42±0.08 |
注:r-SHH,重组人r-SHH蛋白;GLI2,效应转录因子;E-cadherin,E-钙黏素;N-cadherin,神经钙黏素;与0 ng/ml r-SHH组(对照组)比较,aP<0.05;与r-SHH+环巴胺组比较,bP<0.05
BA是持续性新生儿胆汁淤积的最常见原因,是婴儿期最严重的肝胆系统疾病。它具有快速进行性纤维化的独特特征,该纤维化会在早期导致肝硬化。尽管进行了早期Kasai手术治疗,成功地进行了胆道引流,但肝纤维化仍会随着门静脉高压的发展而继续进展[3,4]。EMT是指上皮细胞向间质表型转化,使上皮细胞具有增强的迁移、侵袭和细胞外基质生成能力,是肝纤维化的一个重要表型,其与肝纤维化的发生发展密切相关[7]。有研究显示,EMT参与肝细胞和胆管细胞转化为肌成纤维细胞从而促进肝纤维化[8]。研究表明Hedgehog信号通路促进肝纤维化进展[6]。故本研究通过对人肝组织研究与体外人肝内胆管上皮细胞培养探讨Hedgehog信号通路在BA肝纤维化中的表达及作用机制。
Hedgehog信号通路是一种高度保守的信号通路,在人体内各系统发挥广泛作用,主要由配体(SHH)、跨膜蛋白受体(PTCH)、信号转导子(SMO)、中间分子(COS2/SUFU/GLI三聚体、PKA、CK1和GSK3β)、效应转录因子(GLI2)和下游靶基因组成[9]。Cyclopamine是一种天然存在的特异性甾体生物碱类Hedgehog信号通路小分子抑制剂,能选择性地结合SMO从而发挥抑制作用[10]。Hedgehog信号通路在胚胎的形态形成和生长控制中起着关键作用[9]。在本实验中,我们首先通过免疫组织化学染色实验发现SHH、GLI2在BA组胆管上皮细胞中高表达,进一步通过人肝组织RT-qPCR实验定量分析发现,较CBD组,BA组患儿肝脏中SHH、GLI2表达水平显著升高。相似的是,既往研究发现与成人肝相比,儿童肝的Hedgehog信号通路激活更大,可能与正在进行的器官发育有关,包括细胞增殖、细胞黏附、胚胎发生等[11,12]。在BA的肝修复和重塑过程中,Hedgehog信号通路似乎被进一步激活。Jung等[13]对BA肝组织的研究发现,Hedgehog信号通路中SHH、PTCH和GLI2主要表达于增殖未成熟的胆管细胞,且与对照组相比表达明显增高。张志波等[14]的研究发现,与正常对照组相比,BA患儿肝组织中Hedgehog信号通路配体SHH的表达水平明显升高。
本研究同时对胆管标记物CK19与间质细胞标记物N-cadherin进行免疫组织荧光双重染色发现,在BA中这些表达CK19的胆管可表达N-cadherin,而在CBD中不表达。促进BA肝纤维化形成的细胞富集于门静脉区内,具有肌成纤维细胞表型。研究发现,产生胶原蛋白的成纤维细胞聚集在增殖的小胆管附近[15]。在导管型上皮细胞中观察到纤维化相关的细胞因子、趋化因子和基质重塑蛋白(如金属蛋白酶)[16]。胆管上皮细胞中上皮和间质标记物的共表达进一步证明了胆管细胞参与了BA肝纤维化[17,18]。目前认为各种致病因素导致的胆管上皮细胞发生EMT是导致肝纤维化的主要病理进程之一[7]。Díaz等[17]研究表明上皮到间质的转变发生在人的肝纤维化中,特别是在BA和原发性胆汁性肝硬化等具有明显胆管增生的疾病中。通过上述BA肝组织研究结果,我们可以推断,BA胆管上皮细胞中的EMT与Hedgehog通路活化具有相关性。
基于以上发现,本研究进一步通过人肝内胆管上皮细胞体外培养,探索Hedgehog信号通路在BA肝纤维化中的作用机制。既往研究表明,Hedgehog信号通路的活化可能导致具有生成纤维基质的能力基质细胞积聚,干扰上皮的成熟并导致畸形的胆管结构积聚,共同表达未成熟胆管细胞和基质细胞的各种标志物,而这些都是BA的典型病理表现[19]。Choi等[20]的研究也表明Hedgehog信号通路配体会上调各种编码EMT间质细胞标记物基因的表达。在一项胆总管结扎模型中,Hedgehog信号通路在肌成纤维细胞和未成熟的胆管细胞中被激活,这些细胞在受损的肝中积累,通过EMT促进肝纤维化的形成[21,22]。另一项胆总管结扎诱导小鼠胆管纤维化研究中也发现,胆管上皮细胞中Hedgehog信号通路被激活,而该通路被认为是诱导EMT的关键信号通路[23]。Omenetti等[24]的进一步研究证实,Hedgehog信号通路配体中和抗体可以用于抑制活化肝星状细胞条件培养基处理的胆管细胞中的EMT。本研究体外试验发现,在人肝内胆管上皮细胞中,Hedgehog信号通路活化促进EMT发生,阻断Hedgehog通路活化将抑制EMT的发生过程。
综上所述,Hedgehog信号通路的激活促进EMT是BA肝纤维化病理演变的重要机制。本研究发现Hedgehog信号通路在BA中高表达,是促进肝内胆管上皮细胞发生EMT的重要诱导通路,其在BA肝纤维化进程中起重要作用,为BA肝纤维化发生机制提供实验依据。
所有作者均声明不存在利益冲突



























