
慢性肾脏病已经成为全球重要的公共卫生问题,其治疗目标为延缓疾病进展至终末期肾病。糖尿病肾脏病(DKD)作为常见的糖尿病慢性并发症,也是引起终末期肾病的主要病因之一,因此,合并糖尿病增加了CKD的管理难度。钠-葡萄糖共转运蛋白2抑制剂(SGLT2i)作为一种新型降糖药,不仅可以降低血糖,还具有明显的肾脏保护作用,被推荐用于预防及延缓DKD的发生和发展。然而,SGLT2i肾脏保护的作用机制尚不完全清楚。因此,本文汇总了近年来SGLT2i肾脏保护的相关临床研究,并对SGLT2i肾脏保护的潜在机制进行总结。

慢性肾脏病(chronic kidney disease,CKD)在全世界范围内仍然是一个重要的公共卫生问题,其患病率不断增加并影响了全球超过 7 500万人[1, 2]。糖尿病是增加CKD负担的主要原因,糖尿病肾脏病(diabetic kidney disease,DKD)作为常见的糖尿病慢性并发症,也是引起终末期肾病(end stage renal disease,ESRD)的主要病因之一(约占10%~67%)[3]。DKD可增加肾病相关失能,并引发动脉疾病和心血管并发症,同时也增加了糖尿病的临床管理难度[4, 5]。近年来在糖尿病治疗药物的探索中,大型临床研究证明了钠-葡萄糖共转运蛋白2抑制剂(sodium-glucose cotransporter 2 inhibitors,SGLT2i)降糖疗效确切,并先后确认了其心血管及肾脏获益。因此,目前国内外多个指南均推荐SGLT2i用于降低糖尿病患者的CKD风险。SGLT2i肾脏获益机制也随之成为研究热点之一。本文针对SGLT2i肾脏获益的研究进展及其潜在机制这两方面进行综述。
1. SGLT2i临床研究的肾脏结局证据:心血管结局试验(cardiovascular outcome trials,CVOT)旨在评估降糖药物的疗效与心血管安全性,而近年来研究者在多个CVOT中均发现了SGLT2i肾脏获益的证据(表1)。EMPA-REG OUTCOME(Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus Patients)研究纳入了已确诊心血管疾病(cardiovascular disease,CVD)的2型糖尿病(type 2 diabetes mellitus,T2DM)患者,除主要终点外还设计了肾脏终点,即“新发或恶化的肾病(定义为进展至大量白蛋白尿、血肌酐水平倍增、开始肾脏替代治疗或因肾病死亡)”。该研究首次公布了恩格列净可显著降低患者的肾脏终点事件风险达39%(P<0.001),表明恩格列净对此类患者可能具有预防和延缓肾脏疾病进展的作用[6]。CANVAS(CANagliflozin cardioVascular Assessment Study)研究纳入了伴高危心血管因素的T2DM人群,其肾脏复合终点设计为“估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)下降40%、需要肾脏替代治疗或因肾病死亡”,结果显示,使用卡格列净治疗后,患者肾脏复合终点事件风险可下降40%(HR 0.60,95%CI 0.47~0.77)[7]。DECLARE-TIMI 58(Multicenter Trial to Evaluate the Effect of Dapagliflozin on the Incidence of Cardiovascular Events)研究同样纳入了合并CVD或心血管危险因素的T2DM患者,其肾脏结局次要终点为“eGFR下降≥40%、ESRD或因肾病或心血管死亡”,结果发现,与安慰剂组相比,达格列净治疗组患者肾脏结局事件的发生率更低(分别为4.3%和5.6%;HR=0.76,95%CI 0.67~0.87)[8]。此外,该研究的肾脏分析显示,达格列净可降低患者的“eGFR下降≥40%”的风险达46%(P<0.000 1)[18]。
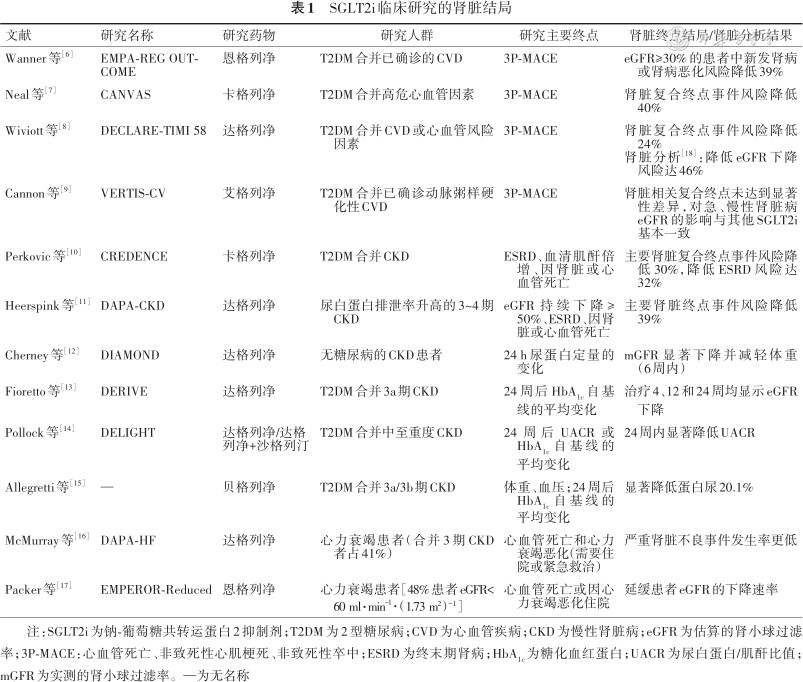
SGLT2i临床研究的肾脏结局
SGLT2i临床研究的肾脏结局
| 文献 | 研究名称 | 研究药物 | 研究人群 | 研究主要终点 | 肾脏终点结局/肾脏分析结果 |
|---|---|---|---|---|---|
| Wanner等[6] | EMPA-REG OUTCOME | 恩格列净 | T2DM合并已确诊的CVD | 3P-MACE | eGFR≥30%的患者中新发肾病或肾病恶化风险降低39% |
| Neal等[7] | CANVAS | 卡格列净 | T2DM合并高危心血管因素 | 3P-MACE | 肾脏复合终点事件风险降低40% |
| Wiviott等[8] | DECLARE-TIMI 58 | 达格列净 | T2DM合并CVD或心血管风险因素 | 3P-MACE | 肾脏复合终点事件风险降低24% 肾脏分析[18]:降低eGFR下降风险达46% |
| Cannon等[9] | VERTIS-CV | 艾格列净 | T2DM合并已确诊动脉粥样硬化性CVD | 3P-MACE | 肾脏相关复合终点未达到显著性差异,对急、慢性肾脏病eGFR的影响与其他SGLT2i基本一致 |
| Perkovic等[10] | CREDENCE | 卡格列净 | T2DM合并CKD | ESRD、血清肌酐倍增、因肾脏或心血管死亡 | 主要肾脏复合终点事件风险降低30%,降低ESRD风险达32% |
| Heerspink等[11] | DAPA-CKD | 达格列净 | 尿白蛋白排泄率升高的3~4期CKD | eGFR持续下降≥50%、ESRD、因肾脏或心血管死亡 | 主要肾脏终点事件风险降低39% |
| Cherney等[12] | DIAMOND | 达格列净 | 无糖尿病的CKD患者 | 24 h尿蛋白定量的变化 | mGFR显著下降并减轻体重(6周内) |
| Fioretto等[13] | DERIVE | 达格列净 | T2DM合并3a期CKD | 24周后HbA1c自基线的平均变化 | 治疗4、12和24周均显示eGFR下降 |
| Pollock等[14] | DELIGHT | 达格列净/达格 列净+沙格列汀 | T2DM合并中至重度CKD | 24周后UACR或HbA1c自基线的平均变化 | 24周内显著降低UACR |
| Allegretti等[15] | — | 贝格列净 | T2DM合并3a/3b期CKD | 体重、血压;24周后HbA1c自基线的平均变化 | 显著降低蛋白尿20.1% |
| McMurray等[16] | DAPA-HF | 达格列净 | 心力衰竭患者(合并3期CKD者占41%) | 心血管死亡和心力衰竭恶化(需要住院或紧急救治) | 严重肾脏不良事件发生率更低 |
| Packer等[17] | EMPEROR-Reduced | 恩格列净 | 心力衰竭患者[48%患者eGFR<60 ml·min-1·(1.73 m²)⁻¹] | 心血管死亡或因心力衰竭恶化住院 | 延缓患者eGFR的下降速率 |
注:SGLT2i为钠-葡萄糖共转运蛋白2抑制剂;T2DM为2型糖尿病;CVD为心血管疾病;CKD为慢性肾脏病;eGFR为估算的肾小球过滤率;3P-MACE:心血管死亡、非致死性心肌梗死、非致死性卒中;ESRD为终末期肾病;HbA1c为糖化血红蛋白;UACR为尿白蛋白/肌酐比值;mGFR为实测的肾小球过滤率。—为无名称
CREDENCE(Evaluation of the Effects of Canagliflozin on Renal and Cardiovascular Outcomes in Participants With Diabetic Nephropathy)研究是首个以肾脏事件为主要终点的大型随机对照临床试验,纳入了合并CKD的T2DM患者[基线eGFR为(56.2±18.2)ml·min⁻¹·(1.73 m²)⁻¹,中位尿蛋白/肌酐比值为927 mg/g]。在该研究中,卡格列净可显著降低主要肾脏复合终点(ESRD、血清肌酐倍增、因肾脏或心血管死亡)风险达30%(P=0.000 01),降低ESRD风险达32%(P=0.002)[10]。近年来公布的DAPA-CKD(A Study to Evaluate the Effect of Dapagliflozin on Renal Outcomes and Cardiovascular Mortality in Patients With Chronic Kidney Disease)研究,则纳入了尿白蛋白排泄率升高的2~4期CKD患者[基线eGFR为(43.1±12.4)ml·min⁻¹·(1.73 m²)⁻¹,中位尿蛋白/肌酐比值为949 mg/g;其中包括32.5%的非糖尿病患者],其最终结果显示,与安慰剂组相比,达格列净组主要肾脏终点事件(eGFR持续下降≥50%、ESRD、因肾脏或心血管死亡)发生率降低了39%(HR=0.61,95%CI 0.51~0.72)[11]。这些研究证明了SGLT2i可作为肾脏保护的有效治疗选择而用于伴CKD的T2DM人群。此外,部分心力衰竭研究结果也支持SGLT2i可用于合并CKD的心力衰竭人群,或有可能减缓心力衰竭患者的肾脏损害进展[16, 17](表1)。
总体来看,SGLT2i不仅可降低eGFR下降风险,也可降低蛋白尿,延缓肾病恶化和降低肾病相关死亡率[6, 7,14,18]。基于上述证据,《中国2型糖尿病防治指南(2020年版)》已提出,对伴DKD的T2DM患者,推荐在eGFR≥45 ml·min⁻¹·(1.73 m²)⁻¹的患者中使用SGLT2i,以降低DKD进展和(或)心血管事件风险[19]。《中国成人2型糖尿病合并心肾疾病患者降糖药物临床应用专家共识》也推荐对于T2DM合并CKD 的患者,不论其糖化血红蛋白是否达标,建议联合SGLT2i,以改善肾脏结局[20]。
2.肾脏获益的其他证据:大型真实世界研究进一步补充支持了相关CVOT的肾脏结局数据。如EMPRISE(Empagliflozin Comparative Effectiveness and Safety)研究的次要肾脏终点为“需要透析的急性肾损伤和ESRD的发生”,结果发现,恩格列净可使需要透析患者的急性肾损伤相对风险降低36%[21]。EMPRISE东亚地区亚组的肾脏分析也显示恩格列净可显著降低患者总体ESRD风险[22]。CVD-REAL的肾脏结局队列研究表明,与其他种类降糖药物相比,SGLT2i在广泛T2DM人群中能够有效延缓eGFR的下降,显著降低复合肾脏相关事件风险达51%[23]。
尽管早期研究对SGLT2i在非糖尿病患者中的肾脏保护作用曾有争议,但近年来的DAPA-CKD研究已证实了其在非糖尿病人群中是具有明显肾脏获益的[12]。目前正在开展中的EMPA-KIDNEY(The Study of Heart and Kidney Protection With Empagliflozin)研究,纳入了有疾病进展风险的CKD患者,其主要终点设计为肾脏疾病进展或心血管死亡的复合终点。未来该研究结果的公布,也将进一步补充SGLT2i用于CKD患者的证据[24]。
1.血流动力学假说:肾小球高滤过是一种肾脏血流动力学的异常状态,可引发多种肾脏疾病,促进CKD的进展。糖尿病患者的肾小球高滤过状态发病机制复杂,包括各种原因导致的血管活性异常、肾小管功能异常和代谢因素等[25]。在早发性糖尿病患者中,降糖本身可以改善糖尿病的高滤过状态[25]。由于在DKD早期阶段也存在高滤过状态[26],因此,控制血糖、纠正高滤过可能有助于保护DKD早期患者的肾脏功能。
SGLT2i可阻断糖尿病患者葡萄糖/钠离子在近端小管重吸收,恢复被抑制的管-球反馈,缓解肾小球囊内压升高和高滤过状态,从而发挥肾脏保护作用。这与血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)和血管紧张素Ⅱ受体拮抗剂(angiotensin receptor blocker,ARB)两类降压药物的缓解高滤过作用有异曲同工之妙。以肾脏结局为终点的SGLT2i研究的设计中,通常是在基线使用ACEI和ARB基础之上联合使用SGLT2i。Cherney等[27]的研究结果首次发现,钳夹控制下的正常血糖和高血糖期间,恩格列净均可显著降低高滤过状态的1型糖尿病患者的GFR(P均<0.01)。Vallon等[28]的糖尿病小鼠模型研究得出了一致的结论,使用恩格列净可防止高滤过,将糖尿病秋田小鼠的GFR降低至野生型小鼠中观察到的水平,且这种作用不依赖于血糖[28]。
2.抗炎、抗纤维化和抗氧化应激机制:DKD患者可发生肾小管萎缩、间质纤维化和慢性炎症等。在人近端肾小管细胞中,恩格列净降低了葡萄糖诱导的炎症和纤维化反应介质——Toll样受体2、4以及核因子-κB的表达[29]。氧化应激增加所引起的内皮功能障碍,是糖尿病患者发展为大血管或微血管疾病的关键起因,而SGLT2i可减轻高糖诱导的氧化应激和内皮功能障碍,从而缓解小鼠DKD的进展[30, 31]。
3.改善肾脏缺氧状态:肾小管间质缺氧是最终导致ESRD的常见途径。在糖尿病患者中,近端肾小管因葡萄糖的过度吸收而使耗氧量增加,从而引起肾小管间质缺氧。受累肾小管周围的成纤维细胞随后丧失功能,而使红细胞生成受损。SGLT2i通过降低近端小管的重吸收负荷,改善肾小管间质的缺氧状况,使得成纤维细胞恢复正常的促红细胞生成素产生[32]。缺氧诱导因子1(hypoxia-induced factor 1,HIF-1)在大脑、心脏、肝脏、肾脏等多种器官的缺氧过程中起保护作用,HIF-1可减少缺血再灌注诱导的肾细胞凋亡和炎症。Chang等[33]的研究发现,在肾脏缺血再灌注损伤模型小鼠中,达格列净可诱导HIF-1表达,从而发挥肾脏保护作用。
4.调节肾素-血管紧张素-醛固酮系统和交感神经活性:肾脏内肾素-血管紧张素-醛固酮系统(renin-angiotensin- aldosterone system,RAAS)的激活,是T2DM患者DKD发生的机制之一。经典的RAAS级联通路产生血管紧张素Ⅱ,并随后与血管紧张素Ⅱ1型受体结合,导致血管收缩、炎症、氧化应激增加和细胞凋亡。SGLT2i有助于增加输送至致密斑的钠离子水平,减少肾素释放,从而调节肾小球动脉血管收缩,改善局部血管紧张素Ⅱ引起的肾小球内高压。SGLT2i和RAAS抑制剂作用于不同部位,存在机制的互补效应,因此临床研究中常见SGLT2i联合RAAS抑制剂的治疗,如EMPA-REG OUTCOME中81%的患者使用了ACEI/ARB[6]。Kopecky等[34]的研究结果支持恩格列净联合选择性RAAS阻断剂可上调血管紧张素(1~7),从而进一步降低糖尿病患者的肾病风险。这些证据或可促使RAAS抑制剂联合SGLT2i成为有潜力的肾脏保护方案。
SGLT2和交感神经系统之间存在的相互作用不仅介导交感神经系统对糖代谢的调控,也潜在地与SGLT2i诱导的心肾保护效应相关。研究显示,达格列净可在小鼠模型中显著降低因高脂饮食引起的肾脏和心脏酪氨酸羟化酶和去甲肾上腺素水平的升高[35]。研究发现,鲁格列净可显著抑制高盐饮食、腺嘌呤诱发的非糖尿病CKD大鼠交感神经活性的增加和血压的升高[36]。
5.改善代谢相关危险因素:高血糖是DKD发生和进展的公认危险因素,因此,控制血糖对延缓肾病进展十分必要。然而,单纯的血糖控制并不足以降低肾脏预后的风险,且强化降糖引发的低血糖甚至可能加重大血管和微血管并发症。SGLT2i被认为能够更安全地发挥降糖作用,且在糖尿病模型小鼠中证实,SGLT2i在有效控制血糖水平的同时也降低了蛋白尿并缓解肾间质纤维化[37]。
糖尿病患者往往合并高血压、高血脂等慢性疾病,大量临床研究已证实SGLT2i同时具有降压和降血脂作用,血压的改善也有助于对肾脏的长期保护。
此外,较高的血尿酸水平也可能参与DKD的发生和发展。Lytvyn等[38]发现,SGLT2i可能通过对葡萄糖转运蛋白9的调节,促进近曲小管尿酸排泄,抑制集合管尿酸重吸收,来降低糖尿病患者的尿酸水平。Lu等[39]的研究也发现,恩格列净可明显上调尿酸转运蛋白的表达,从而促进尿酸排泄,进而降低血尿酸水平。
6.能量代谢相关机制:胰高糖素样肽-1(glucagon-like peptide-1,GLP-1)水平的升高有望改善DKD。而有研究发现,抑制SGLT2可减少胰岛素用量,同时升高GLP-1水平;其结果可间接导致脂解作用和肝糖异生增加,进一步造成轻度的酮体升高[40]。酮体作为“超级燃料”的假说机制,或可部分解释SGLT2i的肾脏效应。肾脏组织的耗氧量仅次于心脏,而糖尿病患者的肾脏耗氧量可能更高。SGLT2i治疗可通过降低GFR和直接抑制SGLT2介导的近端肾小管对钠的重吸收来降低肾脏的耗氧量,并减少低氧应激,改善肾脏结局[41]。
肾脏需要较高能量,除应用“超级燃料”外,肾脏组织也含有丰富的线粒体供能。线粒体中的磷酸甘油酸变位酶5(phosphoglycerate mutase family member 5,PGAM5)蛋白可加重糖尿病肾小管损伤。Liu等[42]的研究证明了恩格列净可通过一磷酸腺苷依赖的蛋白激酶/特异性蛋白1/PGAM5信号通路减轻线粒体裂变,进而改善DKD。这是一种独立于血糖外的预防糖尿病肾小管损伤的保护机制,也为DKD的治疗靶点带来了新的思路。
7.SGLT2i的心脏-血管-肾脏保护机制理论:近年来有研究者基于CVOT等研究结果提出了一种模拟水动力学的理论,将糖尿病患者的心、血管和肾脏比喻成“泵、管道及过滤器”的完整系统[43]。这些观点强调了SGLT2i具有改善心力衰竭和心血管风险、减少血管炎症以及减少GFR的下降等多种功能,这些功能已远超出其降糖作用的获益。
综上,CVOT等循证证据已证实了SGLT2i在糖尿病及合并CKD的患者中具有肾脏获益,甚至在非合并糖尿病的CKD患者中也可能降低肾脏不良事件风险。这种肾脏保护机制复杂,涉及血糖控制、血流动力学、抗炎和RAAS等多重调节。目前相关指南共识大多支持SGLT2i作为糖尿病患者二线首选药物,以降低CKD风险。未来仍期待更多SGLT2i与其他药物联合方案的研究探索,如联合使用RAAS抑制剂等。而在非合并糖尿病人群中扩展SGLT2i的适应证,也需要进一步的大型临床试验数据支持,如正在进行的EMPA-KIDNEY研究。总体来说,SGLT2i有望能使更广泛的慢性疾病人群获得肾脏保护。
所有作者均声明不存在利益冲突



























