
患者女,58岁。发现左侧乳房拇指大包块1个月余入院。行单侧乳房根治性切除术。肿瘤切面灰白灰红,见多个微囊。镜下肿瘤大部分由大小不一的囊腔构成,囊壁被覆富含细胞内黏液的柱状细胞,部分囊壁肌上皮丢失;另见浸润性癌(非特殊类型)成分。两种浸润性成分免疫表型不一致。病理诊断乳腺黏液性囊腺癌(MCA)合并乳腺浸润性癌(非特殊类型)。原发乳腺MCA为少见恶性肿瘤,可同时伴有其他类型浸润性癌成分,各成分需明确诊断。

患者女,58岁。因发现左侧乳房拇指大包块1个月余,于2020年10月就诊于湖北省仙桃市第一人民医院。体检:左侧乳房外上象限触及2 cm×2 cm肿块,质硬,边界不清,活动差,乳头无内陷,无溢乳,双侧腋窝及锁骨上未触及肿大淋巴结,彩超示:左侧乳腺囊实性结节,边界清,乳腺影像报告和数据系统(BI-RADS)分类4b类,胃镜、肠镜、子宫双侧附件彩超及腹部CT均未见明显异常。遂行术中快速冷冻切片病理检查、术后组织病理学检查及免疫组织化学检查。
病理检查:送检不规则组织一块,大小5.0 cm×3.0 cm×2.0 cm,切开见3.0 cm×2.0 cm结节,界尚清,切面灰白灰红,见多个微囊(图1)。另送检前哨淋巴结1枚。镜下观察,肿瘤由大小不等的囊腔构成(图2),腔内见黏液,囊壁被覆单层或多层柱状细胞,细胞核位于基底,胞质内富含黏液,部分区域细胞排列成复杂的分支状乳头突入囊腔(图3, 4, 5),囊壁肌上皮完全丢失(图6)或部分丢失,另外在囊腔之间见导管原位癌(DCIS)成分及浸润性癌(非特殊类型,IBC-NST)成分。乳腺前哨淋巴结未见癌转移。免疫组织化学:含黏液部分:GATA3、细胞角蛋白(CK)7、CK5/6阳性,雌激素受体(ER)、孕激素受体(PR)、HER2、CK20、CDX2、PAX8均阴性,p63、Calponin部分阳性,Ki-67阳性指数约70%;浸润性癌(非特殊类型)部分:ER中等偏弱阳性(40%),PR阴性,HER2 1+,p63、Calponin阴性,Ki-67阳性指数约40%。
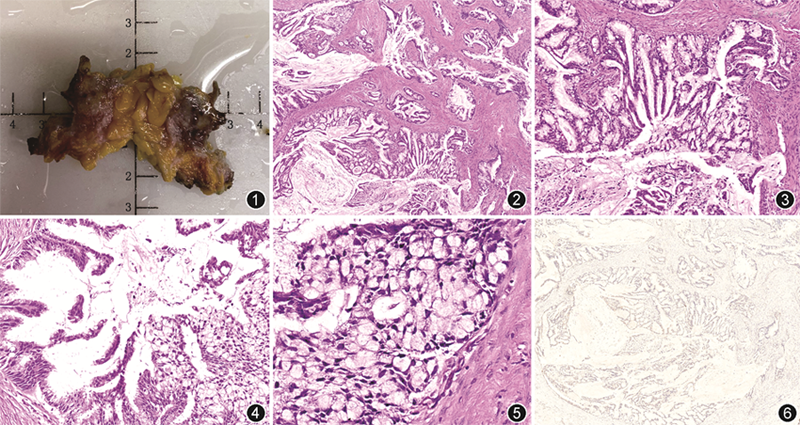

病理诊断:(左侧)乳腺黏液性囊腺癌合并乳腺浸润性癌(非特殊类型)。
治疗与随访:患者行单侧乳房根治性切除术,定期行盐酸吡柔比星、环磷酰胺及紫杉醇(EC-T)化疗及内分泌治疗,术后患者恢复良好,随访6个月,未见肿瘤复发转移。
讨论:原发于乳腺黏液性囊腺癌(MCA)一种罕见肿瘤,其组织学形态非常类似于卵巢或胰腺的黏液性囊腺癌,于1998年Koening和Tavassoli首次报道,目前,国外报道病例不足30例[1],而乳腺MCA合并乳腺浸润性癌(非特殊类型)报道更少[2, 3]。
2003年WHO乳腺和女性生殖器官肿瘤病理学和遗传学将MCA划入产生黏液的癌,而第4版乳腺肿瘤WHO分类取消了MCA,仅保留了乳腺黏液癌及伴有印戒细胞分化的癌。但在第5版乳腺肿瘤WHO分类中重新加入MCA并单独分类,其临床特点为:好发于绝经后妇女,中位年龄61岁,肿瘤常表现为可触及的肿块,大小0.8~19.0 cm不等,平均大小为3 cm,界限清楚,囊实性肿块,囊内常见胶冻样物[4, 5, 6]。本例患者为中老年女性,临床表现为无痛性肿块,B超显示为囊实性结节,与文献报道相符。
根据第5版乳腺肿瘤WHO分类,MCA的特征性结构为被覆复层柱状细胞的囊腔,囊内细胞可成簇或形成乳头状结构,囊内可见黏液,肿瘤细胞核位于基底侧,胞质内富含黏液,即使位于同一肿瘤内,肿瘤细胞也可具有不同异型性,肿瘤囊状结构通常轮廓清晰,但周围缺乏肌上皮[6]。本例肿瘤的组织学构象也具有以上特点,但是仅部分囊腔的囊壁完全丢失肌上皮,囊腔形状不规则,周围伴有促结缔组织反应,而部分囊腔的囊壁并未完全丢失肌上皮,表现为p63不连续表达或者囊壁一半区域完全丢失,一半区域表达,且其囊腔形状相对规则,而p63的丢失与囊腔大小无关。据报道,Chen等[2]曾提出原位MCA,因此肌上皮未完全丢失的囊腔应是原位MCA,另外Chen等还认为这些原位MCA起源于普通型DCIS黏液化生[2],然而Lee和Chaung[7]认为MCA的发生是源于导管内乳头状癌腔内黏液聚集,引起导管扩张,丢失肌上皮,浸润间质,而在本例中,囊腔之间不仅见到中级别导管原位癌、原位MCA,还见到同一导管内部分肿瘤呈DCIS构象,部分呈原位MCA构象,因此支持Chen等的观点。然而,MCA的发病机制有待进一步研究。
另外,本例囊腔之间见到IBC-NST成分,该成分在肿瘤中所占比例小,单灶,其免疫组织化学表型与MCA的不完全一致。IBC-NST的免疫组织化学表型ER中等偏弱阳性(40%),PR阴性,HER2 1+,Ki-67阳性指数约40%;而MCA的免疫组织化学表型ER、PR、HER2阴性,Ki-67阳性指数约70%。
据报道,MCA免疫组织化学表型ER、PR阴性(仅1例ER阳性[8])、HER2通常阴性(仅3例报道HER2扩增[9, 10, 11]),本例的免疫组织化学表型与其相符,另外,报道的病例中Ki-67阳性指数平均60%[7],提示MCA处于高增殖状态,但是,据报道MCA患者预后往往相对较好,可能有局部复发的风险,但淋巴结转移少,患者常死于其他疾病[1]。而MCA合并IBC-NST的病例太少,其预后还有待进一步研究。本例患者MCA的Ki-67同样高增殖,术后因MCA免疫表型ER、PR、HER2阴性,定期行EC-T化疗,又因合并ER阳性的IBC-NST,在化疗后辅以内分泌治疗(来曲唑),随访半年,患者未见肿瘤局部复发,未见淋巴结转移。因此,目前为止,该患者预后良好,但后期如何,有待继续追踪随访。另外,在报道的病例中大部分患者手术切除后,接受了放疗和化疗,若MCA预后较好,放疗和化疗是否为必需则有待更多研究。
因原发乳腺MCA病例较少,其组织学与卵巢、胰腺和胃肠道的MCA相似,因此,在诊断乳腺原发MCA时需结合临床,排除转移的可能,而免疫组织化学有一定帮助,如胰腺来源的转移性黏液性囊腺癌,免疫组织化学常同时表达CK7、CK20和CDX2,而原发乳腺MCA表达GATA3、CK7,但不表达CK20、CDX2[12]。本例免疫组织化学表型也是如此。另外转移性黏液性囊腺癌无乳腺DCIS构象,因此,若见到DCIS,则支持乳腺原发[1]。
总之,乳腺原发MCA为少见乳腺恶性肿瘤,若伴发其他浸润性成分,需明确诊断以帮助更好治疗。后期疾病发展情况有待更多病例追踪研究。
所有作者均声明不存在利益冲突



























