
评价新生儿黄疸筛查手机软件基于图像胆红素值(IBB)与经皮胆红素值(TcB)相比的相关性、一致性及安全性。
选择2018年7月至10月在徐州市中心医院新生儿科住院及产科病房的日龄≤28 d、胎龄≥ 35周,且未经蓝光治疗的新生儿,随机分组交叉对照检测胸骨前皮肤黄疸值。试验Ⅰ组先用试验器械(iPhone 6手机和哪吒保贝™手机软件),后用对照器械(JM-103经皮测黄疸仪);试验Ⅱ组先用对照器械;后用试验器械。记录性别、日龄、胎龄、出生体质量和连续检测3次的均值。采用积矩相关性分析、Bland-Altman图一致性分析、t检验及受试者工作特性曲线(ROC)进行统计学分析。
共纳入185例新生儿,其中男99例、女86例,日龄中位数5 d(3~8 d),胎龄(37.6 ± 1.7)周,出生体质量(2 950±645) g。IBB与TcB有较好的相关性(r=0.860,P<0.05)和较强的一致性(95.1%的样本落在95%一致性区间内)。在不同性别、日龄、胎龄和出生体质量等亚组也均有较好的相关性和较强的一致性。≤7 d、>37周和>2 500 g亚组的一致性相对更好。IBB预测TcB>256.5 μmol/L的能力好于预测TcB>171.0 μmol/L的能力,ROC曲线下面积为0.93,最佳预测界值为232.6 μmol/L,敏感性96.7%、特异性82.6%。IBB与TcB检测3次的均值的差值,小于IBB与TcB第1次检测值的差值[(12.0±34.4) μmol/L比(14.4±38.6) μmol/L,P=0.038]。未出现医疗不良事件,未发生器械本身缺陷。
IBB与TcB有较好的相关性及较强的一致性,IBB预测TcB>256.5 μmol/L的能力好于预测TcB>171.0 μmol/L的能力,使用安全。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
新生儿黄疸是新生儿期最常见症状,如果未能早期及时检测发现处理,部分高胆红素血症患儿会进展为胆红素脑病,甚至导致死亡。血清总胆红素值(TSB)是诊断新生儿高胆红素血症的金标准,但需要有创采血、实验室检测,不适合用于动态监测。经皮胆红素值(transcutaneous bilirubin,TcB)具有无创、安全和方便等特点,临床已经广泛使用,检测结果相对可靠,但经皮测黄疸仪价格较高,只适合在医院里使用[1]。而目测评估新生儿黄疸,即使是有经验的医护保健专业人员,也不够可靠[2],英国国家卫生保健研究所也明确建议不要将目测评估作为唯一的筛查手段[3]。一项来自184个国家的全球性调查显示,2010年出生胎龄≥32周的13 400万活产儿中2 400万(18%)面临着新生儿高胆红素血症相关不良结局的风险,21.44万(0.16%)发展为极重度高胆红素血症,11.41万例死亡,7.54万例慢性胆红素脑病。在中低收入国家,上述各项比例更高,主要原因之一是缺乏与医护保健人员的随访联系,未能及时尽早监测[4,5]。目前国内还存在对新生儿黄疸过度担心和过度诊治的问题,因此早期识别、家庭监测和远程随访,不仅能减轻家长焦虑、减少盲目就医,而且对降低胆红素脑病发病率至关重要。
新生儿黄疸筛查手机软件是一款无创、便捷的筛查新生儿黄疸软件系统。手机自动拍照上传云端,利用图像处理和人工智能技术对新生儿皮肤区域照片进行处理和分析,计算胆红素值,即基于图像胆红素(image-based bilirubin,IBB),达到远程预警黄疸高风险的目的[6]。徐州市中心医院于2018年7月21日至10月19日,作为临床试验机构,完成了该Ⅱ类医疗器械注册前的临床试验(方案编号:BSYL2018)。现将其与临床上普遍应用的经皮测黄疸仪的交叉对照试验结果分析如下,以评价该手机软件用于检测新生儿胆红素值的准确性(检测能力与已上市经皮测黄疸仪的一致性)和安全性。
选择试验期间在徐州市中心医院新生儿科住院及产科病房的新生儿。纳入标准:(1)日龄≤28 d、胎龄≥ 35周且未经蓝光治疗的新生儿;(2)受试者法定监护人能理解本次试验的目的,并签署知情同意书。排除标准:(1)受试者检测处皮肤有明显的瘀斑、水肿、破溃、感染等异常;(2)临床医师出于安全原因或患者利益考虑,认为患者不应参加本次临床试验的其他情况。剔除标准:(1)只有试验器械或只有对照器械检测结果的受试者;(2)受试者检测值超出试验器械或对照器械的检测范围;(3)试验器械采集数据时间与对照器械采集数据时间间隔超过30 min;(4)经统计计算被判为离群值的样本。
本试验遵循国家食品药品监督管理总局颁发的《医疗器械临床试验质量管理规范》及其他相关法律法规。试验负责人和具体实施者均在国家食品药品监督管理总局高级研修学院完成药物临床试验管理规范(good clinical practice,GCP)网络培训并取得合格证书(WZ012018003019,WZ012018012650)。本研究通过医院医学伦理委员会批准(批准文号:XZXY-LQ-20180517-008)。患儿医学监护人均了解本试验方案,并签署知情同意书。
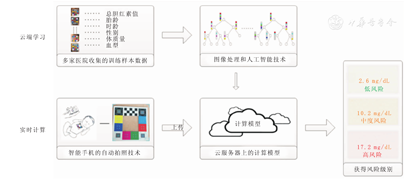
新生儿黄疸筛查手机软件(哪吒保贝™)的型号规格:BSYL-BiliScan-V1,深圳贝申医疗技术有限公司,医疗器械注册证编号:粤械注准20192070061。适用范围:适用于在光线充足条件下测量新生儿(胎龄≥35周、出生日龄≤28 d、黄色人种)的胆红素值,用于辅助筛查新生儿高胆红素血症,进行动态监测及随访。该软件由云端学习部分和客户端实时计算部分组成。"云端学习部分"事先收集包含比色卡的新生儿皮肤图像、胎龄、时龄、性别、体质量及血清总胆红素值,再使用人工智能技术生成胆红素计算模型。"客户端实时计算部分"使用智能手机下载相关应用软件,配合参照比色卡(打印或向公司索取)自动拍摄新生儿皮肤图像,拍摄部位与TcB测定部位相同,并将其上传至云端。云端学习部分得到的胆红素计算模型会对上传的新生儿皮肤图像进行分析并计算得到胆红素值,医护人员实时在智能手机上获得胆红素值和风险级别提示[6]。工作原理见图1。该软件系统由经网络下载的手机软件和专用比色卡组成,比色卡的生物兼容性实验中迟发型超敏反应和皮肤刺激检验结果为合格[6]。为保证拍摄镜头的统一性,本次试验所选用的智能手机型号为美国苹果公司的iPhone 6。

经皮测黄疸仪的型号规格:JM-103,KONICA MINOLTA有限公司,注册号:国食药监械(进)字2014第2404364号,进口产品注册标准:YZB/JAP 4926-2014。测量范围0.0~427.5 μmol/L(427.6~513.0 μmol/L显示数值并闪烁警示,>513.0 μmol/L显示为"0")。测定部位与IBB拍摄部位相同。黄疸仪的管理使用和存放条件等均严格按照使用手册进行。试验期间,专用温湿度计记录每天温湿度,保证温度在-10~50 ℃、相对湿度10%~95%。安静安静状态下检测(哭闹伴面红时,影响准确性)。推荐首选测量部位为血流相对丰富的额头和胸骨处皮肤(血流量小或皮下组织呈现角质化的区域,皮下组织中胆红素浓度可能偏低)。JM-103经皮测黄疸仪是目前临床上普遍使用的机型,其使用手册描述"在国内3家医院对JM-103经皮测黄疸仪测量值和血清TSB之间的相关性进行了测量,获得的回归线的标准差为±21.2 μmol/L(n=69)"。
试验设计:前瞻性、开放性、区组随机、二阶段交叉阳性对照。试验统计人员事先随机编号并制作相应的随机信封,交由试验中心保管。筛选合格受试者,记录人口学特征(性别、日龄、胎龄、出生体质量)。试验者严格按照受试者筛选入组成功的先后顺序依次分配随机编号,根据随机编号拆封对应的信封,确定受试者的分组情况。其中纳入试验Ⅰ组的受试者先使用试验器械进行胆红素值检测,后使用对照器械进行胆红素值检测;纳入试验Ⅱ组的受试者先使用对照器械进行胆红素值检测,后使用试验器械进行胆红素值检测。所有检测操作,均由同一位有经验的临床医师完成。先下载哪吒保贝™手机软件,注册后登录即可开始使用。在受试者安静状态下,将每一位受试者一张带有唯一编码的比色卡放置在受试者胸骨前,打开手机软件,点击拍照按钮进入"黄疸拍照",依据语音提示调整,保持手机稳定,满足"光照"、"图像"和"皮肤"3个条件后自动拍照,点击"上传检测",一般在1~3 s内(依赖于网络连接情况)显示计算出胆红素值。黄疸仪的具体操作严格按照使用手册进行。每次测量前后,均用75%乙醇清洁经皮测黄疸仪测量探头。受试者使用试验器械与对照器械之间的时间间隔不能超过30 min。若试验器械出现网络连接异常导致无法返回数据的情况,则重新补充拍摄,并对这种情况予以记录。
对每位受试者胸骨前皮肤连续检测3次,取均值。每次检测结果连同受试者基本资料,均用同一个标记日期和时间的数码相机进行拍照记录,妥善保管。试验全部结束后,数据均具有原始、实时、准确、完整、可靠和可溯源性,交由第三方机构全部溯源审核。
应用SPSS 20.0统计软件处理。双变量正态分布资料相关分析采用积矩相关性分析(Pearson相关系数);2种测量方法的一致性评价采用Bland-Altman图一致性分析。正态分布计量资料用 ±s表示,2组独立样本间比较采用独立样本t检验,2组配对样本间比较采用配对t检验。预测价值采用受试者工作特征(ROC)曲线分析。P<0.05为差异有统计学意义。
±s表示,2组独立样本间比较采用独立样本t检验,2组配对样本间比较采用配对t检验。预测价值采用受试者工作特征(ROC)曲线分析。P<0.05为差异有统计学意义。
入选186例新生儿,但编号131因出生胎龄为34+2周,违反纳入标准第1条,故剔除,最终纳入185组数据。其中男99例,女86例;日龄中位数5 d(3~8 d),胎龄(37.6 ±1.7)周,出生体质量(2 950±645) g。
全部数据分析显示:IBB与TcB有较好的相关性(r=0.860,P<0.05),直线回归方程为TcB=0.969 IBB-0.336(R2=0.740),见表1和图2。IBB与TcB差值呈正态分布,差值与TcB无相关性,差值对TcB的Bland-Altman图分析提示IBB与TcB有较强的一致性,95.1%(176/185例)的样本落在95%一致性区间内,且该一致性区间(-54.7~78.7 μmol/L)未超出临床上可接受的范围,见表1、图3。本试验目的是用TcB作为对照,评价IBB与TcB的一致性,而不是评价2种价值相近方法之间的一致性,故图3横坐标仅用TcB,未用IBB与TcB的均值。分层比较结果显示:在不同性别、检测日龄、胎龄和出生体质量等亚组的分析结果与总体结果相似,也均有较好的相关性及较强的一致性。≤7 d、>37周和>2 500 g亚组的一致性相对更好。各类亚组之间IBB-TcB的差异均无统计学意义(均P>0.05)(表1)。
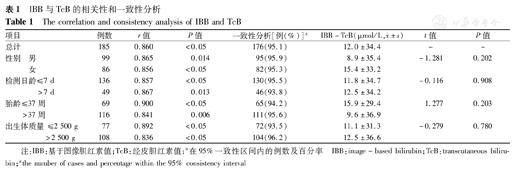
IBB与TcB的相关性和一致性分析
The correlation and consistency analysis of IBB and TcB
IBB与TcB的相关性和一致性分析
The correlation and consistency analysis of IBB and TcB
| 项目 | 例数 | r值 | P值 | 一致性分析[例(%)]a | IBB-TcB(μmol/L, ±s) ±s) | t值 | P值 | |
|---|---|---|---|---|---|---|---|---|
| 总计 | 185 | 0.860 | <0.05 | 176(95.1) | 12.0±34.4 | - | - | |
| 性别 | 男 | 99 | 0.865 | 0.014 | 95(95.9) | 8.9±35.4 | -1.281 | 0.202 |
| 女 | 86 | 0.856 | <0.05 | 82(95.3) | 15.4±33.2 | |||
| 检测日龄 | ≤7 d | 136 | 0.857 | <0.05 | 130(95.5) | 11.8±34.7 | -0.116 | 0.908 |
| >7 d | 49 | 0.867 | 0.013 | 46(93.8) | 12.5±34.2 | |||
| 胎龄 | ≤37周 | 69 | 0.900 | <0.05 | 65(94.2) | 15.9±29.4 | 1.277 | 0.203 |
| >37周 | 116 | 0.841 | 0.006 | 111(95.6) | 9.6±36.9 | |||
| 出生体质量 | ≤2 500 g | 77 | 0.892 | <0.05 | 72(93.5) | 11.1±31.3 | -0.279 | 0.780 |
| >2 500 g | 108 | 0.836 | <0.05 | 104(96.2) | 12.5±36.6 |
注:IBB:基于图像胆红素值;TcB:经皮胆红素值;a在95%一致性区间内的例数及百分率 IBB:image-based bilirubin;TcB:transcutaneous bilirubin;athe number of cases and percentage within the 95% consistency interval
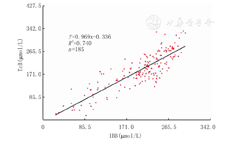

注:IBB:基于图像胆红素值;TcB:经皮胆红素值 IBB:image-based bilirubin;TcB:transcutaneous bilirubin
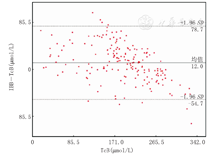

注:IBB:基于图像胆红素值;TcB:经皮胆红素值 IBB:image-based bilirubin;TcB:transcutaneous bilirubin
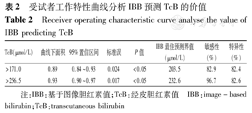
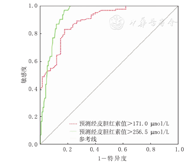
IBB预测TcB>256.5 μmol/L的能力好于预测TcB>171.0 μmol/L的能力,ROC曲线下面积为0.93,最佳预测界值为232.6 μmol/L,敏感性96.7%、特异性82.6%(图4、表2)。
受试者工作特性曲线分析IBB预测TcB的价值
Receiver operating characteristic curve analyse the value of IBB predicting TcB
受试者工作特性曲线分析IBB预测TcB的价值
Receiver operating characteristic curve analyse the value of IBB predicting TcB
| TcB(μmol/L) | 曲线下面积 | 95%置信区间 | 标准误 | P值 | IBB最佳预测界值(μmol/L) | 敏感性(%) | 特异性(%) |
|---|---|---|---|---|---|---|---|
| >171.0 | 0.89 | 0.84~0.93 | 0.024 | <0.05 | 203.5 | 82.9 | 82.4 |
| >256.5 | 0.93 | 0.90~0.97 | 0.017 | <0.05 | 232.6 | 96.7 | 82.6 |
注:IBB:基于图像胆红素值;TcB:经皮胆红素值 IBB:image-based bilirubin;TcB:transcutaneous bilirubin

IBB与TcB检测3次的均值的差值,小于IBB与TcB第1次检测值的差值,差异有统计学意义[(12.0 ± 34.4) μmol/L比(14.4±38.6) μmol/L,t=-2.088,P=0.038]。
未出现医疗不良事件,未发生器械本身缺陷。试验器械:2次上传后未得到数值,发现系网络异常,均重拍上传后得到结果;对照器械:1次按下后未显示数值,1次显示数值与黄疸程度明显不符,考虑测量探头未垂直放置所致,均重新检测后得到结果。
随着互联网+时代的到来和智能手机的快速普及,手机软件在医疗行业已得到广泛应用,智能手机凭借其迅捷处理和远程传输等优势,在跟踪管理、动态监测、筛查诊断、自我评估等医疗保健领域发挥着越来越大的作用[7]。在新生儿黄疸领域,近年来国外发表了多项研究,采用略有不同的技术方法,通过分析智能手机拍摄皮肤或巩膜数字图像来估算新生儿胆红素值[8,9,10,11,12,13,14,15,16,17,18],国内相关报道较少[2,19,20,21]。
2014年,美国华盛顿大学学者de Greef等[8]率先报道了其团队研发了一款名为"BiliCam"的智能手机拍照估算新生儿胆红素值的软件应用于临床,结果显示:胎龄>35周的新生儿IBB与TSB的相关系数为0.85,与TcB的准确性相似。随后该团队学者Taylor等[9]纳入美国多中心的530位健康新生儿,与TSB配对比较,结果显示IBB准确性、相关性与TcB相似,91.9%的IBB与TSB差值<51.3 μmol/L,两者一致性区间为-61.6~61.6 μmol/L,相关系数是0.91,其中亚裔美国人最低(相关系数为0.88)。本试验使用的哪吒保贝™(BiliScan)手机软件与BiliCam工作原理相似,但运算模型并不一样。BiliCam采用了10 s的录像,未考虑光线、角度、抖动等条件[9]。本试验结果显示IBB与TcB有较好的相关性(r=0.860)和较强的一致性(95.1%的样本落在95%一致性区间内),一致性区间为-54.7~78.7 μmol/L,与上述研究结果基本一致,均能可靠地动态监测新生儿黄疸。
本试验结果还显示,早期(日龄≤7 d)、足月(胎龄>37周)和非低出生体质量(出生体质量>2 500 g)的新生儿IBB与TcB的一致性相对更好,提示该应用软件更适用于该类人群。但应该注意,出生2 d内迅速升高的"早发性黄疸"(如溶血性黄疸等),皮下组织中胆红素浓度上升速度会略迟于血清胆红素的上升速度,从而会轻微影响TcB和IBB的准确性。进行蓝光治疗期间,光照区域皮下组织中胆红素浓度下降速度会快于血清胆红素的下降速度,从而会明显影响TcB和IBB的准确性。所以最好在额部或胸部的测量点上覆盖一块遮光垫,在蓝光治疗期间和治疗结束后24 h内,测量遮光垫下皮肤的黄疸值,可提高准确性[22]。
挪威学者Aune等[10]发表一项横断面前瞻性研究,使用了与本试验基本一致的技术理念,但收集了不同光照条件(标准光照、自然光线和闪光灯)、不同拍摄距离(20、30和40 cm)的计算结果,取均值。结果显示比色卡能有效地校正自然光线;出生15 d内白种人足月儿胸骨皮肤IBB与TSB(微量血)、TcB(Dräger JM-103)之间的相关系数为0.84、0.81;IBB与TSB有较好的一致性,一致性区间为-84.0~+83.8 μmol/L,准确性略低于本试验,故建议最好尽可能统一检测时的外部条件。
丹麦学者Munkholm等[11]纳入64例胎龄>35周、日龄>24 h且≤14 d的健康白种新生儿,使用iPhone 6手机直接拍摄、通过皮肤镜拍摄和通过滤光镜+皮肤镜拍摄3种方式,拍摄眉间皮肤色度评估新生儿黄疸。对拍摄部位适当加压,以减少皮下血管内血红蛋白对皮肤色度的干扰。排除了图像明显异常的13/64例后,结果显示,仅有依据通过皮肤镜拍摄的皮肤色度与TSB(27.4~290.7 μmol/L)有显著相关性(P<0.001),但相关系数不高(绿色通道r=0.59、蓝色通道r=0.46)。
除胆红素外,其他因素也会影响皮肤数字图像色度,如外界光线、皮肤厚度、血红蛋白和黑色素水平。因此英国学者使用智能手机软件,通过对巩膜成像来筛查新生儿黄疸[12,13]。优点有:(1)巩膜没有皮肤中的黑色素和血红蛋白发色基团;(2)巩膜受蓝光治疗的影响较小;(3)通过苹果手机白屏幕进行漫反射均匀照明,前置摄像头拍摄照明(标准)和不照明(环境)2张图像,无需比色卡,通过减法计算,消除环境光线的影响,因此原则上允许通过一次性校准后对巩膜黄度进行成像,消除了设备和环境的影响,获取巩膜结膜胆红素值(SCB),与TSB的相关性达0.75(P<0.01)。它不依赖于比色卡或其他附件,这可能有助于其在经济不发达地区大规模使用。但缺点是:(1)目前只有少数品牌手机具有前置摄像头+白屏幕漫反射均匀照明功能;(2)对屏幕光谱功率、相机传感器光谱灵敏度曲线等硬件的一致性要求较高;(3)环境光线和照明光度对结果有一定影响;(4)照明和不照明2张图像的曝光时间常不相同;(5)对新生儿巩膜拍照相对困难;(6)有些新生儿巩膜偏蓝(巩膜偏薄所致)会影响结果;(7)需要人工选择的巩膜适宜区;(8)尚缺乏大样本资料了解新生儿巩膜黄染程度与血清TSB之间的线性或非线性关系[12,13]。
"BiliCam"和哪吒保贝™(BiliScan)需要使用专用比色卡,在一定程度上影响了其更广泛的应用。但上述不使用比色卡的探索,均未取得更理想结果,且需要依赖皮肤镜或特定手机[11,12,13],应用前景均不如"BiliCam"和哪吒保贝™(BiliScan)。
薛国昌等[23,24]使用8色或6色黄疸比色卡辅助目测识别足月儿和近足月儿、日龄3~28 d的新生儿高胆红素血症。按压前额、面颊及胸骨处待测皮肤2 s后,迅速用比色卡与暴露的黄色皮肤进行比色,结果显示比色卡在面颊部对黄疸的识别能力最高,胸骨略低,前额较差。色块12在面颊部识别TSB≥205.2 μmol/L的敏感性为95.95%、特异性为74.14%。这项技术比IBB更方便、更廉价,有一定的应用推广价值,但受目测者经验和主观因素影响较大[25]。
本试验结果显示,IBB预测TcB>256.5 μmol/L的能力好于预测TcB ≥ 171.0 μmol/L的能力,ROC曲线下面积为0.93,最佳预测界值为232.6 μmol/L,敏感性96.7%、特异性82.6%。与Aune等[10]和Outlaw等[12]研究结果均类似:IBB预测TSB≥ 249.7 μmol/L的ROC曲线下面积为0.925,最佳预测界值为225.7 μmol/L,敏感性87%、特异性77%[10];SCB预测TSB>205.2 μmol/L的ROC曲线下面积为0.85,最佳预测界值为191.5 μmol/L,敏感性92%、特异性67%[12]。
TSB 15.0 μmol/L左右正是判断是否需要医疗干预的关键水平。如果TSB<171.0 μmol/L,即使IBB的准确性有所下降,也不影响对新生儿的处理。如果TSB>342.0 μmol/L,目视已可见显著黄疸,即使IBB的准确性有所下降,也常超过预警值,提醒家长去医院查TSB来指导诊治。无论是经皮测黄疸,还是拍照测黄疸,均适用于目视可见黄疸的新生儿皮肤(TSB>85.5 μmol/L)。新生儿TSB过低(<85.5 μmol/L)或过高(>427.5 μmol/L),TcB和IBB与TSB将会相差较大。本团队以往的研究也表明IBB预测TSB≥342.0 μmol/L的能力欠佳[2],故本次试验没有研究IBB预测新生儿重度高胆红素血症的能力。该软件不是为了准确检测任何水平的胆红素值,而是为了动态监测新生儿中度高胆红素血症,并筛查出具有黄疸高风险、需要医学干预的新生儿,这也是该软件注册为"新生儿黄疸筛查手机软件"的主要原因。该软件减少了目视经验及主观因素的影响,优于目测评估[2],尤其显著优于没有经验的家长的目测观察。这种"远程、廉价、可靠"的黄疸监护手段尤其适用于医疗和经济资源欠发达地区。
关于检测次数,本试验结果建议连续检测3次取均值相对准确。关于检测部位,本试验统一选取了胸骨前。额部、面颊、胸前等3个部位的皮肤黄度相差不大,大多学者建议首选胸前或额部[1,11,22]。综合考虑环境温度和方便程度,建议在医院可选择胸前,在家中可选择额部。尽管新生儿皮肤相对较薄,其黄度的均匀性明显好于成人[11],但对于个别目视皮肤黄度明显不均匀、上述3处测量部位的TcB或IBB相差>51.3 μmol/L左右的新生儿中度黄疸时,建议根据TSB水平进行临床决策。
试验局限性:(1)智能手机:本次试验我们统一使用了iPhone 6,但智能手机及其拍摄镜头更新换代速度很快,尚不能确定本试验的结果也完全适用于其他型号的iPhone和其他品牌的智能手机。单中心小样本的研究表明,3种不同品牌的智能手机之间,拍摄检测新生儿黄疸的一致性基本相似[2]。(2)考虑到伦理问题,轻度黄疸未查TSB;又因为本试验主要目的是评价IBB检测能力与已上市经皮测黄疸仪的一致性,故本试验没有与诊断新生儿高胆红素血症的金标准TSB对照。
建议和展望:(1)收集更多不同条件的训练样本,如更需要积极监测黄疸的早产儿和皮肤黑色素含量较高的人群等,拓展人工智能技术生成胆红素计算模型。(2)在不削弱准确性的前提下,减弱甚至取消对比色卡和云计算的依赖。(3)使用同样的系统,在不同的医院[10]或地区[14,19],研究的结果存在一些难以解释的差异,推测与是否接受培训、TSB的水平、样本量大小、不同的手机等因素有关[10],需要多中心、大样本、多因素的真实世界研究进一步明确各种因素的影响大小。
综上,临床交叉对照试验显示,IBB与TcB有较好的相关性和较强的一致性,IBB预测TcB>256.5 μmol/L的能力好于预测TcB>171.0 μmol/L的能力,使用安全。哪吒保贝™(BiliScan)能相对准确地动态监测足月儿和近足月儿早期新生儿中度高胆红素血症,预警黄疸高风险,尤其是在发生疫情期间,不方便去医院随访时,这款能在家中使用的"无创、便捷、远程、安全、可靠"的新生儿黄疸筛查手机软件,能减轻家长焦虑、减少胆红素脑病的发生[26]。
感谢申田博士提供的设计统计、技术支持和名称建议
所有作者均声明不存在利益冲突



























