
分析多种抗磷脂抗体(aPL)亚型在健康人群与抗磷脂综合征(APS)患者中的分布情况,并探讨IgA-aPL检测在APS诊断中的临床应用价值。
依据2006年悉尼国际APS分类标准,选取2019年7至12月就诊于北京协和医院和四川大学华西医院的APS患者共计218例纳入研究。其中男66例,女152例,年龄(44.5±15.4)岁,包括原发性APS患者148例,继发性70例,并同期1∶1收集年龄、性别匹配的健康对照。以化学发光免疫分析法检测研究对象血清样本中IgA/IgG/IgM型抗心磷脂抗体(aCL)及抗β2糖蛋白Ⅰ抗体(aβ2GPI)。比较分析组间各指标的差异,并应用受试者工作特征(ROC)曲线分析IgA-aPL对APS的诊断价值。
APS患者中,IgA-aCL、IgA-aβ2GPI的阳性率分别为20.6%、15.6%,而在IgG/IgM-aCL或IgG/IgM-aβ2GPI阴性的个体中,二者的孤立阳性率仅分别为2.3%、0.9%。IgA-aCL、IgA-aβ2GPI孤立阳性不能用于有效识别APS患者(P=0.216、1)。联合IgG/IgM-aCL诊断APS的ROC曲线下面积(AUC)为0.833,明显优于IgG-aCL单独使用时(AUC=0.776,P<0.01),而IgA/IgG/IgM-aCL三联检测时AUC为0.833,并不能进一步提升对APS的诊断价值(P=0.287)。对aβ2GPI而言,联合IgG/IgM(AUC=0.875)或IgA/IgG/IgM型抗体(AUC=0.875)的诊断效能与IgG-aβ2GPI单独使用(AUC=0.869)时相较,差异均无统计学意义(均P>0.05)。此外,IgA-aPL阳性APS患者更易发生心脏瓣膜损伤(P=0.044)及血小板减少症(P=0.014)。
在已有的狼疮抗凝物、IgG/IgM型aCL和aβ2GPI等血清学标志物基础上,增加IgA-aCL与IgA-aβ2GPI并不能进一步提升实验室检查对APS的预测价值,但IgA-aPL与心脏瓣膜损伤及血小板减少症等临床症状相关。

抗磷脂综合征(antiphospholipid syndrome,APS)是一种以血管栓塞和病态妊娠为主要临床表现的系统性自身免疫病[1, 2],其发现至今仅有30余年[3],相关诊治标准仍处于持续优化之中。2006年悉尼国际APS会议修订的分类标准指出,APS的诊断需结合临床特征和实验室检查,其中实验室检查包括间隔12周仍可复现的狼疮抗凝物阳性,或中-高滴度的IgG和(或)IgM型抗磷脂抗体(antiphospholipid antibodies,aPL)[4]。IgA型抗心磷脂抗体(anticardiolipin antibodies,aCL)和抗β2糖蛋白Ⅰ抗体(anti-β2 glycoprotein-Ⅰ antibodies,aβ2GPI)作为aPL的重要组成部分,虽未纳入分类标准,但既往已有研究指出其与血栓形成和不良妊娠相关[5, 6],或可成为现行APS实验室诊断标准的重要补充,提升现有血清标志物的灵敏度。但IgA-aPL与APS相关性的临床研究结论仍缺乏一致性,这可能部分源于患者收集与实验室检测结果的标准化问题[7]。有鉴于此,本研究依托北京协和医院及四川大学华西医院国内两大疑难重病中心,应用病例-对照研究,分析多种aPL亚型在健康人群与APS患者中的分布情况,并探讨IgA-aPL检测在APS诊断中的应用价值,为提升临床诊治能力提供参考。
本研究利用简单随机抽样选取2019年7至12月就诊于北京协和医院或四川大学华西医院未经治疗的初诊型APS患者,共计218例纳入研究,其中男66例,女152例,年龄为(44.5±15.4)岁,包括原发性APS(PAPS)患者148例,继发于系统性红斑狼疮(SLE)、类风湿关节炎(RA)和(或)干燥综合征(SS)者,为继发性APS(SAPS)70例。具体抽样方法:应用Excel软件提供的统计函数“RANDBETWEEN”生成1~100的随机报表,并以此随机报表对患者编号,选取编号≤50的患者纳入研究。所有患者均符合2006年悉尼国际APS分类标准[4],均具有APS典型的临床表现,即血管栓塞和(或)病态妊娠。其中,血管栓塞指经影像学检查或组织活检证实的动脉、静脉或小血管血栓形成,需要注意除外仅表现为浅表静脉血栓的患者以及组织病理学检查发现血栓部位血管壁存在血管炎表现的患者;而病态妊娠包括:(1)在孕10周及以后发生的无法解释的胎死宫内,经超声或直接外观检查未见胎儿形态学结构异常;(2)在孕34周前,因子痫、重度先兆子痫或严重的胎盘功能不全所致形态学正常的新生儿早产;(3)在孕10周以前发生连续3次或以上无法解释的自发性流产,同时除外遗传、解剖结构和内分泌因素异常。收集APS患者中,多种系统性疾病的伴发情况,具体包括高血压、糖尿病、脂代谢紊乱和恶性肿瘤(包括肺癌、肝癌、淋巴瘤、白血病等)。同期1∶1收集无自身免疫性疾病、感染、肿瘤或其他炎性疾病且年龄、性别匹配的健康人群作为对照,相关临床信息见表1。本研究属回顾性病例对照研究,同时由四川大学华西医院伦理委员会和北京协和医院伦理委员会审核通过。
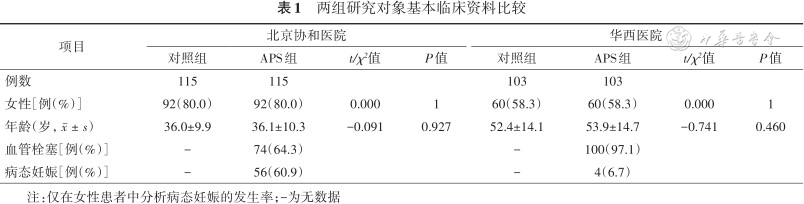
两组研究对象基本临床资料比较
两组研究对象基本临床资料比较
| 项目 | 北京协和医院 | 华西医院 | ||||||
|---|---|---|---|---|---|---|---|---|
| 对照组 | APS组 | t/χ²值 | P值 | 对照组 | APS组 | t/χ²值 | P值 | |
| 例数 | 115 | 115 | 103 | 103 | ||||
| 女性[例(%)] | 92(80.0) | 92(80.0) | 0.000 | 1 | 60(58.3) | 60(58.3) | 0.000 | 1 |
| 年龄(岁,) | 36.0±9.9 | 36.1±10.3 | -0.091 | 0.927 | 52.4±14.1 | 53.9±14.7 | -0.741 | 0.460 |
| 血管栓塞[例(%)] | - | 74(64.3) | - | 100(97.1) | ||||
| 病态妊娠[例(%)] | - | 56(60.9) | - | 4(6.7) | ||||
注:仅在女性患者中分析病态妊娠的发生率;-为无数据
采集患者及健康对照清晨空腹静脉血3 ml,以3 000 转/min离心10 min后收集上层血清。以化学发光免疫分析法(iFlash 3000,深圳亚辉龙生物科技股份有限公司)检测血清样本中IgA、IgG和IgM型aCL及aβ2GPI,检测所需试剂、定标品、质控品均为商品化试剂,由深圳亚辉龙生物科技股份有限公司生产提供。依据国标GB/T 21415-2008[8]要求,aCL或aβ2GPI的检测结果可分别溯源至国际人标准血清或亚辉龙参考血清。各项目阳性判断界限值由制造商提供,均通过收集包括健康对照、APS患者及其他自身免疫性疾病患者在内的共计300例个体,利用受试者工作特征(ROC)曲线选取最适相对特异度和相对灵敏度所对应的浓度值作为临界值。不同项目的阳性判断标准分别为:IgG-aCL>10 GPLU/ml,IgM-aCL>10 MPLU/ml,IgA-aCL>10 APLU/ml,IgG/IgM/IgA-aβ2GPI>20 AU/ml。
aCL阳性代表受检血清中存在IgA/IgG/IgM中一种或多种抗心磷脂抗体阳性,同理,aβ2GPI阳性指代至少检出一种抗β2糖蛋白Ⅰ抗体。相对地,若在三种不同类型的aCL(或aβ2GPI)中仅有一种型别的抗体呈阳性,则称该型aCL(或aβ2GPI)呈孤立阳性。
将APS患者分别根据是否存在IgA、IgG或IgM型aPL分组,分析阴、阳性组间血管栓塞、病态妊娠、脑卒中、急性冠脉综合征、肺栓塞、心脏瓣膜损伤、肾脏受累、自身免疫性溶血性贫血、血小板减少症等APS相关临床表现的发生是否有差异。
采用SPSS 25.0和MedCalc软件进行统计分析。正态分布的计量资料以表示,组间比较采用独立样本t检验,非正态分布的计量资料以M(Q1,Q3)表示,组间比较采用Mann-Whitney U检验;计数资料以频数(百分率)表示,组间比较采用χ²检验和Fisher精确检验。采用ROC曲线及曲线下面积(AUC)分析各项指标对APS的诊断价值。以二分类logistic回归分析各临床指标与抗磷脂抗体检测结果的关联。双侧检验,取α=0.05。
SAPS组中,女性患者占比(87.1%)明显高于PAPS组(61.5%,χ²=14.819,P<0.001),该组患者发生血管栓塞的比例(90.0%)也较PAPS组(75.0%)更高(χ²=6.637,P=0.010)。相对地,PAPS组既往有吸烟史或目前仍吸烟的个体较多(25.7%比7.1%,χ²=10.308,P=0.001),且该组女性患者更易发生病态妊娠(49.5%比24.6%,χ²=9.447,P=0.002)。高血压、糖尿病、脂代谢紊乱、恶性肿瘤等指标的组间差异均无统计学意义(均P>0.05),具体见表2。

抗磷脂综合征(APS)患者的基础临床资料[例(%)]
抗磷脂综合征(APS)患者的基础临床资料[例(%)]
| 项目 | PAPS组 (n=148) | SAPS组 (n=70) | t/χ²值 | P值 |
|---|---|---|---|---|
| 女性 | 91(61.5) | 61(87.1) | 14.819 | <0.001 |
| 年龄(岁)a | 45.6±15.4 | 42.4±15.2 | -1.439 | 0.152 |
| 吸烟 | 38(25.7) | 5(7.1) | 10.308 | 0.001 |
| 高血压 | 26(17.6) | 20(28.6) | 3.456 | 0.063 |
| 糖尿病 | 13(8.8) | 6(8.6) | 0.003 | 0.959 |
| 脂代谢紊乱 | 50(33.8) | 27(38.6) | 0.477 | 0.490 |
| 恶性肿瘤 | 10(6.8) | 3(4.3) | 0.557b | |
| 血管栓塞 | 111(75.0) | 63(90.0) | 6.637 | 0.010 |
| 病态妊娠c | 45(49.5) | 15(24.6) | 9.447 | 0.002 |
注:a;bFisher精确检验;c仅在女性患者中分析病态妊娠的发生率并进行相关统计分析;PAPS为原发性APS;SAPS为继发性APS
IgA与IgG型aPL的阳性率及抗体浓度均从对照组、PAPS组到SAPS组顺次递增。而IgM-aCL与IgM-aβ2GPI在SAPS组的阳性率及抗体浓度均略低于PAPS组,但差异无统计学意义(均P>0.05)(表3)。对照组与APS组间IgA型aPL孤立阳性率的差异无统计学意义(均P>0.05);而原发与继发性APS间除外IgG-aCL(χ²=6.009,P=0.014),其他不同类型aPL孤立阳性率的组间差异均无统计学意义(均P>0.05)。不同组间IgA-aCL或IgA-aβ2GPI孤立阳性的个体中,IgA型抗体的浓度分布差异均无统计学意义(均P>0.05)(表4、5)。
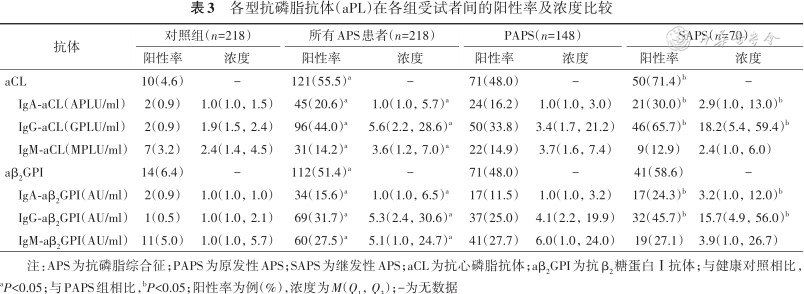
各型抗磷脂抗体(aPL)在各组受试者间的阳性率及浓度比较
各型抗磷脂抗体(aPL)在各组受试者间的阳性率及浓度比较
| 抗体 | 对照组(n=218) | 所有APS患者(n=218) | PAPS(n=148) | SAPS(n=70) | ||||
|---|---|---|---|---|---|---|---|---|
| 阳性率 | 浓度 | 阳性率 | 浓度 | 阳性率 | 浓度 | 阳性率 | 浓度 | |
| aCL | 10(4.6) | - | 121(55.5)a | - | 71(48.0) | - | 50(71.4)b | - |
IgA-aCL(APLU/ml) | 2(0.9) | 1.0(1.0,1.5) | 45(20.6)a | 1.0(1.0,5.7)a | 24(16.2) | 1.0(1.0,3.0) | 21(30.0)b | 2.9(1.0,13.0)b |
IgG-aCL(GPLU/ml) | 2(0.9) | 1.9(1.5,2.4) | 96(44.0)a | 5.6(2.2,28.6)a | 50(33.8) | 3.4(1.7,21.2) | 46(65.7)b | 18.2(5.4,59.4)b |
IgM-aCL(MPLU/ml) | 7(3.2) | 2.4(1.4,4.5) | 31(14.2)a | 3.6(1.2,7.0)a | 22(14.9) | 3.7(1.6,7.4) | 9(12.9) | 2.4(1.0,6.0) |
| aβ2GPI | 14(6.4) | - | 112(51.4)a | - | 71(48.0) | - | 41(58.6) | - |
IgA-aβ2GPI(AU/ml) | 2(0.9) | 1.0(1.0,1.0) | 34(15.6)a | 1.0(1.0,6.5)a | 17(11.5) | 1.0(1.0,3.2) | 17(24.3)b | 3.2(1.0,12.0)b |
IgG-aβ2GPI(AU/ml) | 1(0.5) | 1.0(1.0,2.1) | 69(31.7)a | 5.3(2.4,30.6)a | 37(25.0) | 4.1(2.2,19.9) | 32(45.7)b | 15.7(4.9,56.0)b |
IgM-aβ2GPI(AU/ml) | 11(5.0) | 1.0(1.0,5.7) | 60(27.5)a | 5.1(1.0,24.7)a | 41(27.7) | 6.0(1.0,24.0) | 19(27.1) | 3.9(1.0,26.7) |
注:APS为抗磷脂综合征;PAPS为原发性APS;SAPS为继发性APS;aCL为抗心磷脂抗体;aβ2GPI为抗β2糖蛋白Ⅰ抗体;与健康对照相比,aP<0.05;与PAPS组相比,bP<0.05;阳性率为例(%),浓度为M(Q1,Q3);-为无数据
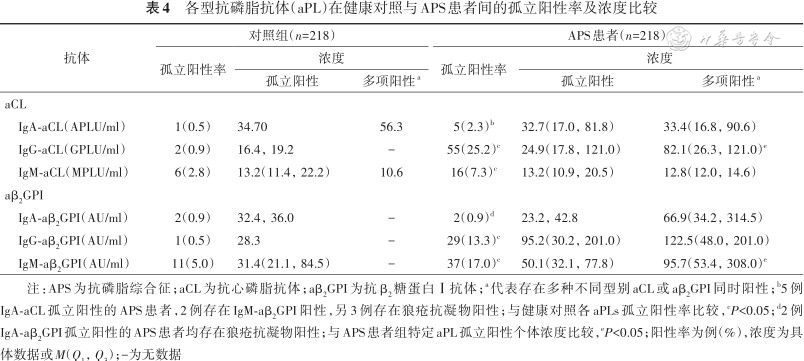
各型抗磷脂抗体(aPL)在健康对照与APS患者间的孤立阳性率及浓度比较
各型抗磷脂抗体(aPL)在健康对照与APS患者间的孤立阳性率及浓度比较
| 抗体 | 对照组(n=218) | APS患者(n=218) | ||||
|---|---|---|---|---|---|---|
| 孤立阳性率 | 浓度 | 孤立阳性率 | 浓度 | |||
| 孤立阳性 | 多项阳性a | 孤立阳性 | 多项阳性a | |||
| aCL | ||||||
IgA-aCL(APLU/ml) | 1(0.5) | 34.70 | 56.3 | 5(2.3)b | 32.7(17.0,81.8) | 33.4(16.8,90.6) |
IgG-aCL(GPLU/ml) | 2(0.9) | 16.4,19.2 | - | 55(25.2)c | 24.9(17.8,121.0) | 82.1(26.3,121.0)e |
IgM-aCL(MPLU/ml) | 6(2.8) | 13.2(11.4,22.2) | 10.6 | 16(7.3)c | 13.2(10.9,20.5) | 12.8(12.0,14.6) |
| aβ2GPI | ||||||
IgA-aβ2GPI(AU/ml) | 2(0.9) | 32.4,36.0 | - | 2(0.9)d | 23.2,42.8 | 66.9(34.2,314.5) |
IgG-aβ2GPI(AU/ml) | 1(0.5) | 28.3 | - | 29(13.3)c | 95.2(30.2,201.0) | 122.5(48.0,201.0) |
IgM-aβ2GPI(AU/ml) | 11(5.0) | 31.4(21.1,84.5) | - | 37(17.0)c | 50.1(32.1,77.8) | 95.7(53.4,308.0)e |
注:APS为抗磷脂综合征;aCL为抗心磷脂抗体;aβ2GPI为抗β2糖蛋白Ⅰ抗体;a代表存在多种不同型别aCL或aβ2GPI同时阳性;b5例IgA-aCL孤立阳性的APS患者,2例存在IgM-aβ2GPI阳性,另3例存在狼疮抗凝物阳性;与健康对照各aPLs孤立阳性率比较,cP<0.05;d2例IgA-aβ2GPI孤立阳性的APS患者均存在狼疮抗凝物阳性;与APS患者组特定aPL孤立阳性个体浓度比较,eP<0.05;阳性率为例(%),浓度为具体数据或M(Q1,Q3);-为无数据
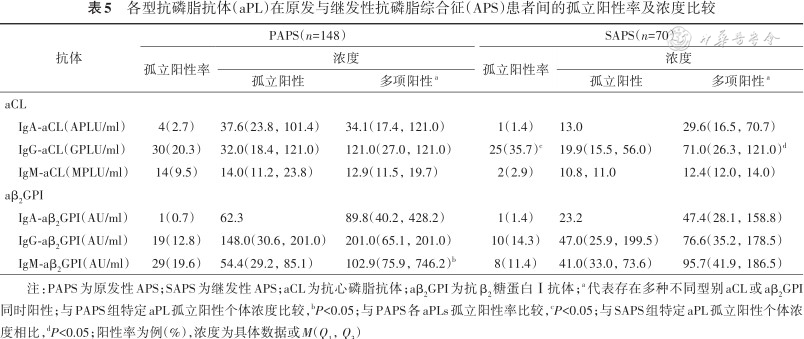
各型抗磷脂抗体(aPL)在原发与继发性抗磷脂综合征(APS)患者间的孤立阳性率及浓度比较
各型抗磷脂抗体(aPL)在原发与继发性抗磷脂综合征(APS)患者间的孤立阳性率及浓度比较
| 抗体 | PAPS(n=148) | SAPS(n=70) | ||||
|---|---|---|---|---|---|---|
| 孤立阳性率 | 浓度 | 孤立阳性率 | 浓度 | |||
| 孤立阳性 | 多项阳性a | 孤立阳性 | 多项阳性a | |||
| aCL | ||||||
IgA-aCL(APLU/ml) | 4(2.7) | 37.6(23.8,101.4) | 34.1(17.4,121.0) | 1(1.4) | 13.0 | 29.6(16.5,70.7) |
IgG-aCL(GPLU/ml) | 30(20.3) | 32.0(18.4,121.0) | 121.0(27.0,121.0) | 25(35.7)c | 19.9(15.5,56.0) | 71.0(26.3,121.0)d |
IgM-aCL(MPLU/ml) | 14(9.5) | 14.0(11.2,23.8) | 12.9(11.5,19.7) | 2(2.9) | 10.8,11.0 | 12.4(12.0,14.0) |
| aβ2GPI | ||||||
IgA-aβ2GPI(AU/ml) | 1(0.7) | 62.3 | 89.8(40.2,428.2) | 1(1.4) | 23.2 | 47.4(28.1,158.8) |
IgG-aβ2GPI(AU/ml) | 19(12.8) | 148.0(30.6,201.0) | 201.0(65.1,201.0) | 10(14.3) | 47.0(25.9,199.5) | 76.6(35.2,178.5) |
IgM-aβ2GPI(AU/ml) | 29(19.6) | 54.4(29.2,85.1) | 102.9(75.9,746.2)b | 8(11.4) | 41.0(33.0,73.6) | 95.7(41.9,186.5) |
注:PAPS为原发性APS;SAPS为继发性APS;aCL为抗心磷脂抗体;aβ2GPI为抗β2糖蛋白Ⅰ抗体;a 代表存在多种不同型别aCL或aβ2GPI同时阳性;与PAPS组特定aPL孤立阳性个体浓度比较,bP<0.05;与PAPS各aPLs孤立阳性率比较,cP<0.05;与SAPS组特定aPL孤立阳性个体浓度相比,dP<0.05;阳性率为例(%),浓度为具体数据或M(Q1,Q3)
ROC曲线(图1)分析显示,单独使用时,IgG型aPL对APS的诊断价值最高,其中IgG-aCL的AUC及其95%置信区间为0.776(0.729,0.824),而IgG-aβ2GPI的AUC为0.869(0.834,0.905)。IgA与IgM型aPL用于诊断APS的AUC相当,其各自的AUC分别为IgA-aCL:0.586(0.532,0.641);IgA-aβ2GPI:0.664(0.613,0.716);IgM-aCL:0.586(0.532,0.641);IgM-aβ2GPI:0.659(0.608,0.711)。将AUC进行比较时发现,IgA-aCL与IgM-aCL,Z=0.002,P=0.999;IgA-aβ2GPI与IgM-aβ2GPI,Z=0.163,P=0.870。


联合IgG/IgM-aCL的诊断效能明显优于IgG-aCL单独使用时[IgG/IgM-aCL的AUC为0.833(0.795,0.872),IgG-aCL比IgG/IgM-aCL,Z=3.623,P<0.001],而加入IgA-aCL并不能进一步提升对APS的诊断价值[IgA/IgG/IgM-aCL的AUC为0.833(0.794,0.872),IgG/IgM-aCL比IgA/IgG/IgM-aCL,Z=1.064,P=0.287]。对aβ2GPI而言,联合IgG/IgM[AUC为0.875(0.841,0.910)]或IgA/IgG/IgM型抗体[AUC为0.875(0.840,0.909)]的诊断效能与IgG-aβ2GPI单独使用时相较,均无显著差异(IgG/IgM-aβ2GPI比IgG-aβ2GPI,Z=0.841,P=0.401;IgA/IgG/IgM-aβ2GPI比IgG-aβ2GPI,Z=0.781,P=0.435)。
IgA-aPL阳性APS患者发生心脏瓣膜损伤(χ²=4.073,P=0.044)及血小板减少症(χ²=6.012,P=0.014)的比例更高,差异均有统计学意义。而IgG-aPL阳性患者更易出现血小板较少(IgG-aPL阳性与IgG-aPL阴性:45.8%与27.0%,χ²=8.153,P=0.004),且疾病更易累及肾脏(IgG-aPL阳性与IgG-aPL阴性:18.8%与8.2%,χ²=5.086,P=0.024)(表6)。
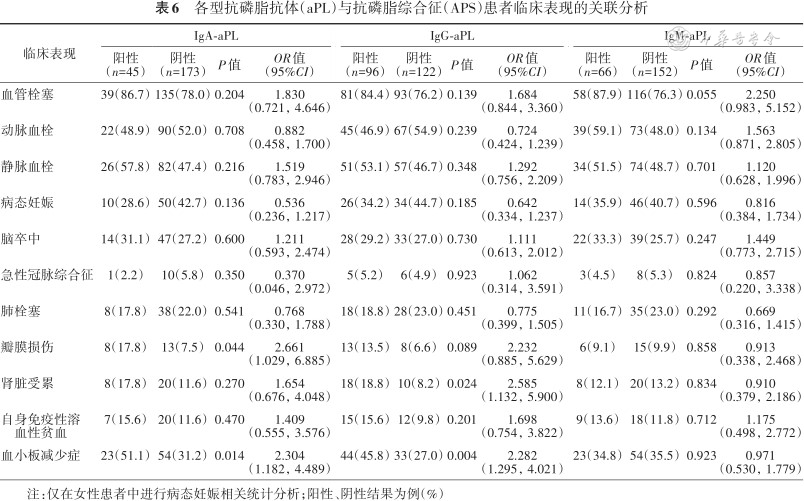
各型抗磷脂抗体(aPL)与抗磷脂综合征(APS)患者临床表现的关联分析
各型抗磷脂抗体(aPL)与抗磷脂综合征(APS)患者临床表现的关联分析
| 临床表现 | IgA-aPL | IgG-aPL | IgM-aPL | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
阳性 (n=45) | 阴性 (n=173) | P值 | OR值 (95%CI) | 阳性 (n=96) | 阴性 (n=122) | P值 | OR值 (95%CI) | 阳性 (n=66) | 阴性 (n=152) | P值 | OR值 (95%CI) | |||
| 血管栓塞 | 39(86.7) | 135(78.0) | 0.204 | 1.830 (0.721,4.646) | 81(84.4) | 93(76.2) | 0.139 | 1.684 (0.844,3.360) | 58(87.9) | 116(76.3) | 0.055 | 2.250 (0.983,5.152) | ||
| 动脉血栓 | 22(48.9) | 90(52.0) | 0.708 | 0.882 (0.458,1.700) | 45(46.9) | 67(54.9) | 0.239 | 0.724 (0.424,1.239) | 39(59.1) | 73(48.0) | 0.134 | 1.563 (0.871,2.805) | ||
| 静脉血栓 | 26(57.8) | 82(47.4) | 0.216 | 1.519 (0.783,2.946) | 51(53.1) | 57(46.7) | 0.348 | 1.292 (0.756,2.209) | 34(51.5) | 74(48.7) | 0.701 | 1.120 (0.628,1.996) | ||
| 病态妊娠 | 10(28.6) | 50(42.7) | 0.136 | 0.536 (0.236,1.217) | 26(34.2) | 34(44.7) | 0.185 | 0.642 (0.334,1.237) | 14(35.9) | 46(40.7) | 0.596 | 0.816 (0.384,1.734) | ||
| 脑卒中 | 14(31.1) | 47(27.2) | 0.600 | 1.211 (0.593,2.474) | 28(29.2) | 33(27.0) | 0.730 | 1.111 (0.613,2.012) | 22(33.3) | 39(25.7) | 0.247 | 1.449 (0.773,2.715) | ||
| 急性冠脉综合征 | 1(2.2) | 10(5.8) | 0.350 | 0.370 (0.046,2.972) | 5(5.2) | 6(4.9) | 0.923 | 1.062 (0.314,3.591) | 3(4.5) | 8(5.3) | 0.824 | 0.857 (0.220,3.338) | ||
| 肺栓塞 | 8(17.8) | 38(22.0) | 0.541 | 0.768 (0.330,1.788) | 18(18.8) | 28(23.0) | 0.451 | 0.775 (0.399,1.505) | 11(16.7) | 35(23.0) | 0.292 | 0.669 (0.316,1.415) | ||
| 瓣膜损伤 | 8(17.8) | 13(7.5) | 0.044 | 2.661 (1.029,6.885) | 13(13.5) | 8(6.6) | 0.089 | 2.232 (0.885,5.629) | 6(9.1) | 15(9.9) | 0.858 | 0.913 (0.338,2.468) | ||
| 肾脏受累 | 8(17.8) | 20(11.6) | 0.270 | 1.654 (0.676,4.048) | 18(18.8) | 10(8.2) | 0.024 | 2.585 (1.132,5.900) | 8(12.1) | 20(13.2) | 0.834 | 0.910 (0.379,2.186) | ||
| 自身免疫性溶血性贫血 | 7(15.6) | 20(11.6) | 0.470 | 1.409 (0.555,3.576) | 15(15.6) | 12(9.8) | 0.201 | 1.698 (0.754,3.822) | 9(13.6) | 18(11.8) | 0.712 | 1.175 (0.498,2.772) | ||
| 血小板减少症 | 23(51.1) | 54(31.2) | 0.014 | 2.304 (1.182,4.489) | 44(45.8) | 33(27.0) | 0.004 | 2.282 (1.295,4.021) | 23(34.8) | 54(35.5) | 0.923 | 0.971 (0.530,1.779) | ||
注:仅在女性患者中进行病态妊娠相关统计分析;阳性、阴性结果为例(%)
APS的临床表现复杂多变,可累及多种器官、组织,严重者可因短时间内发生的血栓及炎症风暴导致患者直接死亡[9, 10]。增加现行实验室标准以外的aPL检测,可能有助于提高APS检出率,进而促进临床医师积极干预,改善患者临床结局,但也可能导致过度诊疗及医疗资源浪费。因此,全面评价“非标准”aPL的APS诊断价值至关重要。
本研究依据目前临床实践中广泛应用的APS分类标准,严格纳入疾病患者。结果发现疾病组中,IgA-aCL、IgA-aβ2GPI的阳性率分别为20.6%、15.6%,明显低于IgG-aPL;而IgA-aCL、IgA-aβ2GPI各自的孤立阳性率仅为2.3%、0.9%,即IgA-aPL多数情况下与IgG/IgM型aPL共存。同时,健康对照人群中,IgA-aCL、IgA-aβ2GPI的孤立阳性率可分别达到0.5%、0.9%,与IgG或IgM型aPL不同,IgA型aPL的孤立阳性并不能用于有效识别APS患者(P=0.216、1)。Chayoua等[11]和Vlagea等[12]的研究与本研究结论一致。
本研究中,IgA-aCL与IgA-aβ2GPI用于诊断APS的AUC相对较低,仅分别为0.586及0.664,与IgM-aPL相当;而Liu等[13]在中国人群中的研究指出前两者用于APS诊断的AUC可分别达到0.814与0.778,显著高于IgM-aPL,与本研究结论差异明显。Liu等[13]的研究中纳入了部分血清阴性APS患者——即临床症状符合疾病表现但实验室检查阴性的患者,这可能是造成分歧的主要原因。本研究与Liu等[13]的研究均提示IgG-aPL单独应用时,对APS的诊断价值最大。通过比较aPL二联与三联检测对诊断APS的价值,笔者发现将IgA-aPL加入现有实验室诊断项目中,并不能进一步提升对APS的诊断效能。这与既往在其他人种APS患者中的研究结论一致,即检测IgA-aPL无益于提高APS检出率[6,14]。
本研究还发现IgA-aPL存在可能与心脏瓣膜损伤及血小板减少症发生相关,这可能源于IgA-aPL的促血栓形成作用[15]。血栓形成可导致血小板消耗性减少,同时也是瓣膜损伤的重要原因。另外,包括IgA在内的免疫球蛋白于瓣膜处沉积,进而诱导局部粥样斑块形成,也可损伤瓣膜[16]。以IgA-aPL阳性与否,对APS进行危险分层,提请临床医师关注此类患者的心脏并发症及血小板减少问题,可能有助于指导个体化治疗。但鉴于影像学检测方便快捷,对心脏瓣膜损伤的检出也更为准确可靠,同时IgG-aPL阳性患者血小板减少发生率亦较高,而IgA-aPL常与之共存,因此APS患者检测IgA-aPL的临床意义相对较小。
综上所述,本研究同时纳入中国东北及西南地区APS患者进行研究,发现IgA型抗磷脂抗体与心脏瓣膜损伤、血小板减少等APS临床表现相关。但是,在已有的狼疮抗凝物、IgG/IgM型aCL和aβ2GPI等血清学标志物基础上,增加IgA-aCL与IgA-aβ2GPI并不能进一步提升实验室检查对APS的预测价值。因此,出于卫生经济学考虑,尚不支持将IgA型抗磷脂抗体纳入临床疑诊APS患者的常规检测当中。本研究属小样本回顾性研究,可能影响统计方法的检验效能,并且不同医院纳入的疾病个体间存在年龄差异,仍有必要进一步扩大样本量以确认IgA-aPL对APS诊断有无附加价值。
所有作者均声明不存在利益冲突



























