
通过弥散张量成像(DTI)技术测定脊髓型颈椎病(CSM)患者颈脊髓最大压迫节段(MCL)的弥散信号,分析术前至术后5年的DTI参数同患者临床功能评分的相关性。
采用前瞻性的研究方法分析北京朝阳医院2014年2月至2020年2月37例手术治疗的CSM患者临床资料,使用DTI对MCL进行研究。比较颈椎前路间盘切除融合术(ACDF)术前至术后5年CSM患者弥散指标变化[各向异性(FA)]和患者临床功能评分,包括改良日本骨科协会评分(mJOA)、颈椎功能障碍指数(NDI)和疼痛视觉模拟评分(VAS)。在每个随访点采集相关数据,并观察MRI T2加权像(T2WI)中是否可观测到脊髓髓内高信号。对比术前和术后随访节点的变化,并分析FA值和临床功能评分的相关性。
最终37例患者纳入研究,年龄(55±10)岁,男14例,女23例。所有患者均顺利完成手术,髓性症状改善明显。术后3个月mJOA相较术前平均改善(2.62±1.41)分(P<0.001),FA值平均改善(0.14±0.11)(P<0.01),且mJOA和FA值在术前及术后两年各随访节点相互之间差异均有统计学意义(均P<0.05)。在MCL节段,术前及术后FA值和mJOA评分呈正相关(rs=0.770、0.729,均P<0.01)。mJOA同NDI和VAS之间无相关性(均P>0.05)。
DTI可敏感地反映脊髓功能的改善,可作为预测及评价CSM脊髓功能障碍状态的重要工具。

脊髓型颈椎病(cervical spondylotic myelopathy,CSM)是55岁以上最常见的导致颈脊髓功能障碍的疾病之一[1]。目前诊断CSM最有价值的影像学检查是颈椎磁共振成像(MRI),其可提供清晰的颈脊髓影像,并可观察脊髓压迫程度和脊髓内信号的改变[2]。但研究表明传统MRI的敏感性较低(15%~65%)[3],只能提供最原始的定性信息。目前尚无办法定量评估脊髓功能受损情况及其微观结构变化。弥散张量成像(DTI)可提供定量的信息并检测出比常规MRI分辨率更高的微观结构变化[4]。DTI的变化比髓内高信号的发展要快,尤其是在脊髓已经受到压迫变形但在T2加权像(T2WI)没有高信号征象的患者中也是如此[5]。最常见的DTI指标是各向异性参数(FA)。FA对脊髓内水分变化更加敏感,能更早地发现脊髓损伤。本研究应用DTI分析CSM患者术前及术后FA值,并和一系列临床功能评分相比较并分析其关联性,进而在临床工作中对CSM患者脊髓损伤程度诊断做出判断[6]。
本研究采用前瞻性的队列研究方法纳入自2014年2月至2020年2月于北京朝阳医院就诊的CSM患者共55例。纳入标准:(1)明确诊断为CSM;(2)MRI影像表现同CSM诊断相符;(3)术前及术后影像学资料完整;(4)行前路单节段颈椎间盘切除内固定术(ACDF)。排除标准:(1)既往有脊柱手术史;(2)既往有颈椎外伤史;(3)脑卒中或其他神经系统疾病;(4)影像学表现同体征不完全相符;(5)无颈椎管狭窄症表现;(6)存在MRI检查禁忌(如幽闭恐惧症)。最终37例患者纳入研究。所有手术均由同一医师团队完成。本研究获得朝阳医院伦理委员会审核,所有患者均签署知情同意书。
本研究通过客观评分问卷形式量化患者神经功能状况以便分析。改良日本骨科学会评分(mJOA)用于评估神经系统功能(如感觉和膀胱功能);颈部残障指数(NDI)和视觉模拟评分(VAS)分别用于评估功能障碍和疼痛程度。所有问卷调查于术前、术后3个月及1~5年进行。术后mJOA恢复率计算公式为(术后mJOA评分-术前mJOA评分)/(17-术前mJOA评分)×100%。恢复率>50%认为症状明显改善。
所有MRI数据(包括DTI扫描)均由Philips 3-T Achieva TX(荷兰飞利浦公司)MRI扫描仪应用16排神经血管射频线圈完成。多次激发、高分辨DTI数据采用二维导航交错平面回波成像(EPI)序列获得。外围脉冲单元(PPU)触发器被用来抑制脑脊液(CSF)脉冲伪像(触发延迟100 ms)。在矢状面和轴向面均采集影像数据。对于矢状面脊柱DTI,成像参数如下:激发次数10次;b=0和600 s/mm2;弥散方向数=10;平均信号数(NSA)=2;层面数=5(中央层面位于脊柱中部);采集时间=大约10.5 min(取决于心率)。轴向扫描的成像参数为:激发次数=8;b=0和600 s/mm2;弥散方向数=15;NSA=1;层面数=5;采集时间,大约6.5 min(取决于心率)。扫描层面位于被抑制的区域周围。所有患者于各随访点使用相同序列重复扫描同一位置。
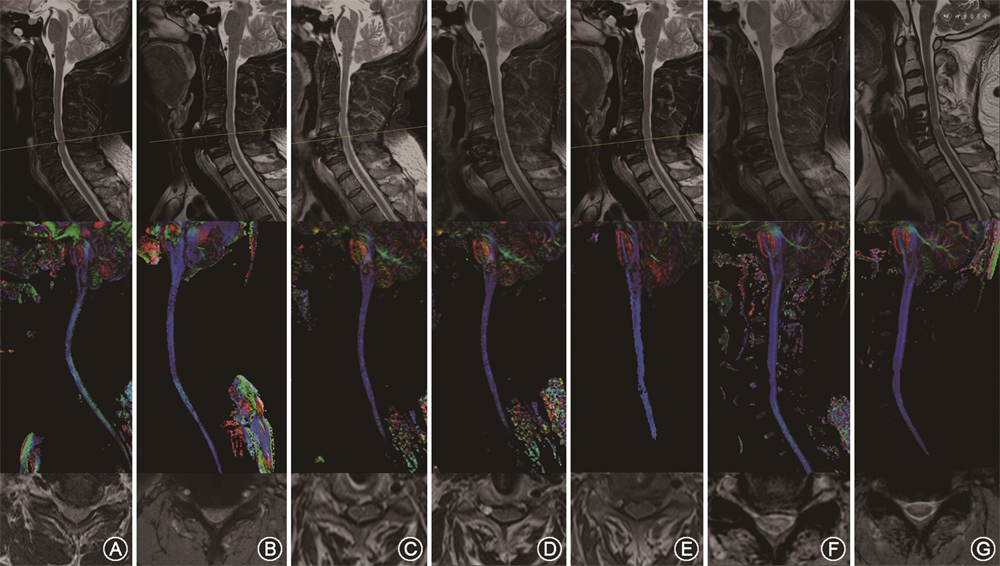
弥散加权图像重建后,利用DTI Studio计算FA和特征值(λ1、λ2、λ3)。首先,利用矢状面T2WI来识别狭窄节段。然后在轴向T2WI和b0图像脊髓受压最终水平上绘制感兴趣区(ROIs)(图1)。ROI由2名本院拥有30年以上经验的脊柱外科主任医师手动划取,在轴向T2WI多快速场回波图像作为区分CSF和脊髓边界的参考,并选取T2WI多快速场回波上颈脊髓压迫最严重节段(MCL)的压迫最严重层面(同一节段层面数为5层选取中间层面即第3层)。DTI参数例如FA等值,从相应ROI中提取并计算平均值,若差异超过20%则请第3名上级主任医师进行测量(图1)。


采用SPSS 25.0软件进行统计学分析。符合正态分布的计量数据采用表示,不符合正态分布的数据采用M(Q1,Q3)表示,术前和术后平均FA值及mJOA、NDI和VAS评分的比较采用双尾配对t检验。使用Spearman相关性检验分析临床功能评分和MRI参数的相关关系。对于手术前后多次数据进行重复测量的方差分析。双侧检验,取α=0.05。
根据纳入及排除标准,共计37例患者参与完成了本次研究,其中男14例,女23例,年龄(55±10)岁,随访时间(60.7±2.4)个月。参与研究的患者表现出不同程度的症状:包括手部精细动作无法完成、下肢僵硬、踏棉感、行走不稳等,其中出现精细动作无法完成者23例,下肢僵硬者16例,步态异常者16例。症状持续中位时间为24.0(12.0,35.0)个月。所有患者手术均顺利完成,无相关并发症出现。术后2年,所有患者的症状得到不同程度的缓解,其中22例术前出现持物不稳的患者中15例恢复至正常,15例术前有下肢僵硬症状的患者中10例恢复至正常,14例术前存在行走不稳的患者中8例恢复至正常。
患者的影像学表现中,术后3个月所有患者行MRI检查可发现手术对椎管的减压非常充分,但是脊髓内高信号并未恢复至正常,甚至在患者术后第5年的随访时依然可见脊髓内高信号。术前FA值为0.44±0.17,术后3个月为0.58±0.15,差异有统计学意义(t=-7.587,P<0.01),术后3个月与术后1年间、术后1年和术后2年间差异均有统计学意义(均P<0.05)。经单因素重复测量的方差分析,随着随访时间变化FA-MCL评分的改变差异有统计学意义,校正后F=157.111,P<0.01(表1)。

脊髓型颈椎病患者不同随访点各项评分情况()
脊髓型颈椎病患者不同随访点各项评分情况()
| 项目 | 术前 | 术后3个月 | 术后1年 | 术后2年 | 术后3年 | 术后4年 | 术后5年 | F值 | P值 |
|---|---|---|---|---|---|---|---|---|---|
| FA-MCL | 0.44±0.17 | 0.58±0.15a | 0.64±0.13ab | 0.68±0.12ac | 0.68±0.13a | 0.67±0.12a | 0.67±0.13a | 157.111 | <0.01 |
| mJOA | 12.0±2.2 | 14.3±1.9a | 15.4±1.5ab | 16.2±1.3ac | 16.3±1.4a | 16.4±1.1a | 16.5±1.1a | 192.663 | <0.01 |
| NDI | 9.7±2.7 | 3.3±2.1a | 3.5±2.0a | 3.2±2.7a | 3.0±2.5a | 3.0±1.9a | 2.8±1.5a | ||
| VAS | 5.67±1.63 | 1.00±1.10a | 0.95±1.01a | 1.21±1.21a | 1.15±1.22a | 1.32±1.11a | 1.01±0.11a |
注:FA-MCL为最大压迫层面的各向异性系数;mJOA为改良日本骨科协会评分;NDI为颈部残障指数;VAS为疼痛视觉模拟评分;因NDI和VAS评分不符合重复测量χ²检验的基本条件,未计算F及P值;与术前相比,aP<0.05;与术后3个月相比,bP<0.05;与术后1年相比,cP<0.05
患者术前mJOA为(12.0±2.2)分,术后5年改善至(16.5±1.1)分,评分平均改善(4.6±1.8)分;手术治疗后,所有患者mJOA的恢复率均超过50%;术后3个月与术前、术后3个月和术后1年、术后1年和术后2年差异均有统计学意义。经单因素重复测量方差分析,随着随访时间变化mJOA的改变差异有统计学意义,校正后F=192.663,P<0.001。术前VAS评分为(5.67±1.63)分,术后5年降至(1.01±0.11)分,平均降低(4.81±1.55)分,术后3个月与术前相比差异有统计学意义(t=5.29,P=0.003)。术前NDI评分为(9.7±2.7)分,术后5年降至(2.8±1.5)分,平均降低(8.1±1.8)分,术后3个月与术前相比差异有统计学意义(t=4.50,P=0.006)。
Spearman相关性检验分析发现,术前FA-MCL与术前mJOA评分呈正相关(rs=0.770,P<0.01),术后FA与术后mJOA量表评分也呈正相关(rs=0.729,P<0.001)(图2)。术前及术后FA与VAS或NDI无相关性(rs=-0.347、-0.097、-0.539、0.614,均P>0.05)。


患者女,59岁。因双上肢麻木无力2年,伴双下肢足底踩棉感6个月收入住院。术前MRI检查发现C4/5节段颈椎管狭窄,结合病史及查体表现考虑CSM诊断明确。术前行颈椎DTI扫描发现FA-MCL=0.425±0.021,术前mJOA评分10分。于本院行ACDF术,手术过程顺利,术后症状缓解。术后3个月复查时FA-MCL为0.475±0.012,mJOA评分14分,改善率57.1%(图3)。患者术后各时间点随访各指标见表2。


脊髓型颈椎病典型病例术后各指标结果(分)
脊髓型颈椎病典型病例术后各指标结果(分)
| 时间 | FA-MCL | mJOA | VAS |
|---|---|---|---|
| 术前 | 0.42±0.02 | 10 | 6 |
| 术后3个月 | 0.48±0.01 | 14 | 1 |
| 术后1年 | 0.54±0.02 | 15 | 1 |
| 术后2年 | 0.64±0.01 | 16 | 1 |
| 术后3年 | 0.63±0.03 | 16 | 1 |
| 术后4年 | 0.63±0.03 | 16 | 1 |
| 术后5年 | 0.62±0.03 | 17 | 1 |
注:FA-MCL为最大压迫层面的各向异性系数;mJOA为改良日本骨科协会评分;VAS为疼痛视觉模拟评分
传统CSM患者病情严重程度的评估方法主要依赖临床表现和体格检查和颈椎影像学检查如MRI,但是其只能间接而非量化地反映脊髓功能状态。研究发现,术前T2WI脊髓内高信号常提示术后神经功能预后不佳,但是T2WI高信号一旦形成,并不会随着脊髓压迫解除而消失:即患者术后mJOA评分有所改善,但脊髓内高信号仍可能存在。在本研究中,虽然术后3个月随访时在所有患者的MRI图像上都可见脊髓得到了充分的减压,而且mJOA量表评分和DTI指标均已经发生改变,但术后5年MRI上仍可检测到脊髓内高信号。Shabani等[7]综述结果显示MRI在CSM疾病预后中的应用,但MRI的异常信号同临床预后意义之间的关联仍存争议。所以目前传统的MRI并不能准确及时地反应脊髓的功能状态。
单次激发扩散成像(SS-DTI)已经应用于临床当中,但是由于金属内固定及椎体附近的敏感性变化引起B0场不均匀性,导致术后SS-DTI图像产生了明显的畸变,脊髓信号无法辨认,其对于CSM患者颈椎内固定融合术后脊髓功能评估的效果欠佳[8]。笔者与清华大学合作开发了多次激发扩散成像技术(MS-DTI)。这种新技术具有可量化、操作性及准确度较高等优势,其拥有至少6个扩散梯度方向,脊髓信号显示效果更好,并通过弥散成像降低伪影干扰,相对于SS-DTI可大幅降低伪影并提高图像的测量精度。而且传统的SS-DTI采集时间超过1 h,但笔者新开发的MS-DTI经过优化后,仅比常规的MRI扫描的基础上多8 min左右。所以无论从可行性、准确性及实用性来讲,MS-DTI都远优于SS-DTI和传统MRI成像效果。
有研究表明,CSM患者术前FA-MCL显著降低[9, 10, 11],并且术前FA-MCL与mJOA评分的恢复率相关。Guan等[12]的研究证实,DTI参数可区分CSM患者和健康受试者。Jones等[13]报告,术前FA值越高,术后获得良好的预后的可能性越大。本研究结果表明,CSM患者术前及术后FA-MCL和mJOA评分均呈正相关,也证实了Jones等[13]的研究结果。但目前只有少数研究关注术后DTI指标与临床结果之间的关系[14, 15],而且没有研究报道术后DTI指标的远期随访数据。本研究平均随访60.7个月,对于探究CSM患者DTI参数和脊髓功能随时间变化的关联有着重要的意义。根据本研究结果,术后患者mJOA和DTI参数同时在2年达到了最大值,且mJOA同FA值呈显著相关性(rs=0.729,P<0.01),这证实DTI可准确表达脊髓的功能状态。在2年之后的随访中,笔者注意到FA值随着随访时间延长有轻微下降,但较前差异无统计学意义。根据Mamata等[16]报道,在正常人的脊髓中随着年龄的增长,FA逐渐减小,所以本研究认为长期随访中FA值降低是由于颈脊髓的自然老化和退行性改变所导致。此外笔者注意到一些患者手术部位邻近节段的FA值下降,尽管MRI扫描未显示继发性退变或压迫的迹象,但是这些异常的发现提示邻近节脊髓损伤的早期预警。
本研究的主要局限性是样本量小,以后还需要更大的样本量来进行目的性研究。因为CSM减压手术的临床成功取决于手术干预的时机,在CSM的自然病程中,早期手术可以获得较好的预后,但是何时为“早期”需要一个量化指标。所以下一步本研究将对正常人群FA参考区间进行测量,并同CSM患者进行对比,结合患者神经功能状态来确定FA的临界值,以此来规划最佳的手术干预时间;此外整个操作过程中,ROI均为人工手动划取,目前无法通过技术手段自动根据信号高低划取ROI,而且对于在冠状位还是矢状位划取ROI存在争议。这样会导致些许的误差,但是对于FA-MCL的准确度不会有实质性影响。
综上,DTI相较于传统MRI成像可作为评估CSM患者脊髓功能状态的准确方法,并可提供脊髓微观结构信息,有助于解释不同程度神经功能障碍颈椎病患者术后临床状态的差异。
所有作者均声明不存在利益冲突



























