
探讨结直肠癌免疫细胞浸润模式,分析免疫细胞浸润与患者临床特征及总生存(OS)的相关性。
在癌症基因组图谱(TCGA)数据库中下载615例结直肠癌RNA测序数据,数据更新于2019年7月19日。包括结直肠癌肿瘤组织571例、癌旁组织44例,其中具有临床资料552例,包括生存时间、生存状态、年龄、性别、临床分期、分级、肿瘤部位等信息。采用CIBERSORT工具反卷积算法,基于标准化的基因表达数据计算出22种免疫细胞的相对含量。根据CIBERSORT算法的结果验证,选取反卷积结果准确性高的样本(P<0.05),用于分析和绘图。分析免疫细胞浸润模式与患者临床特征及OS的相关性。
采用CIBERSORT方法运行后过滤去除P≥0.05的样本,共筛选出肿瘤组织样本282例,癌旁组织样本16例;其中有临床信息者共293例,包括肿瘤组织样本277例、癌旁组织样本16例。293例样本中M0巨噬细胞、M1巨噬细胞、M2巨噬细胞、CD8+ T细胞及未活化的CD4记忆性T细胞占总免疫细胞的比例较高;在肿瘤组织样本中,M0巨噬细胞、M1巨噬细胞、活化的CD4记忆性T细胞、未活化的自然杀伤(NK)细胞表达量较高;在癌旁组织中,初始B细胞、M2巨噬细胞、活化的NK细胞、未活化的树突细胞、未活化的肥大细胞及浆细胞等表达量较高;随着临床分期的升高,滤泡辅助性T细胞、活化的CD4记忆性T细胞、活化的NK细胞、M1巨噬细胞表达量降低,浆细胞、调节性T细胞表达量升高,差异均有统计学意义(均P<0.05)。M1巨噬细胞、未活化的肥大细胞、活化的CD4记忆性T细胞、CD8+ T细胞、滤泡辅助性T细胞在右半结肠癌中表达量较高,而M0巨噬细胞、活化的肥大细胞在左半结肠和直肠癌中表达量较高,差异均有统计学意义(均P<0.05)。以浸润的免疫细胞的中位表达水平将患者分为高浸润组和低浸润组进行生存分析,结果显示初始B细胞浸润程度高的患者OS较好,而M2巨噬细胞、活化的肥大细胞、中性粒细胞浸润程度高的患者OS较差。
结直肠癌中不同分期、部位的样本中存在不同类型的免疫细胞浸润模式,且与肿瘤进展及患者OS密切相关,有望用于治疗靶点开发及预后预测。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
结直肠癌是发病率与死亡率均很高的恶性肿瘤[1,2],其表型和预后多样性使个性化的临床决策面临巨大的挑战。通过对癌细胞基因组和生物学变化的研究,可鉴定具有不同预后和治疗反应的患者亚组,并找到潜在的药物靶标。同时结直肠癌的恶性表型还与肿瘤相关免疫微环境及临床预后密切相关。结直肠癌中的肿瘤浸润免疫细胞(TIIC)包括T细胞、树突细胞、巨噬细胞、中性粒细胞、肥大细胞等,其类型、功能、密度和浸润位置能反映宿主防御和肿瘤进展情况,不仅对患者的生存具有预测价值,而且影响肿瘤对治疗的反应[3,4,5,6]。肿瘤相关的中性粒细胞与肿瘤患者不良预后有关,中性粒细胞与淋巴细胞的比值是影响患者总生存(OS)的重要指标[7,8]。肿瘤相关巨噬细胞(TAM)、调节性T细胞(Treg细胞)等也与结直肠癌肿瘤进展及预后相关[9,10]。针对TIIC相关的研究主要采用免疫组织化学和流式细胞术等对细胞表面标志物进行识别,由于技术的限制,不同研究对特定TIIC亚群的预后意义研究结果不同,如TAM在不同研究中提示与预后呈正相关或负相关[9,11]。反卷积算法可以从复杂组织的基因表达谱中计算免疫细胞的组成,通过流式细胞术在非小细胞肺癌、滤泡淋巴瘤中得到了很好的验证,能大规模应用于基因表达谱数据的分析[12]。本研究使用反卷积算法对癌症基因组图谱(TCGA)数据库中结直肠癌的基因表达谱数据进行计算,分析22种免疫细胞含量与结直肠癌临床特征及OS的相关性。
在TCGA数据库(https://portal.gdc.cancer.gov)中下载615例结直肠癌RNA测序数据,数据更新于2019年7月19日。包括结直肠癌肿瘤组织571例、癌旁组织44例,其中具有临床资料552例,包括生存时间、生存状态、年龄、性别、临床分期、分级、肿瘤部位等信息。
由Newman等[12]开发的反卷积算法是从RNA转录组数据中估算细胞类型丰度的方法(CIBERSORT工具),可以基于标准化的基因表达数据估算复杂组织的细胞组成,量化特定细胞类型的丰度。将标准化的结直肠癌基因表达数据转化为22种免疫细胞的含量,包括初始B细胞、记忆性B细胞、浆细胞、CD8+ T细胞、初始CD4+ T细胞、未活化的CD4记忆性T细胞、活化的CD4记忆性T细胞、滤泡辅助性T细胞、Treg细胞、γδT细胞、未活化的自然杀伤(NK)细胞、活化的NK细胞、单核细胞、M0巨噬细胞、M1巨噬细胞、M2巨噬细胞、未活化的树突细胞、活化的树突细胞、未活化的肥大细胞、活化的肥大细胞、嗜酸性粒细胞、中性粒细胞。将615例RNA测序数据整理为样本和基因表达量的矩阵,上传至CIBERSORT在线分析网站(https://cibersortx.stanford.edu)。通过将各样本的表达数据与22种免疫细胞基因表达参考矩阵进行比对和反卷积算法解析,得到各样本中免疫细胞的相对组成含量(每个样本中22种免疫细胞的含量总和为1),基于CIBERSORT算法原理,根据算法的结果验证,P≥0.05表示该样本的反卷积结果不可信,应剔除;P<0.05表示该样本反卷积结果可信,保留进入下一步分析。选取准确性高的样本(P<0.05),用于后续分析和绘图。
采用R 3.6.2和SPSS 25.0统计学软件进行数据分析。使用R软件包heatmap绘制各样本免疫细胞的组成图,用R软件包corrplot绘制免疫细胞的相关性热图。肿瘤组织与癌旁组织样本中各类免疫细胞相对含量的差异比较采用Wilcoxon秩和检验,并用R软件包vioplot绘制小提琴图。采用多样本Kruskal Wallis检验比较不同临床分期样本中各类免疫细胞含量的差异。采用χ2检验比较不同部位结直肠癌样本临床病理特征的差异,用两样本Wilcoxon秩和检验比较不同部位结直肠癌样本中各类免疫细胞含量的差异。根据免疫细胞的中位表达水平将患者分为高、低浸润组,使用Kaplan-Meier法进行生存分析,用R软件包survival绘制生存曲线。P<0.05为差异有统计学意义。
使用CIBERSORT工具运行后过滤去除P≥0.05的样本,共筛选出肿瘤组织样本282例,癌旁组织样本16例,其中有临床信息者共293例,包括肿瘤组织样本277例、癌旁组织样本16例。临床信息包括年龄、性别、TNM分期、肿瘤部位、生存状态和生存时间等。293例结直肠癌患者中,年龄>60岁(196例,66.9%)、男性(155例,52.9%)、Ⅱ期(119例,40.6%)、结肠肿瘤(255例,87.0%)患者居多。208例患者有肿瘤部位信息,以结肠脾曲为界,对左半结肠和直肠癌、右半结肠癌患者临床病理特征差异见表1。
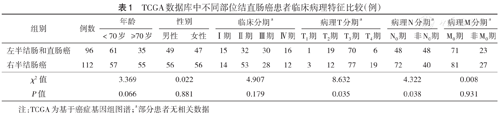
TCGA数据库中不同部位结直肠癌患者临床病理特征比较(例)
TCGA数据库中不同部位结直肠癌患者临床病理特征比较(例)
| 组别 | 例数 | 年龄 | 性别 | 临床分期a | 病理T分期a | 病理N分期a | 病理M分期a | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <70岁 | ≥70岁 | 男性 | 女性 | Ⅰ期 | Ⅱ期 | Ⅲ期 | Ⅳ期 | T1期 | T2期 | T3期 | T4期 | N0期 | 非N0期 | M0期 | 非M0期 | ||
| 左半结肠和直肠癌 | 96 | 61 | 35 | 49 | 47 | 15 | 32 | 30 | 16 | 1 | 19 | 70 | 6 | 48 | 48 | 71 | 23 |
| 右半结肠癌 | 112 | 57 | 55 | 56 | 56 | 14 | 53 | 28 | 12 | 3 | 12 | 77 | 19 | 72 | 40 | 81 | 27 |
| χ2值 | 3.369 | 0.022 | 4.907 | 8.632 | 4.322 | 0.008 | |||||||||||
| P值 | 0.066 | 0.881 | 0.179 | 0.035 | 0.038 | 0.931 | |||||||||||
注:TCGA为基于癌症基因组图谱;a部分患者无相关数据
根据筛选出的293例样本(包括肿瘤组织样本277例、癌旁组织样本16例)绘制免疫细胞组成图和热图显示,所有样本中M0巨噬细胞、M1巨噬细胞、M2巨噬细胞、CD8+ T细胞及未活化的CD4记忆性T细胞占总免疫细胞的比例较高(图1、图2)。

注:TCGA为癌症基因组图谱;共筛选出293例样本,包括肿瘤组织样本277例,癌旁组织样本16例;不同颜色柱状长度代表每种免疫细胞占总免疫细胞的比例;每个样本中22种免疫细胞的含量总和为1

注:TCGA为癌症基因组图谱;共筛选出293例样本,包括肿瘤组织样本277例,癌旁组织样本16例;红色表示高表达,绿色表示低表达
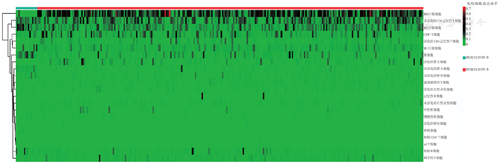
肿瘤组织和癌旁组织样本中免疫细胞浸润模式存在差异。在肿瘤组织中,M0巨噬细胞、M1巨噬细胞、活化的CD4记忆性T细胞、未活化的NK细胞表达量较高;在癌旁组织中,初始B细胞、M2巨噬细胞、活化的NK细胞、未活化的树突细胞、未活化的肥大细胞及浆细胞等表达量较高(图3),以上差异也可能与癌旁组织样本较少有关。根据22种免疫细胞之间的相关性热图(图4),在结直肠癌组织样本中,正相关性和负相关性最强为:CD8+ T细胞与活化的CD4记忆性T细胞呈正相关(r=0.46,P<0.01),CD8+ T细胞与M0巨噬细胞呈负相关(r=-0.44,P<0.01)。

注:TCGA为癌症基因组图谱;NK细胞为自然杀伤细胞;红色表示肿瘤组织样本,蓝色表示癌旁组织样本;1为初始B细胞;2为记忆性B细胞;3为浆细胞;4为CD8+ T细胞;5为初始CD4+ T细胞;6为未活化的CD4记忆性T细胞;7为活化的CD4记忆性T细胞;8为滤泡辅助性T细胞;9为调节性T细胞;10为γδT细胞;11为未活化的NK细胞;12为活化的NK细胞;13为单核细胞;14为M0巨噬细胞;15为M1巨噬细胞;16为M2巨噬细胞;17为未活化的树突细胞;18为活化的树突细胞;19为未活化的肥大细胞;20为活化的肥大细胞;21为嗜酸性粒细胞;22为中性粒细胞
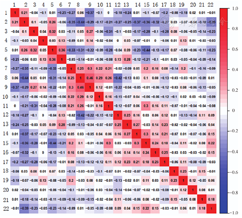

注:TCGA为癌症基因组图谱;NK细胞为自然杀伤细胞;红色越深表明正相关性越强,蓝色越深表明负相关性越强;格子中数字为相关系数;1为调节性T细胞;2为M0巨噬细胞;3未活化的NK细胞;4为活化的树突细胞;5为活化的肥大细胞;6为中性粒细胞;7为M1巨噬细胞;8为CD8+ T细胞;9为活化的CD4记忆性T细胞;10为滤泡辅助性T细胞;11为活化的NK细胞;12为未活化的CD4记忆性T细胞;13为嗜酸性粒细胞;14为未活化的树突细胞;15为未活化的肥大细胞;16为单核细胞;17为M2巨噬细胞;18为初始CD4+ T细胞;19为γδT细胞;20为记忆性B细胞;21为初始B细胞;22为浆细胞
从TCGA数据库中下载的结直肠癌临床信息包括年龄、性别、分期、肿瘤部位、生存状态和生存时间。不同临床分期结直肠癌样本的免疫细胞浸润模式比较结果显示,随着分期的升高,滤泡辅助性T细胞、活化的CD4记忆性T细胞、活化的NK细胞、M1巨噬细胞表达量降低,浆细胞、Treg细胞表达量升高,差异均有统计学意义(均P<0.05)(表2)。不同肿瘤部位,即左半结肠和直肠癌、右半结肠癌的免疫细胞浸润模式比较结果显示,M1巨噬细胞、未活化的肥大细胞、活化的CD4记忆性T细胞、CD8+ T细胞、滤泡辅助性T细胞在右半结肠癌中表达量较高,而M0巨噬细胞、活化的肥大细胞在左半结肠和直肠癌中表达量较高,差异有统计学意义(P<0.05)(表3)。
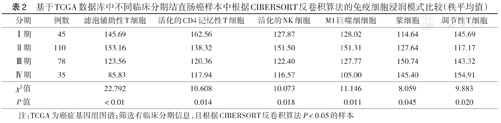
基于TCGA数据库中不同临床分期结直肠癌样本中根据CIBERSORT反卷积算法的免疫细胞浸润模式比较(秩平均值)
基于TCGA数据库中不同临床分期结直肠癌样本中根据CIBERSORT反卷积算法的免疫细胞浸润模式比较(秩平均值)
| 分期 | 例数 | 滤泡辅助性T细胞 | 活化的CD4记忆性T细胞 | 活化的NK细胞 | M1巨噬细细胞 | 浆细胞 | 调节性T细胞 |
|---|---|---|---|---|---|---|---|
| Ⅰ期 | 45 | 145.69 | 162.56 | 127.87 | 128.02 | 114.64 | 145.69 |
| Ⅱ期 | 110 | 153.16 | 138.32 | 151.50 | 151.31 | 127.64 | 117.17 |
| Ⅲ期 | 78 | 123.56 | 120.36 | 122.40 | 127.77 | 150.74 | 143.32 |
| Ⅳ期 | 35 | 85.83 | 117.94 | 116.57 | 105.00 | 145.40 | 154.91 |
| χ2值 | 22.792 | 10.608 | 10.073 | 11.146 | 8.059 | 9.883 | |
| P值 | <0.01 | 0.014 | 0.018 | 0.011 | 0.045 | 0.020 |
注:TCGA为癌症基因组图谱;筛选有临床分期信息,且根据CIBERSORT反卷积算法P<0.05的样本
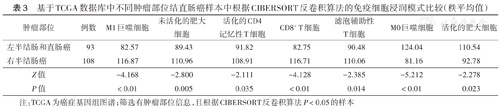
基于TCGA数据库中不同肿瘤部位结直肠癌样本中根据CIBERSORT反卷积算法的免疫细胞浸润模式比较(秩平均值)
基于TCGA数据库中不同肿瘤部位结直肠癌样本中根据CIBERSORT反卷积算法的免疫细胞浸润模式比较(秩平均值)
| 肿瘤部位 | 例数 | M1巨噬细胞 | 未活化的肥大细胞 | 活化的CD4记忆性T细胞 | CD8+ T细胞 | 滤泡辅助性T细胞 | M0巨噬细胞 | 活化的肥大细胞 |
|---|---|---|---|---|---|---|---|---|
| 左半结肠和直肠癌 | 93 | 82.57 | 89.43 | 91.82 | 82.75 | 90.48 | 124.04 | 110.54 |
| 右半结肠癌 | 108 | 116.87 | 110.96 | 108.91 | 116.71 | 110.06 | 81.16 | 92.78 |
| Z值 | -4.168 | -2.800 | -2.111 | -4.128 | -2.385 | -5.212 | -2.278 | |
| P值 | <0.01 | 0.005 | 0.035 | <0.01 | 0.014 | <0.01 | 0.023 |
注:TCGA为癌症基因组图谱;筛选有肿瘤部位信息,且根据CIBERSORT反卷积算法P<0.05的样本
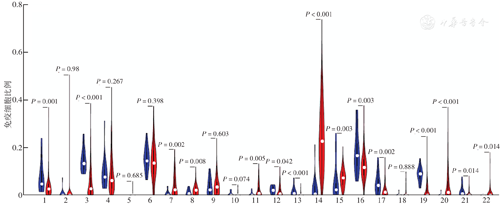
结合结直肠癌患者的生存数据与各样本中免疫细胞表达水平,以浸润的免疫细胞中位表达水平将患者分为高浸润组和低浸润组。生存分析结果显示,初始B细胞浸润程度高的患者OS较好。而M2巨噬细胞、活化的肥大细胞、中性粒细胞浸润程度高的患者OS较差(图5)。
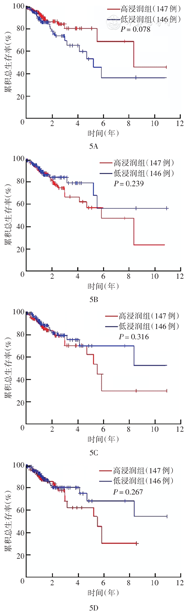

注:TCGA为癌症基因组图谱;以浸润的免疫细胞中位表达水平将患者分为高、低浸润组
本研究使用生物信息学工具CIBERSORT分析来源于TCGA数据库的293例结直肠癌组织样本的基因表达谱数据及临床数据,并根据表达谱数据分析免疫细胞的浸润模式。结果显示,结直肠癌患者中女性比例较男性低,年龄≥70岁、病理TNM分期较晚的患者主要分布在右半结肠癌患者中,与文献[13]报道的一致。
CIBERSORT反卷积算法利用22个不同免疫细胞亚群纯化的表达谱为参照,定义了基因在免疫细胞的表达特征,可以在不需要细胞类型特异性标记基因的情况下有效地区分这些细胞类型,从而通过复杂组织的表达谱数据计算出样本中细胞亚群的相对比例[12]。本研究发现在结直肠癌中,M0巨噬细胞、M1巨噬细胞、M2巨噬细胞、CD8+ T细胞、未活化的CD4记忆性T细胞占总免疫细胞的比例较高。在肿瘤组织样本中,M0巨噬细胞、M1巨噬细胞、活化的CD4记忆性T细胞、未活化的NK细胞表达较高;而在癌旁组织样本中,M2巨噬细胞、活化的NK细胞表达较高,这与文献[2]报道巨噬细胞在结直肠癌中有明显富集的结果一致。CD4记忆性T细胞作为T细胞的一个亚群,可以进一步分化并具有多种功能,可以辅助CD8细胞抑制肿瘤,抑制对自身和外来抗原的有害免疫反应,抑制NK细胞的杀伤作用[14,15],由此可见CD4记忆性T细胞在结直肠癌的发生、发展中发挥重要的作用。本研究发现在结直肠癌中,CD8+ T细胞与活化的CD4记忆性T细胞呈正相关(r=0.46,P<0.01),也可以看出活化的CD4记忆性T细胞对CD8+ T细胞的辅助作用。
本研究结果显示M1巨噬细胞、未活化的肥大细胞、活化的CD4记忆性T细胞、CD8+ T细胞、滤泡辅助性T细胞在右半结肠癌中表达较高,而M0巨噬细胞、活化的肥大细胞在左半结肠和直肠癌中表达较高。Zhang等[16]的研究指出在右半结肠癌中CD8细胞表达较高,左半结肠和直肠癌中NK细胞表达较高,并未提到CD4细胞、巨噬细胞及肥大细胞的差异。本研究结果可以为进一步研究左、右半结肠癌之间的差异提供思路。
既往有研究报道肿瘤相关中性粒细胞浸润、Treg细胞、TAM浸润程度与结直肠癌患者的预后有相关性。本研究中虽然未发现免疫细胞与OS有相关性,但通过生存曲线可以看出初始B细胞高浸润组患者OS较好,而M2巨噬细胞、活化的肥大细胞、中性粒细胞高浸润组患者OS较差。
总之,本研究通过CIBERSORT软件利用基因表达谱数据推测结直肠癌的免疫细胞浸润模式,分析其临床特征之间的相关性及对预后的预测价值。这种方法为研究免疫细胞与肿瘤的关系提供了新的途径和线索。随着对肿瘤浸润免疫细胞在肿瘤免疫中作用的不断深入研究,有望为开发结直肠癌新的有效预后预测指标以及治疗靶标提供理论依据。
所有作者均声明不存在利益冲突



























