
肝小静脉闭塞病(VOD)是进行造血干细胞移植期间发生的一种严重的并发症,本文介绍造血干细胞移植后肝小静脉闭塞病的特点,包括发病机制、危险因素、预测指标、诊断及治疗等,在疾病的早期诊断和治疗方面具有重要的指导意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肝小静脉闭塞病(VOD)又称肝窦阻塞综合征(SOS),是进行造血干细胞移植(HSCT)期间发生的一种严重的并发症,其特征为肝肿大、疼痛、黄疸和腹水。HSCT后VOD/SOS的中位发生率为13.7%(0~62%)[1]。严重的VOD/SOS的定义是存在多器官功能障碍(MOD),包括肾功能衰竭(血清肌酐≥正常值3倍或需要血液透析)或呼吸衰竭(室内空气氧饱和度<90%,或需依赖呼吸机),并与更高的死亡率(>80%)相关[2]。
肝脏窦状内皮损伤在VOD/SOS的发病机制中起核心作用,内皮损伤导致内皮细胞间的凝聚力下降,血管内皮细胞脱离,下游小叶中心静脉栓塞,最终形成窦后阻塞和窦后性门静脉高压。与初始内皮损伤有关的几种原因,包括清髓性预处理方案、受损组织产生的细胞因子、通过受损黏膜屏障迁移的内源性微生物产物、移植过程中使用的免疫抑制药物(如钙神经磷酸酶抑制剂)以及移植过程本身[3]。化学药物治疗药物经细胞色素P450复合物系统产生有毒的代谢物,再被谷胱甘肽(GSH)酶促系统转化为无毒的代谢物并被清除。肝脏的小叶中心区谷胱甘肽含量较低,对毒性物质更敏感,易受到损伤。而儿童酶促系统不成熟,导致解毒能力降低,可能是儿童VOD/SOS发生率较高的原因[4]。门静脉高压导致腹水、容量超载和钠含量增加,并损伤肺或肾组织,是VOD/SOS发生的关键病变。组织学特征包括终末肝小静脉和小叶下静脉的同心狭窄或纤维性闭塞,最终导致小叶窦样纤维化和肝细胞坏死[5]。目前,VOD/SOS病理生理机制尚不十分明确,仍需要进行大量基础研究。
VOD/SOS发生的危险因素通常分为与受者相关和与移植相关。与受者相关的危险因素包括女性、低龄、乙型肝炎/丙型肝炎血清学阳性、肝功能不良、肝毒性药物使用史、较低的Karnofsky评分、晚期血液病、噬血细胞综合征(HLH)和铁蛋白水平超负荷、腹部放射治疗;与移植相关的包括受者接受的预处理方案的类型,供、受者巨细胞病毒(CMV)血清阳性,使用西罗莫司预防移植物抗宿主病(GVHD),异基因移植和二次移植[6,7,8]。一项识别移植前VOD/SOS高形成倾向的风险评分系统,有利于早期识别高危受者,该研究主要确定6个有统计学意义的变量[1],为方便使用,此研究提供了自动风险评分计算网站(https://www.cibmtr.org/ReferenceCenter/Statistical/Tools/Pages/VOD.aspx),用于计算每位受者发生VOD/SOS的概率,结果所得百分比越大,风险越高。
临床表现是体重迅速增加、黄疸,肝肿大、腹水和疼痛。轻度VOD/SOS受者几周内症状可自行消退,重度伴有器官损害和多器官功能衰竭尤其是肺和肾功能损害,预后较差。
探索VOD/SOS发生的预测指标有助于疾病的早期诊断,包括一些生化指标和临床症状。血清肌酐水平显著升高、移植前受者体内铁蛋白水平(>1000 μg/L)、急性肾功能不全、血小板输注无效、他克莫司的浓度升高是VOD/SOS重要的预测诊断指标[7]。胰岛素样生长因子-1(IGF-1)是一种血管保护因子和内皮活化抑制剂,移植前低水平的IGF-1可作为预测VOD/SOS的生物标志物[9]。国外的一项前瞻性研究发现移植后发生VOD/SOS与未发生的受者相比中位血浆游离氨基酸(PAA)水平明显较低[10]。关注以上指标的变化有利于实现VOD/SOS的早期诊断。
欧洲血液和骨髓移植学会(EBMT)最近更新的用于诊断VOD/SOS的标准如下[11]。成人:(1)经典型VOD/SOS,HSCT后21 d内发病,总胆红素大于等于34 μmol/L,且至少满足以下标准的2条:①肝肿大;②腹水;③体重增加超过基线值的5%。(2)晚发型VOD/SOS,HSCT术后21 d后发病并且有以下的潜在表现:①与经典型相同的特征;②可被组织学证实的特征;③经典型4条标准(总胆红素大于等于34 μmol/L,体重增加超过原有体重的5%,肝脏肿大,腹水)中的2个加上VOD/SOS的血流动力学或者超声学证据。儿童:诊断需要满足以下至少2个标准:①无法解释血小板输注无效的消耗性血小板减少症;②在使用利尿剂情况下,连续3 d出现不明原因的体重增加,或者体重增加超过基线值的5%;③连续3 d胆红素高于基线值,或者72 h内胆红素大于等于34 μmol/L;④肝肿大(最好由影像学证实)5.腹水(最好由影像学证实)。需要与不同来源的腹水(胰腺癌、乳糜性)、药物性肝损伤、胆管炎、脓毒症、病毒性肝炎、胆汁淤积和肝脏GVHD进行鉴别诊断。
儿童、青少年和青壮年中VOD/SOS的发病情况具有高度的差异性,专家针对这一人群推荐使用与年龄相适应的器官特异性损害作为严重程度分级的辅助标准:(1)肝活检、门静脉楔压和多普勒超声逆转门静脉血流不应用于儿童、青少年和青年成人的常规诊断;(2)肝肿大最好的定义是锁骨中线肝长度绝对增加至少1 cm,如果没有基线测量,肝肿大可以定义为比正常年龄的肝大小多2个标准差;(3)腹水的存在和体积可分为轻度(肝脏、脾脏或盆腔的微小液体)、中度(小于1 cm液体)或重度(3个区域均有液体,至少2个区域有>1 cm液体)[12]。无黄疸与有黄疸的VOD/SOS受者相比死亡率显著降低(12.5%和64.3%),并有更高的2年总体存活(OS)率(60.0%和14.3%)[13]。与之前常用的西雅图及巴尔的摩诊断标准相比,新修订的EBMT诊断标准将有助于早期识别未出现高胆红素血症的儿童受者,便于早期干预,防止疾病进展。
经颈静脉肝活检测量肝静脉压力梯度(HVPG)是诊断VOD/SOS的一项重要的方法,HVPG>10 mmHg对预测VOD/SOS具有良好的准确性和特异性[6]。这种有创的检查方法,出血风险较大,在临床中并不常用。肝脏硬度值(LSM)测量可有效替代HVPG诊断VOD/SOS,Zama等[14]对3例HSCT后发生严重VOD/SOS的受者进行评估,发现他们在确诊VOD/SOS前LSM急剧升高,治疗2周后LSM下降至正常。国内外学者致力于探索非侵入性的检查手段测量LSM,如瞬时弹性成像(TE)和美国横波弹性成像(SWE)。Colecchia等[15]通过TE对78例有异基因造血干细胞移植适应证的成年受者进行LSM的前瞻性研究,结果发现,4例发生VOD/SOS的受者在确诊前2~12 d LSM均升高,治疗后均逐渐降低。Reddivalla等[16]对SWE测量LSM的技术进行了一项前瞻性队列研究,结果发现,SWE可检测到的改变发生在VOD/SOS的其他影像学和临床表现之前。
利用超声成像技术的形态学参数如门静脉血流逆转、肝动脉收缩峰值流速增加、肝静脉单向、肝肿大、胆囊壁增厚和腹水等,可预测儿童VOD/SOS的进展。其中,胆囊壁增厚和腹水是VOD/SOS进展的独立预测因子[17]。Nishida等[18]基于US-17筛选出10项具有代表性的指标,提出了一个新的HokUS-10预测评分系统,敏感性100%,特异性95.8%(表1)。HokUS-10评分系统无疑为VOD/SOS的早期诊断提供有意义的参考,得分越高,则诊断可能性越高。
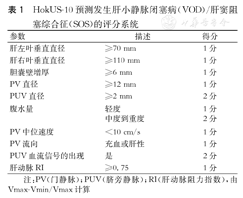
HokUS-10预测发生肝小静脉闭塞病(VOD)/肝窦阻塞综合征(SOS)的评分系统
HokUS-10预测发生肝小静脉闭塞病(VOD)/肝窦阻塞综合征(SOS)的评分系统
| 参数 | 描述 | 得分 |
|---|---|---|
| 肝左叶垂直直径 | ≥70 mm | 1分 |
| 肝右叶垂直直径 | ≥110 mm | 1分 |
| 胆囊壁增厚 | ≥6 mm | 1分 |
| PV直径 | ≥12 mm | 1分 |
| PUV直径 | ≥2 mm | 2分 |
| 腹水量 | 轻度 | 1分 |
| 中度到重度 | 2分 | |
| PV中位速度 | <10 cm/s | 1分 |
| PV流向 | 充血或肝性 | 1分 |
| PUV血流信号的出现 | 是 | 2分 |
| 肝动脉RI | ≥0.75 | 1分 |
注:PV(门静脉);PUV(脐旁静脉);RI(肝动脉阻力指数),由Vmax-Vmin/Vmax计算
根据VOD/SOS轻重程度不同,治疗也因人而异,对于中重度的VOD/SOS大多采取支持性疗法,并动态监测腹围、体重等,便于跟踪治疗反应和疾病进展。对症支持的常规操作包括胸腹腔穿刺术、氧疗、血液透析等。
去纤苷是由猪小肠黏膜DNA中提取的寡脱氧核糖核苷酸的复杂混合物,它可减少内皮细胞的激活,稳定内皮细胞,具有抗氧化、抗血栓形成、恢复血栓-纤溶平衡的作用[19,20]。推荐使用去纤苷的剂量为25 mg·kg-1·d-1,疗程至少为21 d。最近的研究表明,对异基因造血干细胞移植后VOD/SOS高发生风险受者预防性的使用去纤苷和熊去氧胆酸,大大降低了VOD/SOS的发生率,根据新的EBMT诊断标准,VOD/SOS的累积发生率可降至6.3%[21]。一项开放的、单中心T-IND研究扩大去纤苷的使用范围(包括儿童和成人)进一步评估其安全性,研究发现早期使用去纤苷可提高移植后100 d存活率[2]。这项大型前瞻性研究证实了去纤苷在多个VOD/SOS受者亚组的有效性,不少文献均证实了去纤苷改善HSCT后100 d的存活率和预后[19,22]。纤溶酶原激活剂抑制剂1(PAI-1)水平可反应VOD受者对去纤苷的治疗反应,反应较好者在治疗后PAI-1水平降低[23]。最常见的相关不良事件包括低血压、出血(主要是肺出血、胃肠道出血、鼻出血)和腹泻[22,24]。
重组人溶性血栓调节蛋白(rhTM)通过与凝血酶结合使凝集活动减弱,凝血酶-rhTM复合物可激活蛋白C产生活化蛋白C,当蛋白S存在时,活化蛋白C可裂解因子Ⅷa和Ⅴa并抑制凝血酶的进一步形成。最近的一项研究中,65例接受异基因HSCT后并发VOD/SOS的受者,24例接受去纤苷治疗,41例接受rhTM治疗。rhTM的推荐剂量为380 U·kg-1·d-1,根据2 d内是否接受治疗分为早期启动组和延迟启动组。结果表明,去纤苷组和rhTM组第100天的完全缓解率(CR)分别为50%和54%,100 d总存活率分别为50%和48%,早期启动组VOD/SOS的CR高于延迟启动组(去纤苷组为55%和25%,rhTM组为62%和42%)[25]。
ATⅢ是一种由肝脏产生的含丝氨酸蛋白酶抑制剂的糖蛋白,它与凝血酶结合形成复合物而使酶灭活。Kim等[26]对18例HSCT后出现VOD/SOS的儿童受者进行回顾性分析,ATⅢ的用法为第1天每8 h给药50 IU/kg,之后每24 h给药50 IU/kg,ATⅢ的疗程通常为2~10 d。研究结果表明单独使用ATⅢ的CR率为92%,轻度~中度或重度VOD/SOS受者单独使用ATⅢ替代治疗移植后100 d存活率分别为100%和80%。此项研究证明了ATⅢ的安全性,且可阻止疾病进展。
熊去氧胆酸(UDCA)是一种无毒性的亲水胆酸,具有细胞保护和抗氧化作用,可防止毒性胆酸分子如脱氧胆酸和鹅去氧胆酸对肝细胞的损害。最近国外的一项大鼠模型研究表明UDCA具有保护肝星状细胞,恢复CCl4诱导的肝纤维化的作用[27]。不少研究都证明了HSCT后预防性使用UDCA可降低VOD的发生率[28]。前列腺素E1具有诱导血管生成、扩张血管和抑制血小板凝集的作用。Rapoport等[29]研究了前列腺素E1(PGE-1)对大鼠肾脏微栓塞所致肾病模型组织病理学变化的影响,研究证实了PGE-1可预防血管、肾小球、肾小管和间质的改变,明显改善肾脏微栓塞大鼠的肾功能。一项对2 572例接受HSCT的研究表明预防性的使用熊二醇和静脉注射肝素或PGE1降低了HSCT后VOD的发生率,仅为3.4%[30],上述两种药物广泛用于VOD/SOS的治疗仍需深入探索其作用机制和进一步的临床试验验证疗效。另外,肝素以及低分子肝素也被用于治疗VOD/SOS,一些研究使用达肝素联合脂微球前列腺素E1(lipo-PGE1)作为VOD/SOS的预防方案[31],但其疗效需要进一步观察与研究,特别是在移植后血小板低下人群的风险值得评估。
在介入放射学领域,TIPS的应用可以显著改善HSCT术后非常严重的VOD/SOS的预后。一项研究对185例移植后使用环磷酰胺预防GVHD的受者进行回顾性分析,7例(41%)患有严重VOD/SOS的受者,药物治疗后出现难治性肝肾综合征,迅速恶化,开始接受TIPS治疗。治疗前,中位肝静脉压梯度为24 mmHg,TIPS治疗后降低至7 mmHg,TIPS后100 d总存活率为100%[32]。TIPS的长期并发症包括心力衰竭、肝功能损害、肝肾综合征和肺动脉高压[33]。对于进展快的重度VOD/SOS,TIPS可作为一种挽救治疗方法。
肝移植作为终末期肝病的一种治疗方法,用此法治疗VOD/SOS一直存在争议,因VOD/SOS而采用肝移植的治疗方法只有少数的报道,难以在大范围内评估其疗效。对于VOD/SOS引起的危及生命的肝衰竭,难治性腹水和肝肾综合征,可将TIPS作为桥梁,尽早进行肝移植[33]。国外报道1例对allo-HSCT后并发威胁生命的VOD/SOS的受者进行肝移植,并追踪其结局,发现移植后的肝功能良好,最终受者死于间质性肺炎[30]。肝移植对于重度VOD/SOS受者可能是一种行之有效的方法。
综上所述,多数轻、中度VOD/SOS受者的通过支持对症治疗可获得临床缓解,而延误诊治则可能发展为重症,重症受者死亡率高,治疗方法有限,需要药物、手术等多方面的综合策略。
所有作者均声明不存在利益冲突



























