
分析基于中国患者人群的透明细胞乳头状肾细胞癌(CCPRCC)流行病学、临床病理及预后特点。
纳入2016年6月至2020年6月期间在北京大学第一医院确诊的肾细胞癌患者,按照CCPRCC、透明细胞肾细胞癌(ccRCC)、乳头状肾细胞癌(pRCC)进行分组,回顾性比较分析三组患者的一般临床资料、术后病理资料及随访资料。
共纳入CCPRCC患者18例,占该时间段内本院术后病理确诊为肾细胞癌患者的0.44%(18/4 110),年龄(49.5±17.1)岁,男11例,女7例;所有的CCPRCC患者均无肾肿瘤家族史,其中只有1例CCPRCC患者具有相关的临床症状,为间断的腰腹部胀痛,而另外17例均是体检发现,无相关症状。与ccRCC及pRCC组相比,CCPRCC组患者在终末期肾病史上差异无统计学意义(χ2ccRCC=0.291,χ2pRCC=1.161,均P>0.05)。CCPRCC组肿瘤最大径小于pRCC组(χ2=-2.280,P =0.027),但与ccRCC组差异无统计学意义(χ2=-0.579,P =0.565);CCPRCC组患者基本上都处于pT1a期,病理分期明显早于另外两组,且其总生存也较ccRCC组和pRCC组更好(P<0.05)。
CCPRCC是具有独特的流行病学、临床病理及预后特点的一类肾细胞癌,患者较ccRCC和pRCC分期更早、预后更好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
肾细胞癌约占肾脏恶性肿瘤的90%,而透明细胞乳头状肾细胞癌(clear cell papillary renal cell carcinoma,CCPRCC)是2016版WHO泌尿和男性生殖系统肿瘤分类中新增的肾细胞癌亚型,在肾细胞癌亚型中排第四位,约占所有肾脏肿瘤手术患者的1%~4%[1, 2]。肾细胞癌整体预后虽较差,但有报道称CCPRCC是一种惰性的肿瘤,其细胞核特点多符合WHO/国际泌尿病理学会(ISUP)肾细胞癌分级系统的1/2级,目前还没有证据表明CCPRCC会出现肿瘤复发、转移或肿瘤相关的死亡[3]。CCPRCC在病理组织学上与透明细胞肾细胞癌(clear cell renal cell carcinoma,ccRCC)和乳头状肾细胞癌(papillary renal cell carcinoma,pRCC)有一定的相似性,给临床上的鉴别诊断带来了一定的挑战。CCPRCC是一种被新定义的肾细胞癌亚型,目前研究绝大部分都是基于西方患者人群的,仅有的几项国内研究均为小样本的个案报道,且缺乏与其他肾细胞癌亚型之间进行比较性分析。本研究按照CCPRCC、ccRCC、pRCC进行分组,比较性分析基于中国患者人群的CCPRCC流行病学、临床病理及预后特点,增加对这种新定义的肾细胞癌亚型的认识,以期帮助优化肾细胞癌患者的个体化诊疗策略。
回顾性队列研究。纳入2016年6月至2020年6月期间就诊于北京大学第一医院并确诊为CCPRCC的患者18例,纳入标准:(1)由至少2名有经验的泌尿病理科医师基于形态学和免疫组织化学依据而做出病理诊断;(2)依据2016版WHO泌尿和男性生殖系统肿瘤的相关诊断标准。排除标准:(1)术后随访时间少于12个月;(2)一般资料或临床病理资料不完整;(3)形态学和免疫组织化学确诊为CCPRCC证据不足。同时,本研究随机纳入本院同时期内确诊为ccRCC(n=30)和pRCC(n=30)的患者与CCPRCC进行比较性分析,所有纳入的ccRCC及pRCC患者均诊断明确且与CCPRCC没有相关性,并具有完整的临床病理及预后资料。
收集所有患者的以下资料:性别、年龄、吸烟史、饮酒史、身高、体重、肾癌家族史、临床症状、肿瘤最大径、肿瘤体侧(左/右侧)、术前估算的的肾小球滤过率(eGFR)、终末期肾病(ESRD)史、术式、病理T分期及WHO/ISUP分级等。患者的肿瘤最大径为病理医师测量的术后大体标本肿瘤病灶的最大径,若为行肾穿刺活检确诊而未行肿物切除术的患者,肿瘤的最大径依据为患者的增强CT结果;若局部病灶之间的 WHO/ISUP分级不一致,选取最高的级别。本研究通过北京大学第一医院伦理委员会审批(审批号:BMU2018JI002)。
采用IBM SPSS 22.0进行数据分析,对于定量数据的正态性,通过Kolmogorov-Smirnov检验进行评估。年龄、肿瘤最大径符合正态分布,以表示,两组间比较采用独立样本t检验;性别、吸烟史、饮酒史、肾癌家族史、ESRD史、术式、pT分期、分级等计数资料以频数和率(%)表示,组间比较采用χ²检验或Fisher精确检验。双侧检验,检验水准α=0.05。
1.一般情况:本研究最终纳入CCPRCC患者18例,ccRCC组和pRCC组分别30例,占该时间段内本院病理确诊为肾细胞癌患者的0.44%(18/4 110)。18例确诊的CCPRCC患者年龄为(49.5±17.1)岁,男11例,女7例。所有的CCPRCC患者均无肾肿瘤家族史,其中只有1例CCPRCC患者出现相关临床症状,为间断性的腰腹部胀痛,而另外17例患者均是体检发现,无相关临床症状。18例CCPRCC患者中右侧10例,左侧8例,无双侧病灶出现,但有1例患者出现一侧肾脏多个病灶(4处病灶),其中1处病灶为CCPRCC,而另3处病灶为ccRCC。所有患者均接受了患侧肾脏根治性(7/18)或部分切除术(11/18),其中2/18例为开放手术,16/18例为腹腔镜手术,所有患者均未发现区域/远处转移和复发。2/18例CCPRCC患者具有ESRD病史,与ccRCC组、pRCC组的差异无统计学意义(χ2ccRCC=0.291,χ2pRCC=1.161,P>0.05)。CCPRCC组吸烟及饮酒史与ccRCC组、pRCC组差异均无统计学意义(P>0.05)(表1)。
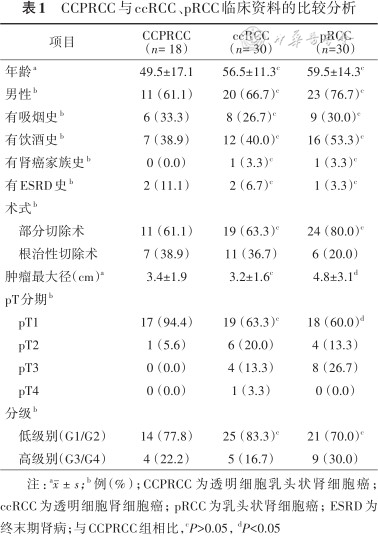
CCPRCC与ccRCC、pRCC临床资料的比较分析
CCPRCC与ccRCC、pRCC临床资料的比较分析
| 项目 | CCPRCC (n= 18) | ccRCC (n= 30) | pRCC (n=30) |
|---|---|---|---|
| 年龄a | 49.5±17.1 | 56.5±11.3c | 59.5±14.3c |
| 男性b | 11(61.1) | 20(66.7)c | 23(76.7)c |
| 有吸烟史b | 6(33.3) | 8(26.7)c | 9(30.0)c |
| 有饮酒史b | 7(38.9) | 12(40.0)c | 16(53.3)c |
| 有肾癌家族史b | 0(0.0) | 1(3.3)c | 1(3.3)c |
| 有ESRD史b | 2(11.1) | 2(6.7)c | 1(3.3)c |
| 术式b | |||
部分切除术 | 11(61.1) | 19(63.3)c | 24(80.0)c |
根治性切除术 | 7(38.9) | 11(36.7) | 6(20.0) |
| 肿瘤最大径(cm)a | 3.4±1.9 | 3.2±1.6c | 4.8±3.1d |
| pT分期b | |||
pT1 | 17(94.4) | 19(63.3)c | 18(60.0)d |
pT2 | 1(5.6) | 6(20.0) | 4(13.3) |
pT3 | 0(0.0) | 4(13.3) | 8(26.7) |
pT4 | 0(0.0) | 1(3.3) | 0(0.0) |
| 分级b | |||
低级别(G1/G2) | 14(77.8) | 25(83.3)c | 21(70.0)c |
高级别(G3/G4) | 4(22.2) | 5(16.7) | 9(30.0) |
注:a;b例(%);CCPRCC为透明细胞乳头状肾细胞癌;ccRCC为透明细胞肾细胞癌;pRCC为乳头状肾细胞癌;ESRD为终末期肾病;与CCPRCC组相比,cP>0.05,dP<0.05
2.临床病理和预后特点:18例CCPRCC患者共计21个肾肿瘤病灶(其中1例患者出现4个肾肿瘤病灶),ccRCC组与CCPRCC组肿瘤最大径差异无统计学意义[(3.2±1.6)比(3.4±1.9)cm,P =0.565],但pRCC组肿瘤最大径大于CCPRCC组[(4.8±3.1)比(3.4±1.9)cm,P =0.027]。17/18的CCPRCC组患者为pT1,仅1例为pT2;而ccRCC组和pRCC组中pT1的比例低于CCPRCC组(P<0.05),表明与ccRCC和pRCC组患者相比,CCPRCC组患者的病理T分期更早。14/18的CCPRCC组患者处在WHO/ISUP分级系统的G1/G2,与ccRCC(χ2=0.152,P =0.697)、pRCC(χ2 =1.318,P =0.251)差异无统计学意义。免疫组织化学的结果显示,CA9、CK7、Vimentin和AE1/AE3几乎在所有的CCPRCC组患者的肿瘤组织中均是阳性,而TFE3、CD117和HMB45则几乎在所有CCPRCC组患者的肿瘤组织中均是阴性(表2),其他分子在免疫组化中的表达及强弱尚未明确。
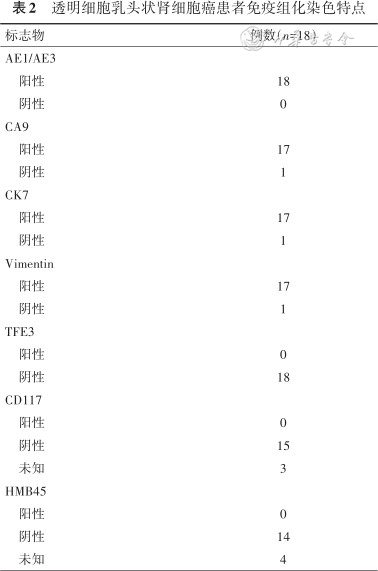
透明细胞乳头状肾细胞癌患者免疫组化染色特点
透明细胞乳头状肾细胞癌患者免疫组化染色特点
| 标志物 | 例数(n=18) |
|---|---|
| AE1/AE3 | |
阳性 | 18 |
阴性 | 0 |
| CA9 | |
阳性 | 17 |
阴性 | 1 |
| CK7 | |
阳性 | 17 |
阴性 | 1 |
| Vimentin | |
阳性 | 17 |
阴性 | 1 |
| TFE3 | |
阳性 | 0 |
阴性 | 18 |
| CD117 | |
阳性 | 0 |
阴性 | 15 |
未知 | 3 |
| HMB45 | |
阳性 | 0 |
阴性 | 14 |
未知 | 4 |
所有患者的中位随访时间为26.8(12.7,42.1)个月,CCPRCC组患者总生存率较ccRCC和pRCC更好(P =0.01),而ccRCC与pRCC患者的总生存相似(P =0.79)。(图1)
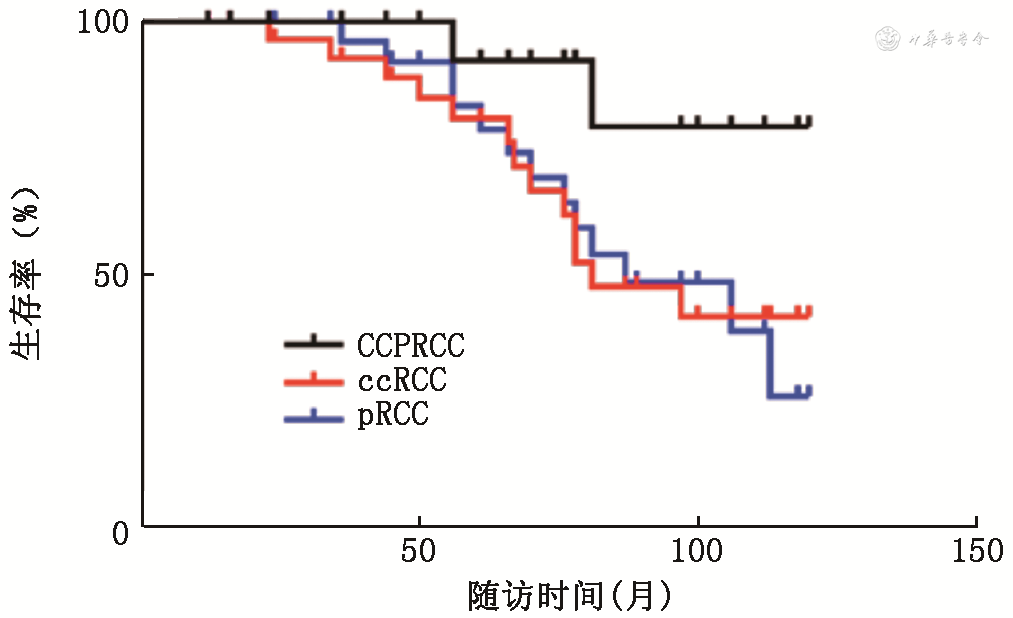

注:CCPRCC为透明细胞乳头状肾细胞癌;ccRCC为透明细胞肾细胞癌;pRCC为乳头状肾细胞癌
与病理特征较相似的肾细胞癌亚型ccRCC及pRCC相比,本研究结果表明CCPRCC患者具有一些临床病理特征,有利于进一步了解CCPRCC这种新定义的肾细胞癌亚型,在临床实践中将预后明显更好的CCPRCC鉴别开来,避免过度医疗,优化肾细胞癌患者的个体化管理。
CCPRCC最早在2006年由Tickoo等[4]报道,CCPRCC被认为是与ESRD紧密相关的疾病,但随着对CCPRCC的后续报道发现,大部分CCPRCC患者并没有合并ESRD。近年来,国外有关CCPRCC的相关研究逐渐增多,其独特的临床病理和预后特点使得其在2016版WHO泌尿和男性生殖系统肿瘤分类中被定义为一种新的肾细胞癌亚型。国内关于CCPRCC的报道较少,基本全为个案报道,长期未受到足够的重视。越来越多基于西方患者人群的研究发现CCPRCC的预后明显好于肾细胞癌的整体预后,在一项纳入了362例CCPRCC患者的文献综述中[3],平均38个月的随访时间未发现1例肿瘤复发、转移或是与肿瘤相关的死亡。基于中国患者人群的研究也证实了CCPRCC似乎是一种惰性的肿瘤,其病理T分期基本全部都是较早期的pT1a,明显较ccRCC和pRCC更早,虽然分级上无显著差异,但是在整体预后上更好。
目前临床上主要需要将CCPRCC与ccRCC及pRCC进行鉴别诊断,主要依赖于其病理学特点。大体标本上,CCPRCC病灶局部似有包膜,与周围组织分隔清楚,切面呈淡灰褐色,质地中等,一般无明显局部坏死出现。在组织学上,CCPRCC主要以乳头状、囊状、管状及巢状分布,可见分枝状乳头出现。高倍镜下可见大小较一致的呈立方形及多角形瘤细胞,胞浆丰富而透明,一般无核分裂像出现,具有特征性远离基膜并朝向管腔表面呈整齐排列的单层线状结构[5, 6]。在免疫组织化学上,有学者报道在CCPRCC患者中,CA-9、CK7和HMWCK的阳性率高达80%以上,而AMACR和CD-10阴性率较高[6]。然而免疫组织化学结果可能受各医疗中心所选抗体厂家及批号不一致、实验室环境及操作等因素的影响。最近有研究[7]发现GATA3可能是一种有价值的免疫组织化学标志物,用于鉴别CCPRCC,该研究发现GATA3在免疫组织化学中用于诊断CCPRCC的敏感度和特异度分别为76%和100%。
在分子遗传学上,CCPRCC同样具有许多有别于ccRCC和pRCC的特征。CCPRCC通常不具有3p染色体缺失和VHL基因突变,而这些是ccRCC的典型表现[3,8]。与pRCC不同的是,CCPRCC不具有7号、17号和Y染色体上的拷贝数变异。而某些体系突变,如MET、PTEN、ERBB4、STK11等可以在CCPRCC中发现[9, 10, 11]。最近的研究发现,CCPRCC肿瘤细胞的线粒体DNA耗竭较ccRCC和pRCC更为严重,提示CCPRCC肿瘤细胞可能存在独特的代谢途径。
综上所述,CCPRCC是新近被定义的肾细胞癌亚型,相关研究较少,国内的相关研究更少且多为个案报道。本研究通过将CCPRCC与ccRCC、pRCC进行比较性分析,结合国外相关报道发现CCPRCC无论在流行病学、临床病理特点、生存预后及分子遗传学上,均具有许多独特的特征。CCPRCC不同于ccRCC和pRCC而具有的较好预后,提示了临床上早期识别CCPRCC的重要性,这可能有助于优化肾细胞癌患者的个体化管理。
所有作者均声明不存在利益冲突



























