
A型胃炎又称自身免疫性胃炎(AIG),该病指胃黏膜萎缩局限于胃体、胃底而未累及胃窦部黏膜的一种特殊的萎缩性胃炎。AIG患者早期缺乏特异性临床表现,临床上很难被发现和识别,病程进展数年后患者才会出现由维生素B12缺乏引起的恶性贫血。该患者因"贫血、黄疸待查"入院,经病史采集、血液系统专科检查,以及胃镜、活体组织检查和病理检查等,诊断为A型胃炎、恶性贫血、继发溶血性贫血。经多学科协作讨论后,予输血,补充甲钴胺治疗。经治疗,患者黄疸症状消失,血红蛋白水平逐渐升高,出院6个月后血红蛋白水平恢复至正常参考值范围内,一般情况良好。本文通过分析该例患者的诊治经过,旨在为临床医师治疗AIG及其并发症提供参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
A型胃炎患者体内常存在抗胃壁细胞抗体(anti-parietal cell antibody,PCA)和抗内因子抗体(anti-intrinsic factor antibody,IFA),故又称自身免疫性胃炎(autoimmune gastritis, AIG)。A型胃炎患者常因乏力、胃肠道不适等症状就诊,而临床上因黄疸来就诊者罕见。该例患者因"乏力、巩膜黄染半月余"就诊于苏州大学第一附属医院血液内科门诊,血常规检查示血红蛋白为54 g/L,血清总胆红素为37.33 μmol/L,诊断为"贫血、黄疸待查",最终被收治于苏州大学第一附属医院消化内科。经多学科协作讨论和治疗,患者长期补充甲钴胺,血红蛋白水平逐渐上升至正常参考值范围内,出院后持续随访半年,患者血常规各项指标均恢复至正常参考值范围内,一般情况良好。
患者男,46岁,因"乏力、巩膜黄染半月余"于2020年7月24日前往苏州大学第一附属医院血液内科就诊,血常规检查示血红蛋白为54 g/L,血清总胆红素为37.33 μmol/L,诊断为"贫血、黄疸待查",7月27日收治入苏州大学第一附属医院消化内科。患者就诊前半个月无明显诱因出现乏力、精神欠佳,并出现巩膜黄染,尿液颜色加深,无皮肤瘙痒,无发热、畏寒,无恶心、呕吐,无腰、背部疼痛等,近半个月体重下降约5 kg。患者1年前因"结肠多发息肉"于外院行内镜下治疗,术后病理提示管状腺瘤伴低级别上皮内瘤变。患者无偏食史,无胆道疾病病史,无手术和外伤史,否认食物、药物过敏史,否认输血史,否认毒物接触史和特殊药物服用史。
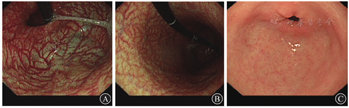
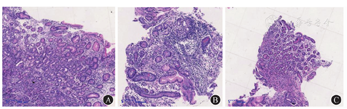
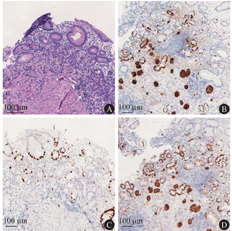
体格检查示体温为36.5 ℃,脉搏为80次/min,呼吸频率为18次/min,血压为112/80 mmHg(1 mmHg=0.133 kPa),体重指数为21.62 kg/m2。神志清楚、精神可,贫血貌,未见明显牛肉舌样改变,巩膜黄染;心律齐,未闻及异常杂音,双肺呼吸音清,未闻及干湿啰音;腹平软,全腹无明显压痛,无肌抵抗,墨菲征阴性,麦氏点无压痛,肝脾肋下未及,未触及包块,肝区无叩击痛,移动性浊音阴性,肠鸣音为4次/min;双肾区叩击痛阴性,脊柱呈生理性弯曲,四肢肌力无异常,双下肢无凹陷性水肿。实验室检查:血常规检查示白细胞计数为8.54×109/L,血红蛋白为48 g/L,血小板计数为65×109/L,红细胞计数为1.36×1012/L,红细胞平均体积为111.8 fL,红细胞平均血红蛋白浓度为302 g/L,红细胞压积为0.152,红细胞分布宽度为0.274,网织红细胞计数为0.086;生物化学检查示总胆红素为25.3 μmol/L,直接胆红素为9.2 μmol/L,间接胆红素为16.1 μmol/L,乳酸脱氢酶为2 306.8 U/L,α-羟丁酸脱氢酶为2 196.3 U/L,红细胞沉降率为17 mm/1 h,C反应蛋白为14.51 mg/L。血液内科检查如下。贫血组套:促红细胞生成素为72.65 U/L,维生素B12为19.95 pmol/L,叶酸为40.79 nmol/L,铁蛋白为650.98 g/L。溶血检查:结合珠蛋白为0.043 g/L,直接抗人球蛋白试验阴性,酸溶血试验阴性,葡萄糖-6-磷酸脱氢酶与6-磷酸葡萄糖酸脱氢酶比值为1.33(正常参考值为1.00~2.30)。红细胞渗透脆性试验:开始溶血时氯化钠溶液浓度为0.50%(正常参考值为0.42%~0.46%),完全溶血时氯化钠溶液浓度为0.32%(正常参考值为0.28%~0.32%)。凝血功能未见明显异常。外周血涂片检查示成熟红细胞大小不一,可见嗜多色、嗜碱性点彩红细胞、卡波环,破碎红细胞占比为0.04,血小板散在可见。阵发性睡眠性血红蛋白尿流式筛查未见明显异常。免疫和内分泌检查示抗核抗体阴性,甲状腺功能无异常。胃蛋白酶原Ⅰ为31.6 g/L,胃蛋白酶原Ⅱ为4.3 g/L,胃蛋白酶原Ⅰ与胃蛋白酶原Ⅱ的比值为7.3,胃泌素17为17.49 pmol/L,PCA和IFA均呈阳性。2020年7月28日胃镜检查结果显示,患者胃部为全层炎症,胃窦部炎症较轻,胃底和胃体部炎症较重;胃底黏膜红白相间(图1A);胃体黏膜红白相间,隐见血管纹理(图1B);胃窦大弯处可见散在发红、糜烂(图1C);提示A型胃炎。2020年8月7日胃底、胃体、胃窦大弯黏膜病理结果(图2)提示胃底大弯和胃体部黏膜重度慢性萎缩性炎伴肠化生,黏膜固有腺体减少,壁细胞减少,部分区域壁细胞消失,可见小灶肠化生和假幽门腺化生,神经内分泌细胞呈巢状分布,部分内分泌巢可见融合,灶性位于黏膜肌层,神经内分泌细胞巢最大径<500 m,内镜下不可见,未见黏膜下累及;胃窦部轻度慢性萎缩性炎。见图3,苏木精-伊红染色结果提示神经内分泌细胞呈巢状增生,免疫组织化学染色结果提示嗜铬素A和主要突触囊泡蛋白p38均阳性(+),Ki-67散在阳性(+);未见幽门螺杆菌。



A型胃炎;恶性贫血,继发溶血性贫血。
患者2020年7月24日直接抗人球蛋白试验呈阴性,基本排除自身免疫性溶血性贫血可能,考虑到患者存在持续慢性出血、血红蛋白水平低下(54 g/L)等红细胞输注指征,予红细胞成分输注支持治疗。患者A型胃炎诊断明确,予甲钴胺肌内注射(0.5 mg/次,2次/周),口服叶酸片(5 mg/次,3次/d)。2020年8月3日患者复查血常规,血红蛋白水平从54 g/ L升至81 g/L,总胆红素恢复至正常参考值范围内,乏力症状明显改善,遂于8月6日出院。出院后患者定期于门诊复查,截至2020年10月29日,患者复查血红蛋白为152 g/L,一般情况良好。
消化内科冯璜副主任医师:慢性萎缩性胃炎是慢性胃炎的类型之一,该病由多种病因引起,以胃黏膜上皮和泌酸腺萎缩为主要表现,伴或不伴幽门腺、肠腺化生和(或)异型增生,其临床表现无特异性[1]。1973年Srick和Mackay将慢性萎缩性胃炎根据病变部位分为A、B型:A型胃炎(根据悉尼系统和京都胃炎分类[2]进行诊断)指萎缩局限于胃体、胃底但不累及胃窦部黏膜的一种特殊的萎缩性胃炎;B型胃炎较为常见,以胃窦部黏膜萎缩为主要表现,多与幽门螺杆菌感染有关。目前普遍认为A型胃炎的发病机制主要与自身免疫抗体(PCA和IFA)有关,而这些自身抗体出现的原因尚不明确,考虑主要是宿主相关因素(基因易感性)与环境因素(内源性和外源性,外源性又称环境暴露)相互作用的复杂结果。A型胃炎的临床诊断主要依据胃镜下发现胃底、胃体黏膜为主的萎缩,病理活体组织检查,以及血清学标志物(PCA、IFA)检查等。A型胃炎患者通常无明显临床表现或仅有上腹胀等非特异性消化不良症状,起病隐匿;消化内镜医师对该病的认识不足也是早期诊断率低的原因之一。有研究报道,亚洲国家AIG的发病率低于欧美国家。近年来随着消化内镜技术的不断提高,国内报道AIG的数量有所增加,普通人群的AIG发病率约为2%[3,4]。AIG患者体内存在PCA,导致胃底腺内壁细胞被破坏,胃体腺萎缩,内镜下表现为"逆萎缩";壁细胞泌酸功能受影响,胃酸分泌减少,导致胃泌素反馈性升高。在此过程中,患者可能均无明显症状,但其体内的PCA和IFA会影响内因子分泌,从而影响小肠吸收维生素B12,最终引起恶性贫血。该例患者因"乏力、巩膜黄染半月余"就诊,主要表现为乏力、巩膜黄染、尿液颜色加深;血常规检查结果提示重度贫血;促红细胞生成素水平、网织红细胞计数均升高,提示患者造血功能无异常;患者无偏食史,营养摄入正常,无便血,亦无证据证明红细胞等经消化道丢失。患者胃蛋白酶原Ⅰ为31.6 g/L,低于正常参考值范围(70~165 g/L);胃泌素17为17.49 pmol/L,高于正常参考值范围(1.00~15.00 pmol/L);胃镜检查提示胃体、胃底黏膜萎缩,考虑A型胃炎继发恶性贫血可能。胃镜病理证实胃体重度萎缩性炎伴肠化生,伴有神经内分泌细胞异型增生;PCA和IFA均阳性,故诊断为A型胃炎伴恶性贫血。考虑患者存在维生素B12吸收障碍,口服维生素B12对该患者无效,故予甲钴胺肌内注射(0.5 mg/次,2次/周),治疗3个月后于2020年10月29日复查血红蛋白为152 g/L,考虑治疗有效。
血液科金松副主任医师:该患者患有大细胞性贫血合并血小板减少。大细胞性贫血包括巨幼红细胞贫血、骨髓增生异常综合征、部分溶血性贫血等。该患者经血清维生素B12检查后,首先考虑诊断为维生素B12缺乏导致的巨幼红细胞贫血,补充维生素B12后,血象快速回升,进一步确认了该诊断。维生素B12缺乏导致的DNA合成障碍不仅影响红系造血,也可影响粒系、巨核系造血,导致多系血细胞减少。巨幼红细胞贫血患者的细胞核与细胞浆发育不平衡(细胞浆较细胞核更成熟,即"核幼浆老"),易发生原位溶血,表现为乳酸脱氢酶升高、血清结合珠蛋白水平下降等。针对维生素B12缺乏导致的巨幼红细胞贫血,明确维生素B12缺乏的病因是关键。除常见的饮食摄入减少的原因外,还需要认真排查是否存在维生素B12吸收和利用障碍,必要时需借助消化专科的检查手段明确病因。
病理科杜明占副主任医师:AIG主要由自身免疫功能异常导致,由于患者自身免疫功能异常,PCA和(或)IFA破坏壁细胞,使胃黏膜壁细胞减少,胃酸分泌也随之减少,导致胃窦部G细胞增生伴胃泌素分泌增多,胃泌素刺激胃底、胃体部肠嗜铬样细胞(enterochromaffin-like cell,ECL)增殖,ECL分泌组胺进一步刺激壁细胞产生胃酸。壁细胞减少导致机体无法形成负反馈机制,G细胞和ECL持续增殖,进而可能形成神经内分泌肿瘤,尤其是 Ⅰ 型神经内分泌瘤常多发[5]。AIG诊断需结合多种临床检查,首先,胃镜下有"逆萎缩"表现,即胃底、胃体黏膜萎缩,胃窦和胃角的黏膜萎缩通常不明显;其次,以下2条中符合≥1项:①PCA和(或)IFA阳性;②ECL增殖或(和)内分泌细胞微巢增生。该患者以上条件均符合,胃镜下主要表现为全层炎症,胃窦部炎症较轻,胃底和胃体部炎症较重。萎缩性改变主要表现为胃体和胃底黏膜呈重度萎缩,黏膜固有腺体减少,壁细胞减少,部分区域壁细胞消失,可见小灶肠化生和假幽门腺化生,神经内分泌细胞呈巢状分布,部分内分泌巢可见融合,灶性位于黏膜肌层,由于神经内分泌细胞巢最大径<500 m,内镜下不可见,未见黏膜下累及,不足以诊断神经内分泌肿瘤,可诊断为神经内分泌细胞异型增生。胃窦部黏膜未见黏膜腺体萎缩性改变,炎症轻微。
内分泌科周颖异主治医师:自身免疫性甲状腺炎和Ⅰ型糖尿病患者的AIG发病率均高于健康人群。在关于自身免疫性甲状腺炎患者的研究中,该类患者的AIG发病率高达35%~40%,有16%的患者在疾病早期伴发恶性贫血[6]。甲状腺疾病患者维生素B12缺乏的患病率为6.3%~55.5%[7]。因此,自身免疫性甲状腺疾病和AIG患者都存在维生素B12水平降低。该患者因"贫血、黄疸待查"入院,并存在维生素B12缺乏,故在入院后完善甲状腺功能和血糖检查,结果无异常,可基本排除甲状腺疾病和糖尿病。
消化内科陈卫昌主任医师:近年来,随着京都胃炎共识在消化内镜医师中的普及,医师对于内镜下判断萎缩性胃炎(A型胃炎)和幽门螺杆菌感染的胃炎(B型胃炎)有了更深入的认知。以往A型胃炎被认为是一种非常少见的疾病,未受到足够重视,但其实是因其起病隐匿才被医师低估了发病率,其主要发病机制为患者自身免疫功能异常导致胃底腺萎缩,壁细胞被破坏,内因子分泌障碍,从而影响小肠吸收维生素B12,最终引起恶性贫血和一系列消化道症状。由于A型胃炎患者早期缺乏特异性临床表现,常在病程进展数年后才会出现因维生素B12缺乏引起的恶性贫血。该患者不仅出现了恶性贫血且伴发黄疸,临床罕见,经消化内科、血液内科、病理科和内分泌科医师多学科讨论和诊治确诊为"A型胃炎、恶性贫血、继发溶血性贫血"诊断,予甲钴胺肌内注射后好转。该患者的诊治经过体现了多学科协作诊疗的优势并提示医师要提高对AIG的认识。
萎缩性胃炎的诊断依赖于消化内镜和病理检查结果,其中A型胃炎的诊断还依赖于血清学抗体检查。A型胃炎患者因体内长期存在PCA和IFA,导致壁细胞被破坏,出现维生素B12吸收障碍,严重者会出现巨幼红细胞贫血。A型胃炎患者常因乏力、胃肠道不适等原因就诊,而因黄疸就诊者临床上少见。本例患者因"贫血、黄疸待查"收入苏州大学附属第一医院消化内科,经消化内科、血液内科、病理科、内分泌科医师多学科讨论诊治,确诊为"A型胃炎、恶性贫血、继发溶血性贫血",给予维生素B12替代治疗后病情好转。该患者的诊治经过对医师的提示如下:①消化内镜医师在胃镜检查中应提高对"逆萎缩"的认识,可通过胃窦、胃体、胃底的多点活体组织检查、与病理科医生充分沟通,以及结合胃血清学和抗体检查来明确诊断;②巨幼细胞贫血可能继发溶血性贫血,导致患者有溶血性黄疸的临床表现,在治疗原发病后血红蛋白水平即可恢复至正常参考值范围内;③多学科讨论的模式更有利于医师明确诊断,制订有利于患者的治疗方案。
所有作者均声明不存在利益冲突



























