
探讨基于CT影像征象联合影像组学模型鉴别新型冠状病毒肺炎(COVID-19)和其他病毒性肺炎的临床价值。
回顾性分析2015年3月至2020年3月云南省15家医院实时逆转录聚合酶链反应检测为病毒性肺炎并接受胸部CT扫描的181例患者的临床和影像资料。根据患者的病毒类型分为COVID-19组(89例)和非COVID-19组(92例);所有病例按7∶3的比例随机分层抽样分为训练集(126例)和测试集(55例)。从首诊平扫胸部CT图像中提取出肺炎征象和影像组学特征,分别建立独立预测模型和联合预测模型。通过受试者操作特征(ROC)曲线、连续净重新分类指数(NRI)校准曲线和决策曲线分析各种模型的诊断性能。
联合模型由3个重要的CT征象和14个筛选的影像组学特征构成。影像组学模型在训练集中鉴别诊断COVID-19组和非COVID-19组的ROC曲线下面积(AUC)为0.904,灵敏度为85.5%,特异度为84.4%,准确度为84.9%;在测试集中鉴别诊断COVID-19组和非COVID-19组的AUC为0.866,灵敏度为77.8%,特异度为78.6%,准确度为78.2%。联合模型在训练集中鉴别诊断COVID-19组和非COVID-19组的AUC为0.956,灵敏为91.9%,特异度为85.9%,准确度为88.9%;在测试集中鉴别诊断COVID-19组和非COVID-19组的AUC为0.943,灵敏度为88.9%,特异度为85.7%,准确度为87.3%。联合模型与影像组学模型鉴别诊断COVID-19组与非COVID-19组的AUC值在训练集中差异具有统计学意义(Z=-2.43,P=0.015),在测试集中差异无统计学意义(Z=-1.73,P=0.083),进一步采用连续NRI分析,结果显示训练集和测试集中联合模型较单独影像组学模型均具有正向改善能力(训练集:连续NRI为1.077,95%CI 0.783~1.370;测试集:连续NRI为1.421,95%CI 1.051~1.790)。校准曲线表明,训练集和测试集中,联合模型预测COVID-19的概率与观察值之间具有良好的一致性;决策曲线显示联合模型阈值概率0~0.75时,可获得大于0.6的净收益。
基于胸部CT影像征象联合影像组学模型鉴别诊断COVID-19和其他病毒性肺炎具有较好的临床价值。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前,新型冠状病毒肺炎(COVID-19)仍在全世界范围内蔓延。由于多数病毒性肺炎的发病高峰和临床症状极为相似,因此,对不同病毒性肺炎与COVID-19的鉴别诊断尤为重要[1, 2]。实时逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)是诊断病毒性肺炎的金标准,但对检测COVID-19的灵敏度较低[3];并且RT-PCR的高假阴性率也限制其在病毒性肺炎鉴别诊断中的应用。目前,CT在病毒性肺炎的临床诊断中发挥了重要作用,但关于COVID-19与其他病毒性肺炎间影像征象差异还鲜见报道[4, 5]。既往研究表明,影像组学在肿瘤诊断、疗效评价和预后中的应用较为广泛[6, 7, 8]。最近,有研究采用影像组学来预测COVID-19患者的不良预后[9, 10, 11]。因此,本研究旨在探讨基于胸部CT影像组学特征与征象在鉴别COVID-19和其他病毒性肺炎的临床价值。
本研究为回顾性研究,经昆明市第三人民医院伦理委员会批准(批号2020020701)和昆明医科大学第一附属医院备案。分析2015年3月至2020年3月云南省15家医院所有确诊的375例仅感染单种病毒的病毒性肺炎患者的临床及影像资料。纳入标准:(1)RT-PCR确诊为病毒性肺炎;(2)临床和影像资料完整;(3)患者入院后48 h内完成了胸部CT检查。排除标准:(1)首次影像检查非胸部CT;(2)图像层厚>2 mm;(3)图像伪影明显,无影像表现;(4)合并细菌、真菌或结核感染及明显慢性阻塞性肺疾病。共入组181例病毒性肺炎患者,男94例、女87例,年龄6~93(45±14)岁。根据RT-PCR确诊的病毒类型,将患者分为COVID-19组(89例)和非COVID-19组(92例,包括甲型流感病毒性肺炎42例、巨细胞病毒性肺炎20例、乙型流感病毒性肺炎18例、Epstein-Barr病毒性肺炎4例、疱疹病毒性肺炎3例、腺病毒性肺炎2例、水痘病毒性肺炎2例,麻疹病毒性肺炎1例)。
采用德国Siemens Somatom Definition AS、荷兰Philips Brilliance Ingenuity Core、美国GE Light Speed 16排或更多排探测器的CT扫描机。嘱患者仰卧,吸气后屏住呼吸开始扫描。扫描范围为胸廓入口到肋间角。扫描参数:探测器准直宽度64×0.6 mm或128×0.6 mm,管电压120 kV,自适应管电流,高分辨率算法重建,重建层厚1.0或1.5 mm,层间距1.5 mm。窗宽1 600 HU、窗位-600 HU。
由3名具有5~7年胸部影像诊断经验的高年资主治医师盲法评价患者入院后首次CT影像表现,当意见不一致时,由另1名主任医师独立阅片后确定。CT形态学评估包括病变位置(左肺上叶、左肺下叶、右肺上叶、右肺中叶和右肺下叶)和征象[磨玻璃密度(ground-glass opacities,GGO)、部分实变、实变(多发性实变、局灶性实变)、纤维条索、小叶间隔增厚、小叶内间质增厚、胸膜下线、“铺路石”征、“树芽”征、支气管壁增厚、支气管扩张、空气支气管征、晕征、反晕征、纵隔淋巴结肿大、胸膜增厚和胸腔积液][4, 5,12]。
1.肺部病变三维分割:使用Lung Kit软件(LK 2.2,GE Healthcare)进行肺炎病变分割。首先将所有CT图像体素大小重采样为1 mm ×1 mm ×1 mm,再将全肺自动分割为5个肺叶,然后自动识别和分割肺炎病变的三维感兴趣区,并由1名经验丰富的主治医师确认病灶的边缘,同时另外1名副主任医师进行核对。
2.影像组学特征提取、特征选择和建模:采用Lung Kit软件对获得三维分割图像提取了1 316个影像特征。主要提取以下特征:(1)32个一阶特征;(2)75个多维纹理特征;(3)1 209个变换的一阶和纹理特征。在进行特征筛选和建模前,将所纳入181例患者按7∶3的比例随机分层抽样分为训练集(126例)和测试集(55例)。训练集用于特征筛选、模型构建,测试集仅用于模型验证。特征筛选前,首先采用中值填充法对具有缺失值的特征进行填充,之后采用Z-Score方法进行数据标准化处理。在特征筛选过程中,首先采用相关性分析剔除与其余特征具有相关性系数大于0.6的冗余特征;接着采用独立样本t检验(针对符合正态分布的特征)或Mann-Whitney U检验(针对不符合正态分布的特征)筛选出在COVID-19组和非COVID-19组间差异具有统计学意义的特征(P<0.05);随后采用单因素logistic和基于10倍交叉验证的最小绝对收缩和选择算子确定最后用于建立logistic回归模型的特征。
采用SPSS 25.0和R 3.6.1统计学软件进行分析。计量资料采用Shapiro-Wilk行正态性检验,符合正态分布的计量资料以表示,2组间的比较采用独立样本t检验;计数资料以例数表示,2组间的比较采用χ²检验。采用单因素和多因素logistic回归来选择CT征象中的独立预测因子,并纳入CT征象模型。通过ROC曲线评估影像组学模型和联合诊断模型的鉴别诊断性能并计算曲线下面积(area under curve,AUC)及其95%CI、准确度、灵敏度及特异度。通过DeLong检验比较两两模型之间的AUC的统计学差异。采用连续净重新分类指数(continuous net reclassification index,NRI)分析联合模型较单独影像组学模型的改善能力,并绘制校准曲线和决策曲线,以评估模型的拟合度及临床价值。P<0.05为差异具有统计学意义。
训练集与测试集患者病毒性肺炎类型、年龄、性别构成差异均无统计学意义(P>0.05)(表1)。
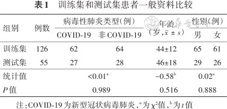
训练集和测试集患者一般资料比较
训练集和测试集患者一般资料比较
| 组别 | 例数 | 病毒性肺炎类型(例) | 年龄 (岁,) | 性别(例) | ||
|---|---|---|---|---|---|---|
| COVID-19 | 非COVID-19 | 男 | 女 | |||
| 训练集 | 126 | 62 | 64 | 44±12 | 65 | 61 |
| 测试集 | 55 | 27 | 28 | 46±18 | 29 | 26 |
| 统计值 | <0.01a | -0.58b | 0.02a | |||
| P值 | 0.989 | 0.516 | 0.888 | |||
注:COVID-19为新型冠状病毒肺炎,a为χ²值,b为t值
训练集中,单因素分析显示COVID-19组和非COVID-19组的GGO、部分实变、多发性实变、纤维条索、小叶内间质增厚、胸膜下线、“树芽”征、空气支气管征、晕征、纵隔淋巴结肿大、胸膜增厚和胸腔积液的分布差异均有统计学意义(P<0.05)(表2)。进一步通过单因素和向前多因素逐步logistic回归(表3),最终筛选出GGO(OR=25.795,95%CI 7.343~129.388,P<0.001)、小叶内间质增厚(OR=5.454,95%CI 2.017~16.596,P=0.001)和晕征(OR=3.309,95%CI 1.250~9.324,P=0.018)是COVID-19的独立预测因子。将此3个CT征象列入logistic回归模型,CT征象模型评分=-3.528+3.250×GGO+1.696×小叶内间质增厚+1.197×晕征。训练集和测试集中该模型的鉴别诊断COVID-19组和非COVID-19组效能差异无统计学意义(Z=0.98,P=0.327)(表4)。
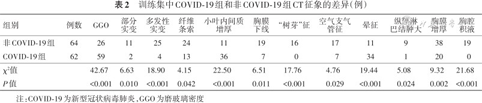
训练集中COVID-19组和非COVID-19组CT征象的差异(例)
训练集中COVID-19组和非COVID-19组CT征象的差异(例)
| 组别 | 例数 | GGO | 部分 实变 | 多发性 实变 | 纤维 条索 | 小叶内间质 增厚 | 胸膜 下线 | “树芽”征 | 空气支气 管征 | 晕征 | 纵隔淋 巴结肿大 | 胸膜 增厚 | 胸腔 积液 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 非COVID-19组 | 64 | 26 | 11 | 25 | 24 | 11 | 19 | 16 | 17 | 11 | 9 | 38 | 19 |
| COVID-19组 | 62 | 59 | 2 | 4 | 13 | 36 | 7 | 0 | 7 | 34 | 1 | 20 | 0 |
| χ²值 | 42.67 | 6.63 | 18.90 | 4.15 | 22.50 | 6.51 | 17.76 | 4.76 | 19.44 | 5.08 | 9.32 | 21.68 | |
| P值 | <0.001 | 0.010 | <0.001 | 0.042 | <0.001 | 0.011 | <0.001 | 0.029 | <0.001 | 0.024 | 0.002 | <0.001 |
注:COVID-19为新型冠状病毒肺炎,GGO为磨玻璃密度
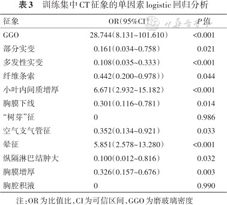
训练集中CT征象的单因素logistic回归分析
训练集中CT征象的单因素logistic回归分析
| 征象 | OR(95%CI) | P值 |
|---|---|---|
| GGO | 28.744(8.131~101.610) | <0.001 |
| 部分实变 | 0.161(0.034~0.758) | 0.021 |
| 多发性实变 | 0.108(0.035~0.333) | <0.001 |
| 纤维条索 | 0.442(0.200~0.978)) | 0.044 |
| 小叶内间质增厚 | 6.671(2.932~15.182) | <0.001 |
| 胸膜下线 | 0.301(0.116~0.781) | 0.014 |
| “树芽”征 | 0 | 0.986 |
| 空气支气管征 | 0.352(0.134~0.921) | 0.033 |
| 晕征 | 5.851(2.578~13.280) | <0.001 |
| 纵隔淋巴结肿大 | 0.100(0.012~0.816) | 0.032 |
| 胸膜增厚 | 0.326(0.157~0.676) | 0.003 |
| 胸腔积液 | 0 | 0.990 |
注:OR为比值比,CI为可信区间,GGO为磨玻璃密度
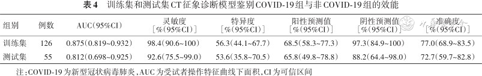
训练集和测试集CT征象诊断模型鉴别COVID-19组与非COVID-19组的效能
训练集和测试集CT征象诊断模型鉴别COVID-19组与非COVID-19组的效能
| 组别 | 例数 | AUC(95%CI) | 灵敏度 [%(95%CI)] | 特异度 [%(95%CI)] | 阳性预测值 [%(95%CI)] | 阴性预测值 [%(95%CI)] | 准确度 [%(95%CI)] |
|---|---|---|---|---|---|---|---|
| 训练集 | 126 | 0.875(0.819~0.932) | 98.4(90.6~100) | 56.3(44.1~67.7) | 68.5(58.3~77.3) | 97.3(84.9~100) | 77.0(68.9~83.5) |
| 测试集 | 55 | 0.812(0.698~0.925) | 92.6(75.5~99.0) | 53.6(35.8~70.5) | 65.8(49.8~78.8) | 88.2(64.4~98.0) | 72.7(59.7~82.8) |
注:COVID-19为新型冠状病毒肺炎,AUC为受试者操作特征曲线下面积,CI为可信区间
1 316个影像组学特征经过筛选后,14个影像组学特征在COVID-19与非COVID-19组间差异具有统计学意义(P<0.05)。由所选影像组学特征构建影像组学评分(Radscore)。
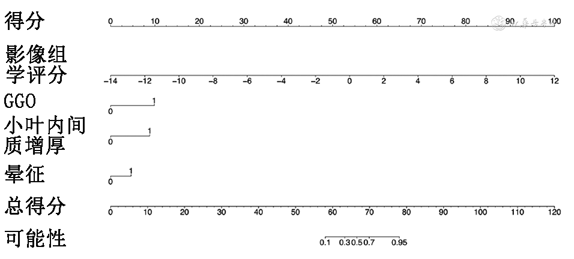
构建影像组学评分与CT征象联合模型,联合模型=3.273+0.987×Radscore+2.522×GGO+2.260×小叶内间质增厚+1.179×晕征。联合模型鉴别COVID-19组与非COVID-19组的列线图见图1。训练集和测试集中影像组学评分和联合模型鉴别COVID-19与非COVID-19的条形图见图2~5。

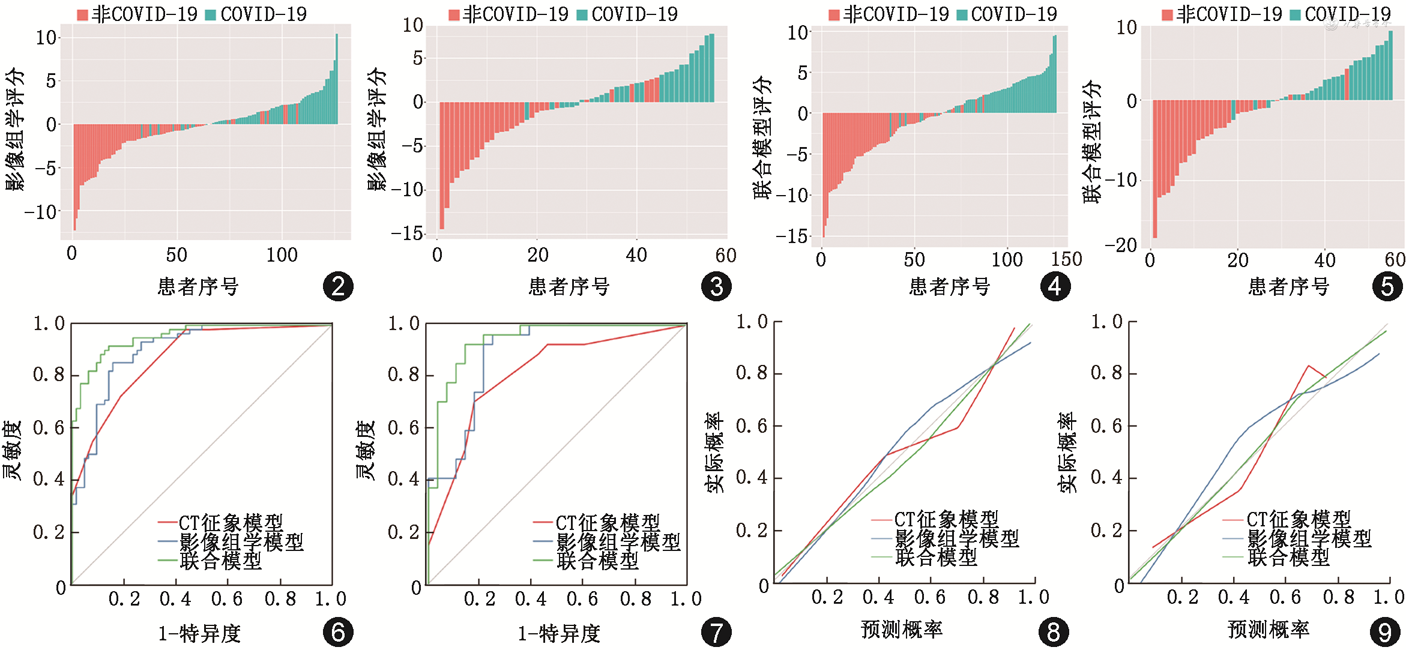

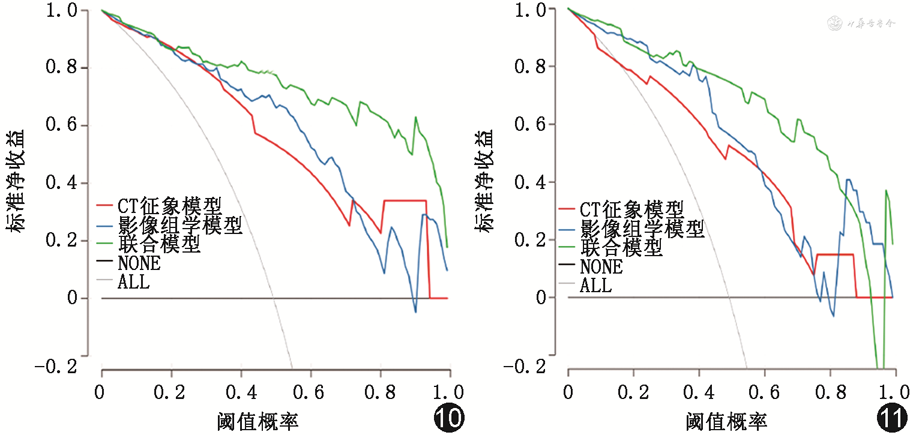
影像组学评分在训练集和测试集中鉴别诊断COVID-19组与非COVID-19组具有良好的效能(表5)。训练集和测试集中联合模型鉴别诊断COVID-19组与非COVID-19组的AUC值均高于CT征象模型(训练集:Z=-3.62,P<0.001;测试集:Z=-2.52,P=0.012)。联合模型与影像组学评分鉴别诊断COVID-19组与非COVID-19组的AUC在训练集中差异具有统计学意义(Z=-2.43,P=0.015),在测试集中差异无统计学意义(Z=-1.73,P=0.083)(图6,7)。进一步采用NRI分析,结果显示训练集和测试集中联合模型较单独影像组学评分均具有正向改善能力(训练集:连续NRI为1.077,95%CI 0.783~1.370;测试集:连续NRI 1.421,95%CI 1.051~1.790)。校准曲线表明,训练集和测试集中,联合模型预测COVID-19的概率与观察值之间具有良好的一致性(图8,9)。决策曲线显示联合模型阈值概率0~0.75时,可获得大于0.6的净收益(图10,11)。
影像组学评分和联合模型鉴别诊断COVID-19和非COVID-19病毒性肺炎的效能
影像组学评分和联合模型鉴别诊断COVID-19和非COVID-19病毒性肺炎的效能
| 组别 | AUC (95%CI) | 阈值 (分) | 灵敏度 [%(95%CI)] | 特异度 [%(95%CI)] | 阳性预测值 [%(95%CI)] | 阴性预测值 [%(95%CI)] | 准确度 [%(95%CI)] |
|---|---|---|---|---|---|---|---|
| 训练集(n=126) | |||||||
影像组学评分 | 0.904(0.853~0.956) | -0.088 | 85.5(74.4~92.4) | 84.4(73.4~91.5) | 84.1(73.0~91.3) | 85.7(74.8~92.5) | 84.9(77.6~90.2) |
联合模型 | 0.956(0.926~0.986) | -0.405 | 91.9(82.1~96.9) | 85.9(75.2~92.6) | 86.4(75.8~92.9) | 91.7(81.5~96.8) | 88.9(82.1~93.4) |
| 测试集(n=55) | |||||||
影像组学评分 | 0.886(0.798~0.975) | -0.088 | 77.8(58.9~89.7) | 78.6(60.1~90.1) | 77.8(58.9~89.7) | 78.6(60.1~90.1) | 78.2(65.5~87.2) |
联合模型 | 0.943(0.885~1.000) | -0.405 | 88.9(71.1~97.0) | 85.7(67.9~94.9) | 85.7(67.9~94.9) | 88.9(71.1~97.0) | 87.3(75.7~94.0) |
注:COVID-19为新型冠状病毒肺炎,AUC为受试者操作特征曲线下面积,CI为可信区间

鉴于病毒性肺炎临床症状的相似性,本研究系统地分析COVID-19和其他病毒性肺炎之间的CT征象和影像组学特征的差异。本研究结果显示3个CT征象和14个影像组学特征与COVID-19感染有关,基于CT征象和影像组学评分的联合诊断模型可以很好地将COVID-19与其他病毒性肺炎区分,并具有较为出色的预测效能。
本研究比较了COVID-19和其他病毒性肺炎的CT征象,结果显示GGO、小叶内间质增厚和晕征是COVID-19的独立预测因子,与既往研究一致[12, 13];将以上3种征象纳入logistic回归模型,认为该模型可以识别COVID-19和其他病毒性肺炎(训练集AUC为0.875;测试集AUC为0.812),与Bai等[14]研究结果一致(准确度60%~83%)。说明CT征象在鉴别不同类型病毒性肺炎方面具有临床价值。但由于特异度和精确度不足,使单纯通过视觉征象评估来区分COVID-19与其他病毒性肺炎仍具有挑战性。
影像组学是通过转换CT和MRI图像生成可挖掘的高通量数据的方法[15]。既往研究中,影像组学在肿瘤的诊断、分期、预后和治疗反应预测方面具有出色的表现[6, 7, 8]。此外,影像组学有助于了解肺炎病变的异质性[16, 17]。因此,影像组学理论上是鉴别COVID-19和其他病毒性肺炎的可行方法。本研究筛选了14个最具鉴别价值的影像组学特征,其中大多数是经过滤波变换的一阶或纹理特征,这也说明在空间域和频域中的高阶特征具有鉴别影像图像上不同肺炎高度重合特征的潜在能力。在临床癌症研究中,影像组学特征可反映肿瘤的浸润性、恶性程度、淋巴结转移潜能及其他生物学特性[18, 19, 20]。而COVID-19和其他病毒性肺炎之间影像组学的差异和肿瘤异质性可能有所不同,其内在影响因素尚未明确。
本研究基于胸部CT影像组学建立预测模型,测试集中模型预测COVID-19的AUC为0.886,灵敏度为77.8%,特异度为78.6%,准确度为78.2%,阳性预测值为77.8%,阴性预测值为78.6%,表明该模型诊断效能良好。为了进一步提高预测模型的效能,本研究将CT征象与影像组学评分联合建立预测模型,发现联合模型具有更优的鉴别诊断能力,且校准曲线和决策曲线表明联合模型的可靠性和稳定性较好。
本研究具有一定的局限性。首先,虽然本研究从多中心纳入病例,但是仍需在以后的更大研究中得到验证。其次,其他病毒性肺炎的纳入病例尚少,进一步比较不同类型病毒性肺炎的特征仍有待扩大样本分层研究。最后,肺部对病毒的反应与宿主因素高度相关,仅靠CT数据尚不能完全区分病毒性肺炎的类型,仍需要考虑更多有价值的临床特征和实验室检查数据。
综上所述,基于胸部CT影像组学特征构建的诊断模型能够鉴别COVID-19与其他病毒性肺炎,而在此基础上联合CT征象建立的联合诊断模型,具有更高的临床价值,为更精准的COVID-19临床诊断和治疗提供帮助。
云南省各COVID-19收治医院放射一线工作者在病例收集中提供的帮助
所有作者声明不存在利益冲突



























