
分析福建医科大学附属第一医院神经外科于2015年1月至2018年12月收治的49例弥漫性低级别胶质瘤相关癫痫患者的临床、病理特征及术后疗效,术后随访1年时,预后良好组33例(67.3%),预后不良组16例(32.7%),多因素logistic回归分析肿瘤次全切除(OR=5.56,95%CI:1.21~25.44,P=0.027)、术后未行放射治疗(OR=9.24,95%CI:2.05~41.75,P=0.004)是术后癫痫预后不良的相关因素。故而弥漫性低级别胶质瘤相关癫痫患者,全切除肿瘤及术后行放射治疗有利于癫痫的控制。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫性低级别胶质瘤(diffuse low-grade glioma,DLGG)被认为是癫痫患者中发生率最高的颅内肿瘤[1]。手术治疗是目前胶质瘤相关癫痫最有效的治疗方法,对于低级别胶质瘤相关癫痫患者,手术目标除了肿瘤减压、控制肿瘤复发、延长生存期外,控制癫痫发作、提高生存质量也显得尤为重要。低级别胶质瘤患者术后癫痫控制效果与诸多因素相关,2016年世界卫生组织对低级别胶质瘤的病理类型进行重新分类[2],不同分子表型表达的低级别胶质瘤生存预后存在明显差异,而按照新分类的病理类型与癫痫的关系也值得进一步探讨。
1. 对象:本研究为病例系列分析,回顾性分析福建医科大学附属第一医院神经外科2015年1月至2018年12月术后病理证实为弥漫性低级别胶质瘤的49例患者,病理诊断符合2016年WHO中枢神经系统肿瘤分类标准。纳入标准:(1)年龄≥18岁;(2)病理诊断根据2016年WHO中枢神经系统肿瘤分类标准诊断为弥漫性低级别胶质瘤;(3)术前癫痫发作≥1次(不论发作形式)即诊断为癫痫;(4)临床资料齐全。排除标准:(1)严重智力低下或智力障碍者;(2)肿瘤复发再次手术患者;(3)肿瘤组织活检及部分切除手术患者;(4)术前已做放射治疗或化学治疗患者;(5)术后生存<12个月的患者;(6)失访患者。
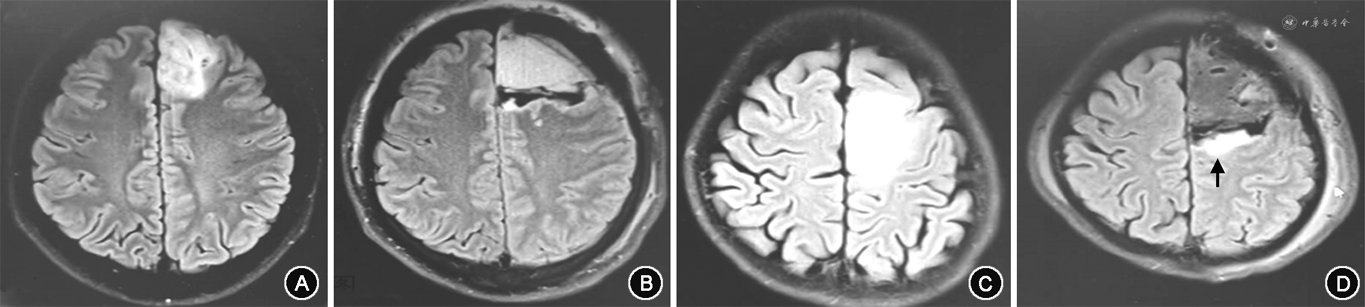
2. 方法:详细收集每例患者的一般资料、癫痫发作史、肿瘤部位、肿瘤侧别、肿瘤体积、瘤周水肿、分子病理类型、放化疗病史及肿瘤切除程度。切除程度根据术后72 h复查磁共振MRI Flair序列判定(图1):Flair影像上完全切除为肿瘤全切除,切除90%~99%为次全切除。术后癫痫疗效按照Engel分级进行分类,Engel Ⅰ级(完全没有癫痫发作)为癫痫预后良好组。EngelⅡ~Ⅳ级(偶尔癫痫发作,较术前明显好转,较术前无明显好转)为癫痫预后不良组。本研究符合《赫尔辛基宣言》对伦理的要求,知情同意豁免。

3. 术后管理:术后常规予丙戊酸钠缓释片0.5 g、1次/12 h或左乙拉西坦片 0.5 g、1次/12 h抗癫痫。弥漫性低级别胶质瘤高危组患者根据2018年中国胶质瘤诊疗规范[3],经多学科讨论后决定是否行放射治疗或者化学治疗。接受放射治疗的患者均行三维调强放射(intensity modulated radiotherapy,IMRT)治疗,放射治疗总剂量为45~54 Gy,单次剂量为1.8~2 Gy,共行25~28次放射治疗。放疗靶区:瘤床区域(gross tumor volume,GTV)根据术前、术后MRI所勾画,临床靶区(clinical target volume,CTV)定义为GTV外放1.5 cm,具体的靶区勾画根据解剖屏障调整。化疗方案均采用替莫唑胺胶囊(temozolomide,TMZ)辅助化学治疗,每28天为一周期,用药时间为连续5 d,每日1次,间隔23 d。第1周期150 mg·m-2·d-1×5 d,第2~6周期200 mg·m-2·d-1×5 d。
4. 统计学方法:本研究采用SPSS 23.0软件进行数据统计分析,呈正态分布的计量资料均以表示,两组间比较采用独立样本t检验;计数资料以例数(%)表示,2组间比较采用χ²检验或Fisher确切概率法。非正态分布的计量资料以M(Q1,Q3)表示,两组间比较采用秩和检验。采用单因素分析及多因素logistic回归分析筛选弥漫性低级别胶质瘤术后癫痫相关因素:对比两组间的临床资料,将P<0.10的因素纳入到多因素logistic回归分析中。以癫痫预后为因变量(0=预后良好,1=预后不良),以影响因素为自变量,以Engel Ⅰ级作为参照,分析影响弥漫性低级别胶质瘤术后癫痫的相关因素。双侧检验,检验水准α=0.05。
49例患者中获得Engel Ⅰ级共33例(67.3%),获得EngelⅡ~Ⅳ级共16例(32.7%)。肿瘤全切除26例,获得Engel Ⅰ级21例(80.8%)。肿瘤次全切除23例,获得Engel Ⅰ级12例(52.1%)。术后行放射治疗30例,获得EngelⅠ级25例(83.3%)。术后未行放射治疗19例,获得Engel Ⅰ级8例(42.1%)。统计结果显示两组间年龄、性别、癫痫病程、癫痫发作形式、癫痫发作频率、肿瘤部位、肿瘤体积、肿瘤周围是否水肿、病理类型、分子生物标志物差异均无统计学意义(均P>0.05)。肿瘤次全切除(P=0.033)、未接受放射治疗(P=0.003)是弥漫性低级别胶质瘤术后癫痫控制不佳的相关因素(表1)。Logistic多因素回归分析显示肿瘤次全切除(OR =5.56,95%CI:1.21~25.44,P=0.027)、术后未行放射治疗(OR =9.23,95%CI:2.04~41.74,P=0.004)是术后癫痫控制不佳的相关因素(表2)。
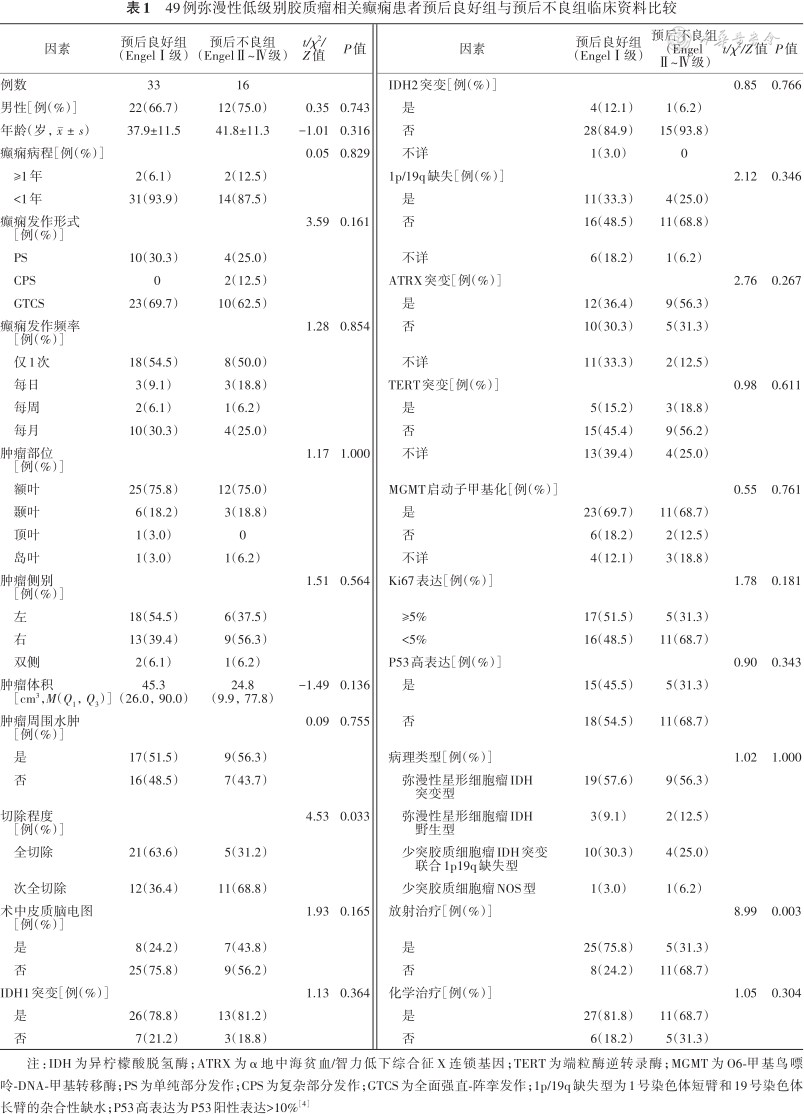
49例弥漫性低级别胶质瘤相关癫痫患者预后良好组与预后不良组临床资料比较
49例弥漫性低级别胶质瘤相关癫痫患者预后良好组与预后不良组临床资料比较
| 因素 | 预后良好组 (EngelⅠ级) | 预后不良组 (EngelⅡ~Ⅳ级) | t/χ2/ Z值 | P值 | 因素 | 预后良好组 (EngelⅠ级) | 预后不良组 (Engel Ⅱ~Ⅳ级) | t/χ2/Z值 | P值 |
|---|---|---|---|---|---|---|---|---|---|
| 例数 | 33 | 16 | IDH2突变[例(%)] | 0.85 | 0.766 | ||||
| 男性[例(%)] | 22(66.7) | 12(75.0) | 0.35 | 0.743 | 是 | 4(12.1) | 1(6.2) | ||
| 年龄(岁,) | 37.9±11.5 | 41.8±11.3 | -1.01 | 0.316 | 否 | 28(84.9) | 15(93.8) | ||
| 癫痫病程[例(%)] | 0.05 | 0.829 | 不详 | 1(3.0) | 0 | ||||
≥1年 | 2(6.1) | 2(12.5) | 1p/19q缺失[例(%)] | 2.12 | 0.346 | ||||
<1年 | 31(93.9) | 14(87.5) | 是 | 11(33.3) | 4(25.0) | ||||
癫痫发作形式 [例(%)] | 3.59 | 0.161 | 否 | 16(48.5) | 11(68.8) | ||||
PS | 10(30.3) | 4(25.0) | 不详 | 6(18.2) | 1(6.2) | ||||
CPS | 0 | 2(12.5) | ATRX突变[例(%)] | 2.76 | 0.267 | ||||
GTCS | 23(69.7) | 10(62.5) | 是 | 12(36.4) | 9(56.3) | ||||
癫痫发作频率 [例(%)] | 1.28 | 0.854 | 否 | 10(30.3) | 5(31.3) | ||||
仅1次 | 18(54.5) | 8(50.0) | 不详 | 11(33.3) | 2(12.5) | ||||
每日 | 3(9.1) | 3(18.8) | TERT突变[例(%)] | 0.98 | 0.611 | ||||
每周 | 2(6.1) | 1(6.2) | 是 | 5(15.2) | 3(18.8) | ||||
每月 | 10(30.3) | 4(25.0) | 否 | 15(45.4) | 9(56.2) | ||||
肿瘤部位 [例(%)] | 1.17 | 1.000 | 不详 | 13(39.4) | 4(25.0) | ||||
额叶 | 25(75.8) | 12(75.0) | MGMT启动子甲基化[例(%)] | 0.55 | 0.761 | ||||
颞叶 | 6(18.2) | 3(18.8) | 是 | 23(69.7) | 11(68.7) | ||||
顶叶 | 1(3.0) | 0 | 否 | 6(18.2) | 2(12.5) | ||||
岛叶 | 1(3.0) | 1(6.2) | 不详 | 4(12.1) | 3(18.8) | ||||
肿瘤侧别 [例(%)] | 1.51 | 0.564 | Ki67表达[例(%)] | 1.78 | 0.181 | ||||
左 | 18(54.5) | 6(37.5) | ≥5% | 17(51.5) | 5(31.3) | ||||
右 | 13(39.4) | 9(56.3) | <5% | 16(48.5) | 11(68.7) | ||||
| 双侧 | 2(6.1) | 1(6.2) | P53高表达[例(%)] | 0.90 | 0.343 | ||||
肿瘤体积 [cm³,M(Q1,Q3)] | 45.3 (26.0,90.0) | 24.8 (9.9,77.8) | -1.49 | 0.136 | 是 | 15(45.5) | 5(31.3) | ||
肿瘤周围水肿 [例(%)] | 0.09 | 0.755 | 否 | 18(54.5) | 11(68.7) | ||||
是 | 17(51.5) | 9(56.3) | 病理类型[例(%)] | 1.02 | 1.000 | ||||
否 | 16(48.5) | 7(43.7) | 弥漫性星形细胞瘤IDH 突变型 | 19(57.6) | 9(56.3) | ||||
切除程度 [例(%)] | 4.53 | 0.033 | 弥漫性星形细胞瘤IDH 野生型 | 3(9.1) | 2(12.5) | ||||
全切除 | 21(63.6) | 5(31.2) | 少突胶质细胞瘤IDH突变 联合1p19q缺失型 | 10(30.3) | 4(25.0) | ||||
次全切除 | 12(36.4) | 11(68.8) | 少突胶质细胞瘤NOS型 | 1(3.0) | 1(6.2) | ||||
术中皮质脑电图 [例(%)] | 1.93 | 0.165 | 放射治疗[例(%)] | 8.99 | 0.003 | ||||
| 是 | 8(24.2) | 7(43.8) | 是 | 25(75.8) | 5(31.3) | ||||
否 | 25(75.8) | 9(56.2) | 否 | 8(24.2) | 11(68.7) | ||||
| IDH1突变[例(%)] | 1.13 | 0.364 | 化学治疗[例(%)] | 1.05 | 0.304 | ||||
是 | 26(78.8) | 13(81.2) | 是 | 27(81.8) | 11(68.7) | ||||
否 | 7(21.2) | 3(18.8) | 否 | 6(18.2) | 5(31.3) |
注:IDH为异柠檬酸脱氢酶;ATRX为α地中海贫血/智力低下综合征X连锁基因;TERT为端粒酶逆转录酶;MGMT为O6-甲基鸟嘌呤-DNA-甲基转移酶;PS为单纯部分发作;CPS为复杂部分发作;GTCS为全面强直-阵挛发作;1p/19q缺失型为1号染色体短臂和19号染色体长臂的杂合性缺水;P53高表达为P53阳性表达>10%[4]
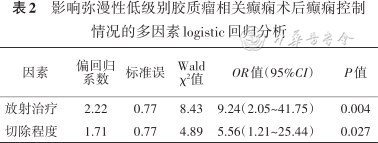
影响弥漫性低级别胶质瘤相关癫痫术后癫痫控制情况的多因素logistic回归分析
影响弥漫性低级别胶质瘤相关癫痫术后癫痫控制情况的多因素logistic回归分析
| 因素 | 偏回归 系数 | 标准误 | Wald χ²值 | OR值(95%CI) | P值 |
|---|---|---|---|---|---|
| 放射治疗 | 2.22 | 0.77 | 8.43 | 9.24(2.05~41.75) | 0.004 |
| 切除程度 | 1.71 | 0.77 | 4.89 | 5.56(1.21~25.44) | 0.027 |
WHOⅡ低级别胶质瘤癫痫发生率为65%~85%[5],癫痫发作严重影响患者认知功能和生活质量[6]。手术后64%~82%的低级别胶质瘤患者术后癫痫能得到完全控制[7]。手术切除是治疗低级别胶质瘤相关癫痫最有效的方法,术后癫痫控制率随着切除程度提高而增加,Still等[8]对346例成人幕上弥漫性低级别胶质瘤合并癫痫患者肿瘤切除程度与术后癫痫预后的关系进行分析,术后随访结果获得EngelⅠ级的比率分别是:肿瘤100%切除时为76.6%、切除程度为90%~99%时为77.3%、切除程度为50%~89%时为60.6%。本组资料49例术前合并癫痫,术后随访1年时,肿瘤全切除26例,获得Engel Ⅰ级21例(80.7%),肿瘤次全切除23例,获得Engel Ⅰ级12例(52.1%),肿瘤次全切除是影响弥漫性低级别胶质瘤患者术后癫痫控制不佳的相关因素(OR=5.56,95%CI:1.21~25.44,P=0.027)。国外学者Pallud等[9]研究结果显示,998例弥漫性低级别胶质瘤患者术后6个月时获得EngelⅠ级占62.4%,肿瘤全切除与术后癫痫控制密切相关。即使肿瘤全切除却仍有部分患者癫痫得不到完全控制,考虑其原因:其一可能肿瘤浸润范围大于影像学所见,瘤周仍存在致痫灶,据研究报道低级别胶质瘤皮质脑电图监测显示放电往往在肿瘤周围[10],致痫灶得不到完全切除可能会影响术后癫痫疗效;其二开颅手术不可避免有术后癫痫的风险,据报道开颅手术1年后癫痫发生率为9.7%[11],原因可能与手术后瘢痕形成、肿瘤进展相关。
术后放射治疗也可以减少胶质瘤相关癫痫的发作[12]。一项43例弥漫性低级别胶质瘤相关癫痫患者术后接受放射治疗对癫痫控制的研究报道[13],随访12个月时,75%的患者术后癫痫发作减少>50%,35%的患者无癫痫发作。欧洲一项临床试验研究结果显示早期放疗不但增加弥漫性低级别胶质瘤患者的无进展生存期,还可以提高术后癫痫控制率[14],本组资料49例弥漫性低级别胶质瘤患者,术后早期行放射治疗30例,获得EngelⅠ级25例(83.3%),术后未行放射治疗19例,获得EngelⅠ级8例(42.1%)。术后未行放射治疗(OR=9.239,95%CI:2.045~41.746,P=0.004)是术后癫痫控制不佳的相关因素。弥漫性低级别胶质瘤相关癫痫放电往往来自肿瘤周围皮质,而放射治疗的临床靶区覆盖范围远比瘤床本身广泛,放疗减少癫痫发作的机制可能通过破坏致痫神经元及改变肿瘤周边微环境来实现[13],但其具体机制还值得继续探索。
本研究结果得出病理类型、分子生物标志物与术后癫痫预后无统计学意义,2021版中枢神经系统肿瘤分类将成人弥漫性胶质瘤分为:星型细胞瘤,异柠檬酸脱氢酶(IDH)突变型;少突胶质细胞瘤,IDH突变伴1P/19q联合缺失,胶质母细胞瘤,IDH野生型,本研究纳入星型细胞瘤,IDH突变型28例;少突胶质细胞瘤,IDH突变伴1P/19q联合缺失14例;少突胶质细胞瘤NOS型2例,基本符合2021年新版中枢神经系统分类诊断[15],分类诊断总体上不会影响统计结果,但新的分子病理分型与癫痫预后的关系仍值得进一步研究。
本文为回顾性、小样本研究,在年龄、部位、病理类型、肿瘤全切时未能进一步分层分析放射治疗的作用。仍有待大样本、多中心、前瞻性研究进一步阐明弥漫性低级别胶质瘤相关癫痫的影响因素。
综上所述,肿瘤次全切除、手术后未行放射治疗与术后癫痫控制不佳相关。对于弥漫性低级别胶质瘤相关癫痫患者,全切除肿瘤及术后行放射治疗有利于癫痫的控制。
所有作者均声明不存在利益冲突



























