
近年来中国肺移植技术发展迅速,感染仍是肺移植术后主要的死亡原因之一,其中包括侵袭性真菌病。肺移植受者侵袭性真菌病发病率高,是影响术后生存的主要因素之一。真菌还可通过免疫途径诱发排斥反应,导致急、慢性移植物功能丧失。为规范肺移植受者侵袭性真菌病的诊治,中华医学会器官移植学分会肺移植学组根据国际指南与共识及中国《器官移植受者侵袭性真菌病临床诊疗规范(2019年版)》[1,2,3,4,5,6],结合近期国内、外临床证据,针对肺移植受者侵袭性真菌病在流行病学、诊断、预防、治疗方面的特殊性制定本规范,以期为中国肺移植临床医师提供参考。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
近年来中国肺移植技术发展迅速,感染仍是肺移植术后主要的死亡原因之一,其中包括侵袭性真菌病。肺移植受者侵袭性真菌病发病率高,是影响术后生存的主要因素之一。真菌还可通过免疫途径诱发排斥反应,导致急、慢性移植物功能丧失。为规范肺移植受者侵袭性真菌病的诊治,中华医学会器官移植学分会肺移植学组根据国际指南与共识及中国《器官移植受者侵袭性真菌病临床诊疗规范(2019年版)》[1,2,3,4,5,6],结合近期国内、外临床证据,针对肺移植受者侵袭性真菌病在流行病学、诊断、预防、治疗方面的特殊性制定本规范,以期为中国肺移植临床医师提供参考。
本指南按照"推荐分级的评估、制定与评价(GRADE)"系统对证据等级和推荐意见强度进行分级。高:以"A"表示,表明未来研究几乎不可能改变现有疗效评价结果的可信度。中:以"B"表示,表明未来研究可能对现有疗效评估有重要影响,可能改变评价结果的可信度。低:以"C"表示,表明未来研究很有可能对现有疗效评估有重要影响,改变评价结果可信度的可能性较大。极低:以"D"表示,表明任何疗效的评估都很不确定。
肺移植侵袭性真菌病的最主要病原菌是曲霉(包括:烟曲霉、黄曲霉和土曲霉等),其次假丝酵母菌、耶氏肺孢子菌、接合菌、隐球菌、地方性真菌等,少见真菌如赛多孢子菌。
肺移植侵袭性真菌病的危害,可表现为气道吻合口侵袭性真菌病、溃疡性气管支气管炎、侵袭性肺实质性疾病、播散性多器官疾病和/或真菌血症等,可直接和/或间接影响移植物功能,增加受者死亡率,报道1年死亡率22%~80%。
定植指培养分离到真菌而不存在侵袭性真菌病临床表现,是肺移植侵袭性真菌病的危险因素之一,也可能影响移植物功能。国外囊性纤维化(CF)受者真菌定植率较高(42%~76%),而非囊性纤维化受者的真菌定植率较低(21%~40%)[7]。中国人支气管扩张合并感染与囊性纤维化非常相似。曲霉是肺移植受者最常见定植菌,又以烟曲霉最常见(59%),其次黄曲霉(35%)[8]。肺移植后第1年内曲霉定植率30%左右[9],定植可进展为侵袭性曲霉病。大多数毛霉病也可能存在定植状态。耶氏肺孢子菌也是呼吸道常见定植菌,实体器官移植中定植率达25%以上[10]。
由于免疫方案、预防策略、气候环境等因素差异,肺移植侵袭性真菌病发生率在各中心不尽相同。肺移植后侵袭性曲霉病发生率为4%~23%,其中侵袭性肺曲霉病(IPA)最常见,发生率达80%[11,12]。假丝酵母菌(念珠菌)是肺移植侵袭性真菌病的第二位病原体,常发生于术后1个月内,1年内死亡率达34% [13]。耶氏肺孢子菌在肺移植受者感染率为10%~40%[14],通常引发肺孢子菌肺炎(PJP),发病率为2.7%,28 d和90 d的死亡率分别为15%和23%[15]。肺移植隐球菌病发病率低于前三者[16]。毛霉病在肺移植受者少见,但近年来升高趋势,术后第1年发病率约1%~2%[17]。
术后长期大剂量免疫抑制;肺通过气道与外界相通,直接暴露于空气中真菌孢子;供肺真菌孢子可能是受者侵袭性真菌病来源之一;手术破坏气道黏膜屏障,气道黏膜及吻合口水肿造成局部防御能力下降;疼痛以及神经受损等导致受者咳嗽、咳痰能力下降,痰液引流不畅,痰液是真菌良好的培养基;手术损伤相应神经组织,使气道纤毛运动障碍及对病原体清除能力下降。
曲霉定植史;鼻窦等肺外曲霉;自体肺切除后发现曲霉;单肺移植;巨细胞病毒感染,包括既往或新发感染;气道吻合口病变(包括吻合口狭窄、缺血、软化、愈合不良、坏死、瘘形成等)。
广谱抗生素使用;留置中心静脉导管、血液透析管。
免疫抑制剂的强化使用;长期血糖控制不佳;接受血液透析;长期预防性使用伏立康唑等[17]。
糖皮质激素的长期使用(相当于泼尼松30 mg/d,连续12周以上);多/单克隆抗体使用,尤其是前者;钙调磷酸酶抑制剂使用(他克莫司诱发肺孢子菌肺炎风险高于环孢素A);巨细胞病毒(CMV)感染(CMV感染是肺孢子菌肺炎发生的独立危险因素,常见二者合并感染);排斥反应(急/慢性排斥反应的发作和治疗次数与肺孢子菌肺炎直接相关);淋巴细胞分类及计数(CD4+T淋巴细胞计数<200个/μl和淋巴细胞计数<0.5×106 /ml是肺孢子菌肺炎发生的独立危险因素)。
我国目前没有肺移植受者侵袭性真菌病大规模循证医学证据,诊断标准参照欧洲癌症研究和治疗组织侵袭性真菌感染协作组/美国国立变态反应和感染病研究院真菌病研究(EORTC/MSG)联合发布的侵袭性真菌病修订定义[18],并参考我国2019版规范所推荐的诊断标准[6],沿用分层诊断体系:根据获得的依据可以分为未确定、拟诊、临床诊断、确诊四个不同级别的诊断。由于肺移植受者的特殊性,侵袭性真菌病具体分层诊断依据如下。
肺移植术后;近期中性粒细胞减少或缺乏、并持续10 d以上;应用糖皮质激素持续超过3周(0.3 mg·kg-1·d-1)以上;过去的90 d内应用过抗T淋巴细胞制剂如抗淋巴细胞免疫球蛋白、抗胸腺细胞免疫球蛋白等;既往有过侵袭性真菌病病史或有真菌定植史;受者原发病为囊性纤维化或支气管扩张合并感染者;存在侵袭性真菌病的其他高危因素例如糖尿病、长期广谱抗生素的应用等。
(1)主要特征:存在相应部位感染所对应的影像学改变证据
肺部侵袭性真菌病:CT检查至少存在以下三项之一;致密、边界清楚的病变,伴或不伴晕症;空气新月征;空洞。
是否出现上述典型影像学特征,取决于基础疾病的种类、病程所处的阶段、机体的免疫状态等。肺移植侵袭性肺曲霉病最常见,且气道侵袭常见。肺移植受者肺部侵袭性真菌病的影像学表现,靠近胸膜的肺结节、实变和/或磨玻璃样变较常见。
气道侵袭性真菌病:纤维支气管镜下直接表现为气管和支气管黏膜充血、水肿、伪膜、溃疡、坏死、肉芽等。
鼻窦侵袭性真菌病:至少符合以下一项;局部出现急性疼痛(包括放射至眼部的疼痛);鼻部溃疡伴黑痂;从鼻窦侵蚀骨质,包括扩散至颅内。
中枢神经系统侵袭性真菌病:符合以下至少一项;影像检查提示局灶性病变;MRI或CT检查提示脑膜强化。
播散性假丝酵母菌病:此前2周内出现假丝酵母菌血症,并伴有以下至少一项(肝或脾牛眼征);眼科检查提示进展性视网膜渗出。
肺孢子菌肺炎:胸部CT符合以下至少一项;弥漫性间质性病变(表现为磨玻璃影型,多位于肺门周围的中心肺区,可表现为蝴蝶征);多发斑片影,可伴有小叶间隔增厚的网状影;双肺对称或不对称的弥漫网状结节。
(2)次要特征:满足可疑感染部位的相应临床症状、体征及至少一项支持感染的实验室证据(常规或生化检查)三项中的两项。
(1)直接检查:主要包括细胞学、直接支气管镜检或培养
痰、支气管肺泡灌洗液(BALF)、支气管刷取物、鼻窦吸取物中发现至少以下一项提示曲霉感染,即发现真菌成分显示为曲霉或常规培养提示曲霉;
痰BALF或脑脊液培养新型隐球菌阳性或经直接镜检、细胞学检查发现隐球菌;
气道分泌物或者活检肺组织发现肺孢子菌特征性包囊、滋养体,或者肺孢子菌核酸阳性。
(2)间接检查:主要是针对抗原或细胞壁成分的检测
血浆、血清、BALF或脑脊液检测半乳甘露聚糖抗原阳性提示曲霉;
血清1,3-β-D-葡聚糖检测阳性提示侵袭性侵袭性真菌病(隐球菌病、接合菌病除外);
血浆、血清、BALF检测隐球菌荚膜多糖抗原阳性提示隐球菌病;
血清1,3-β-D-葡聚糖阳性结合乳酸脱氢酶增高用于诊断肺孢子菌肺炎;
聚合酶链反应(PCR)可能提高侵袭性真菌病诊断率;血浆或BALF均可用于检测,敏感性优于培养,阳性需要鉴别定植与感染,阴性基本可以排除侵袭性真菌病。可以通过检测基因突变来判断耐药性。
确诊依赖深部组织学侵袭性真菌病依据或真菌血症。具体诊断标准参照中华医学会《实体器官移植侵袭性真菌病诊疗规范》[6]。
现代诊断性介入肺脏病学的发展,提高了肺部侵袭性真菌病的诊断能力。诊断性介入肺脏病学"实时伴随技术"快速现场评价技术也获得快速发展。快速现场评价是一项实时伴随于取材过程的快速细胞学判读技术。靶部位取材时,在基本不损失组织标本的前提下,将部分取材印涂于玻片,制成细胞学片基,迅速染色并以专用显微镜综合临床信息立即判读。判读内容包括:细胞形态、分类、计数、构成比、排列、相互关系、背景及外来物分析。快速现场评价可以根据微生物形态学直接判读部分真菌(如曲霉菌、隐球菌、肺孢子菌及假丝酵母菌等)。快速现场评价包括细胞学评价和微生物学评价,后者的主要目的是:提供部分微生物病原的形态学依据。如假丝酵母菌属的属间鉴别、曲霉菌属的属间鉴别等。另外,快速现场评价对于处于菌丝时相的真菌的确认相对容易,且具有极高的灵敏度与特异性[19]。
现代测序技术和生物信息学的快速发展使病原微生物宏基因组测序技术不断成熟,病原微生物宏基因组测序技术仅需从样品中直接获取少量DNA进行测序,然后通过参考基因组数据库鉴定病原体。但是,目前的测序技术在真菌的检测受到技术的局限,结果不甚理想;阴性结果并不能排除侵袭性真菌病[20]。
目前常用的抗真菌药物有多烯类、三唑类、棘白菌素类等。抗真菌药物选择应充分考虑药物有效性与安全性,应根据脏器的功能合理选择,尤其要注意三唑类药物相互作用,三唑类抗真菌药和钙调磷酸酶抑制剂(CNI)及其他免疫抑制剂相互作用复杂,用药过程中注意免疫药物剂量的调整(表1),并同时监测各自血清药物浓度、同时需要动态观察心电图、监测QT间期等。肺移植受者伏立康唑和泊沙康唑的理想血浆浓度应该控制在0.75~3.8 mg/L之间。
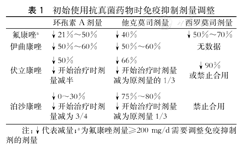
初始使用抗真菌药物时免疫抑制剂量调整
初始使用抗真菌药物时免疫抑制剂量调整
| 环孢素A剂量 | 他克莫司剂量 | 西罗莫司剂量 | |
|---|---|---|---|
| 氟康唑a | ↓21%~50% | ↓40% | ↓50%~70% |
| 伊曲康唑 | ↓50%~60% | ↓50%~60% | 无数据 |
| 伏立康唑 | ↓50% | ↓66% | ↓90%或禁止合用 |
| ↓开始治疗时剂量减半 | ↓开始治疗时剂量减为原剂量的1/3 | ||
| 泊沙康唑 | ↓0~30% | ↓75%~80% | 禁止合用 |
| ↓开始治疗时剂量减为3/4 | ↓开始治疗时剂量减为原剂量1/3 |
注:↓代表减量;a为氟康唑剂量≥200 mg/d需要调整免疫抑制剂的剂量
肺移植侵袭性真菌病往往进展迅速,不但影响移植物功能,而且严重威胁受者生命。鉴于肺移植侵袭性真菌病高危因素的特殊性及目前临床上缺少快速、特异性的诊断手段,推荐对肺移植受者采取合理的预防措施,以保护移植物功能,降低死亡率。
(1)一般预防:优化手术和免疫抑制方案;减少不必要的侵入性操作,尽早拔除留置导管,缩短静脉通道保留时间等;严格控制医院内外的环境因素;避免暴露于建筑施工场所,避免接触绿色植物、鲜花、潮湿土壤、禁忌园艺活动,以减少真菌孢子的暴露。
(2)靶向预防:指针对肺移植受者侵袭性真菌病的某些特定情况所采取的具有针对性的药物防范措施。推荐意见如下:
特定时期如围手术期、大剂量免疫抑制剂使用阶段等,予以相应的药物预防[1-C]。
高危因素肺移植受者,应使用局部和/或系统性抗真菌药物预防(1-B);局部用药,主要以雾化方式给药,如雾化吸入两性霉素B(AMB),系统性用药主要包括唑类药物及棘白菌素类药物。
肺移植受者侵袭性真菌病的主要病原体为曲霉,曲霉预防药物建议如表2。

肺移植受者侵袭性肺曲霉病的预防及治疗用药推荐
肺移植受者侵袭性肺曲霉病的预防及治疗用药推荐
| 预防用药 | 治疗用药 | ||
|---|---|---|---|
| 泊沙康唑 | 强推荐(1-A) | 伏立康唑 | 强推荐(1-A) |
| 伊曲康唑 | 强推荐(1-B) | 泊沙康唑 | 强推荐(1-A) |
| AMB脂质体 | 强推荐(1-B) | 艾沙康唑 | 强推荐(1-A) |
| 伏立康唑 | 强推荐(1-B) | AMB脂质体 | 强推荐(1-B) |
| 卡泊芬净 | 弱推荐(1-C) | 卡泊芬净 | 强推荐(1-B) |
| 米卡芬净 | 弱推荐(1-C) | 米卡芬净 | 弱推荐(1-C) |
注:AMB为两性霉素B;A为证据等级高、强推荐;B为证据等级中,强推荐;C为证据等级低;弱推荐
(3)肺移植受者侵袭性曲霉病预防
肺移植侵袭性曲霉病目前大多采用普遍预防策略。约31%~36%的移植中心对侵袭性曲霉病采取抢先治疗的策略,对于术后3个月内培养阳性者给予抢先治疗可以减少侵袭性曲霉病的发病(抢先治疗组0比对照组18%)[21]。侵袭性曲霉病预防的药物选择、给药方式、持续时间,在不同中心差别很大,大多采用三唑类口服和/或联合雾化吸入AMB。总疗程方面,各中心长短不一,根据移植受者的具体情况进行调整。国际心肺移植协会建议:普遍预防推荐疗程4~6个月,抢先治疗推荐疗程3~4个月。
局部用药:吸入AMB是肺移植受者常用的预防策略。单肺移植受者吸入AMB在移植肺的气道中可以达到较高的药物浓度,在吻合口和近端气道均能达到有效浓度。AMB各剂型(脱氧脂盐单体、脂质体、脂质复合体),均可采用雾化吸入给药,有一定的预防效果。雾化吸入存在消化道、呼吸道不良反应,主要表现为口干、恶心、呕吐、味觉消失、咳嗽、胸闷、气道痉挛、呼吸困难等,可给予相应的对症处理。可在雾化之前予以β肾上腺素能受体兴奋剂和/或M胆碱能受体阻断剂雾化,以减轻气道刺激相关不良反应。无论AMB单体、脂质体或脂质复合体,均需灭菌注射用水配置,常用浓度为1~2.5 g/L,具体浓度可以根据个体耐受性进行调整,每次配置总溶液为5 ml,每次雾化吸入时间15~20 min。
全身用药:三唑类最常用,对绝大多数曲霉有效,是一线推荐药物,包括伏立康唑、泊沙康唑等。棘白菌素类包括卡泊芬净、米卡芬净等,属于二线药物[12]。唑类抗真菌药中,肺移植受者伏立康唑的肝毒性较常见。新一代三唑类药物泊沙康唑,抗菌谱更广,同时对接合菌有一定的活性。具有高亲脂性特点,在各器官组织浓度高,肺组织浓度更高、同时肝毒性更低。泊沙康唑口服生物利用度低,尤其是口服混悬液乳剂,而新一代制剂片剂改善了其生物利用度。因此,采用泊沙康唑预防或治疗用药时,需要根据受者胃肠道的耐受性进行合理选择,口服用药应予以相应的高脂饮食、避免联合使用质子泵抑制剂等,同时建议定期监测血药浓度。
(4)肺移植假丝酵母菌病预防
肺移植受者侵袭性假丝酵母菌病预防一般采用普遍预防策略,局部预防用药推荐AMB雾化吸入,系统性预防用药包括棘白菌素类及三唑类,前者是推荐的一线用药;主要包括卡泊芬净、米卡芬净。棘白菌素类药物目前没有口服剂型,限制了其长期应用,预防用药局限于术后早期。
(5)肺移植肺孢子菌肺炎的预防
肺移植受者是肺孢子菌肺炎的高风险人群,建议终生预防。长期药物预防可以有效降低移植后肺孢子菌肺炎的发生率。肺孢子菌肺炎的预防用药推荐如表3。
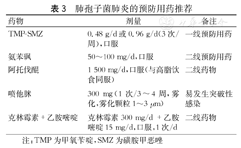
肺孢子菌肺炎的预防用药推荐
肺孢子菌肺炎的预防用药推荐
| 药物 | 剂量 | 备注 |
|---|---|---|
| TMP-SMZ | 0.48 g/d或0.96 g/d(3次/周),口服 | 一线预防用药 |
| 氨苯砜 | 50~100 mg/d,口服 | 二线预防用药 |
| 阿托伐醌 | 1 500 mg/d,口服(与高脂饮食同服) | 二线药物 |
| 喷他脒 | 300 mg(1次/3~4周,雾化,雾化颗粒1~3 μm) | 易发生突破性感染 |
| 克林霉素+乙胺嘧啶 | 克林霉素300 mg/d +乙胺嘧啶15 mg/d,口服,1次/d | 二线药物 |
注:TMP为甲氧苄啶,SMZ为磺胺甲恶唑
肺移植受者侵袭性真菌病的治疗级别分为拟诊治疗、临床诊断治疗、确诊治疗及加强治疗四级,对于肺移植受者的侵袭性真菌病,按照诊断级别,通过组织学标本得到确诊的病例很少。由于肺移植受者侵袭性真菌病病情进展迅速,而临床及影像学表现相对滞后,治疗反应迟缓,故应重视拟诊治疗和临床诊断治疗。针对侵袭性真菌病诊断级别中的确诊、临床诊断、拟诊病例,均推荐予以相应的治疗。一旦发现疑似侵袭性真菌病,应该立即启动抗真菌治疗,同时需要降低免疫抑制的强度,下调免疫抑制方案。一般首先减少或停用霉酚酸类药物,综合受者年龄、移植术后时间、感染严重程度等指标,适当下调CNI水平。
三唑类是首选,棘白菌素类不作为初始选择,但在其他抗真菌药禁忌时可以考虑使用;雾化AMB联合全身抗真菌药物可用于气管支气管曲霉菌病治疗、不推荐单独用于侵袭性曲霉病的治疗。
疗程:根据临床和影像治疗反应决定,大部分病例至少12周。有侵袭性曲霉病病史者在强化免疫抑制(如应用T淋巴细胞耗竭剂、大剂量糖皮质激素)治疗和长时间中性粒细胞缺乏期间,可以启动再次预防治疗。
不同部位治疗策略不同;以下进行分述。
肺假丝酵母菌病:对临床疑似病例,应根据呼吸道分泌物培养和气管镜检查结果进行治疗。轻中度者、非粒缺者和光滑、克柔假丝酵母菌病的低风险者,氟康唑可用于经验性治疗。对危重假丝酵母菌病、棘白菌素类和AMB是经验性治疗的一线药物,经验性治疗药物应该根据培养药敏及时调整。
假丝酵母菌血症:肺移植受者,无论是否存在中性粒细胞减少,初始治疗均建议使用棘白菌素类药物或AMB;如果受者病情较轻、无氟康唑耐药或既往未使用过三唑类抗真菌药,也可以选择氟康唑治疗。疗程:每天至少1次血培养检测,连续两次非同日结果为阴性,才能确认假丝酵母菌血症治愈;确认治愈后再治疗14 d;对于病情复杂的受者,则需要更长时间。
气道吻合口假丝酵母菌病:使用AMB雾化吸入联合系统性抗真菌药物,可以选择氟康唑或伏立康唑,后者抗菌谱更广。另外,需要定期支气管镜下清除气道坏死物。
其他部位假丝酵母菌病:口腔、食道、尿路的假丝酵母菌病,在肺移植受者中也较常见。如果仅是单纯口腔感染,推荐局部用药:制霉菌素涂抹口腔。尿路假丝酵母菌感染,如果是单纯无症状假丝酵母菌菌尿症者,可以不使用抗真菌治疗,祛除高危因素即可。食道及尿路的假丝酵母菌病,如果氟康唑敏感,可以予以氟康唑治疗至少2周;氟康唑耐药者,推荐多烯类(或联合口服5-氟胞嘧啶)治疗。
目标是治愈感染,防止全身播散,尤其是中枢神经系统播散。因此,肺移植受者无论是否存在临床症状,一旦考虑隐球菌感染,均需启动治疗。对于无症状感染或局灶性肺部感染轻症者,初始氟康唑400 mg/d,临床改善后减量至200 mg/d,总疗程6~12个月。重症肺隐球菌病和/或中枢神经系统感染者,诱导治疗予以ABM脂质体3~6 mg·kg-1·d-1或AMB单体0.7~1 mg·kg-1·d-1联合氟胞嘧啶100 mg·kg-1·d-1静脉滴注,疗程2周;巩固治疗以氟康唑静脉滴注,疗程8周;维持治疗予以氟康唑静脉滴注或口服,疗程6~12个月。
包括手术和药物治疗;后者适用于病灶局限毛霉病,不适于播散性毛霉病。药物治疗主要包括AMB及三唑类药物;AMB脂质体是一线治疗药物,泊沙康唑具有抗毛霉活性。推荐起始予以AMB脂质体,可使用足量(10 mg·kg-1·d-1)静脉滴注,避免逐渐增加剂量的治疗方法;治疗2周或临床好转后可改为泊沙康唑治疗。如果没有AMB脂质体,可以选择AMB单体,如果无毒副作用表现,应尽快加量至目标剂量:10 mg·kg-1·d-1。泊沙康唑作为新型广谱三唑类药物,也可以用于AMB不耐受或AMB无效的补救性治疗;初始治疗推荐使用针剂,病情好转后序贯口服。泊沙康唑口服片剂较混悬液的生物利用度得到提高,并且受食物和胃酸抑制的影响较小,推荐首选。难治性/危重症毛霉病初始治疗可以联合两种或者两种以上抗真菌药物,但其协同效应和毒副作用尚需临床进一步评估。
及时启动肺孢子菌肺炎特异性治疗至关重要,延迟治疗常常增加受者机械通气的需要和死亡率,治疗推荐药物详见表4。

肺孢子菌肺炎的治疗用药推荐及备注
肺孢子菌肺炎的治疗用药推荐及备注
| 药物 | 剂量 | 备注 |
|---|---|---|
| TMP-SMX | TMP 15~20 mg·kg-1·d-1,静脉滴注,3~4次/d,轻症可予复合强化片剂0.96 g/d,口服,4次/d | 首选药物(强推荐,中等证据) |
| 喷他脒 | 起始剂量4 mg·kg-1·d-1,静脉滴注,3~5 d后可减至2~3 mg·kg-1·d-1,输注时间≥1~2 h | 磺胺不耐受者(强推荐,中等证据) |
| 阿托伐醌 | 750 mg口服(2次/d)(1500 mg,2次/d仅有口服混悬液),口服吸收变异性大 | 仅用于轻-中症肺孢子菌肺炎受者(强推荐,低证据) |
| 伯氨喹+克林霉素 | 伯氨喹15~30 mg/d,口服,1次/d;克林霉素600~900 mg/d,静脉滴注或口服,3~4次/d;(G6PD缺乏症受者禁用伯氨喹) | 长期使用克林霉素可增加艰难梭菌感染(强推荐,中等证据) |
| 氨苯砜+甲氧苄氨嘧啶 | 氨苯砜100 mg/d;甲氧苄氨嘧啶15 mg·kg-1·d-1,口服,3次/d | (弱推荐,证据不足) |
| 乙胺嘧啶+磺胺嘧啶 | 乙胺嘧啶负荷量为100~200 mg/d口服;继之50~100 mg/d联合磺胺嘧啶4 g/d,分次口服 | 补充叶酸(10 mg/d,口服,1次/d)以减少毒性 |
| 大环内酯类 | 联合使用TMP-SMX可能发挥协同作用 | (弱推荐,证据不足) |
| 卡泊芬净 | 建议与TMP-SMX联合使用 | 动物模型提示(弱推荐,证据不足) |
| 三甲曲沙 | 三甲曲沙45mg·m-2·d-1,静脉滴注(或1.5 mg·kg-1·d-1,静脉滴注) | 需补充叶酸,证据不足 |
| 糖皮质激素 | 甲泼尼龙0.75~1 mg·kg-1·d-1 | 针对低氧受者 |
注:SMZ为磺胺甲恶唑,TMP为甲氧苄啶
肺移植受者少见真菌包括马尔尼菲蓝状菌病、球孢子菌病、镰刀菌病、尖端赛多孢子菌病、多产赛多孢子菌、暗色霉菌病等。
马尔尼菲蓝状菌病是由马尔尼菲蓝状菌感染引起的全身多系统播散性真菌疾病。肺移植受者马尔尼菲蓝状菌病报道较少,来源于供肺的马尔尼菲蓝状菌可以导致肺移植受者发生马尔尼菲蓝状菌病[22]。肺移植马尔尼菲蓝状菌病的临床表现包括发热、咳嗽、贫血、乏力和体重减轻,其次是淋巴结肿大、肝脾肿大、呼吸困难、皮肤病变等。肺部影像学表现多变,包括局限性浸润、网状结节、弥漫性肺部阴影、厚壁空洞、胸腔积液、纵隔和肺门淋巴结肿大等,需注意与肺结核鉴别[23]。对马尔尼菲蓝状菌病疑诊受者,应仔细询问病史,尤其是4周内有无流行地区旅行史、生活史。真菌镜检有助于早期诊断,真菌培养及组织病理是诊断金标准。大多数三唑类抗真菌药对马尔尼菲蓝状菌病有预防作用。马尔尼菲蓝状菌病治疗应以真菌培养的药敏结果为指导。全身播散性马尔尼菲蓝状菌病,推荐AMB初始治疗,之后改为伏立康唑或伊曲康唑序贯治疗,总疗程推荐至少12周。
尖端赛多孢子菌、多产赛多孢子菌、镰刀菌、暗色霉菌病等少见真菌病,经验性用药可以选择AMB、泊沙康唑或伏立康唑,申克孢子丝状菌病可以选择AMB或泊沙康唑。治疗原则参照美国感染学会(IDSA)指南的治疗原则、根据药敏选择相应药物,注意三唑类药物剂量调整及浓度监测。
执笔人:吴波(无锡市人民医院)、巨春蓉(广州医科大学附属第一医院)、冯靖(天津医科大学总医院)
专家组成员:(按姓氏汉语拼音字母排序)
冯敏(郑州大学第一附属医院)、杨莉[树兰(杭州)医院]、陈文慧(中日友好医院)、刘红梅(河南省人民医院)、胡春晓(无锡市人民医院)、柯立[中国科学技术大学附属第一医院(安徽省立医院)]、许淑云(华中科技大学同济医学院附属同济医院)、乔贵宾(广东省人民医院)、郭璐(四川省人民医院)、李锋(上海市胸科医院)、许红阳(无锡市人民医院)
所有作者均声明不存在利益冲突


























