
探讨初诊急性髓系白血病(AML)患者的基因突变分布特点及其与预后的关系。
回顾性分析2016年5月至2019年12月就诊于空军军医大学第二附属医院(唐都医院)的225例初诊AML(非急性早幼粒细胞白血病)患者的临床资料。采用二代测序技术检测与AML、骨髓增生异常综合征(MDS)、骨髓增殖性肿瘤(MPN)相关的34个基因突变,分析总体基因突变的分布及其在不同年龄组间分布的差异,对比不同基因突变患者生存的差异,采用Cox回归模型分析<60岁和≥60岁患者生存影响因素。
225例患者共检测到496个基因突变位点,中位变异等位基因频率(VAF)为38.55%(1.00%~94.86%),患者中位突变基因数为3个/例(0~8个/例)。突变发生频率较高的基因有ASXL1、CEBPA、NPM1、NRAS、FLT3-ITD、DNMT3A、IDH2、TET2、RUNX1、IDH1。≥60岁患者(56例)TET2、SRSF2、SF3B1基因突变发生率均高于<60岁患者(169例),差异均有统计学意义(均P<0.01);在≥60岁患者中同时发生3种及以上基因突变者比例较<60岁患者高[53.6%(30/56)比33.1%(56/169),χ2=7.44,P=0.006]。TP53、RUNX1或FLT3-ITD基因突变患者的总生存(OS)较各基因野生型患者差,CEBPA基因双突变患者OS优于其单突变或野生型患者,差异均有统计学意义(均P<0.05)。多因素Cox回归分析结果显示,CEBPA(HR=0.279,95% CI 0.084~0.926,P=0.037)、TET2(HR=2.611,95% CI 1.115~6.111,P=0.027)和TP53(HR=3.609,95% CI 1.159~11.234,P=0.027)基因突变是<60岁AML患者生存的独立影响因素,ASXL1(HR=3.523,95% CI 1.385~8.962,P=0.008)、FLT3-ITD(HR=4.618,95% CI 1.813~11.762,P=0.001)和NRAS(HR=2.896,95% CI 1.166~7.000,P=0.022)基因突变是≥60岁AML患者生存的独立危险因素。
不同年龄AML患者基因突变分布存在差异,老年患者更易同时合并多种基因突变。除了已知的CEBPA双突变和TP53、ASXL1、RUNX1等基因突变外,TET2和NRAS基因突变可能也是影响预后的因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
目前,二代测序(NGS)技术作为重要的分子生物学检测手段,在血液肿瘤中的应用越来越普遍,越来越多的急性髓系白血病(AML)相关基因突变被发现[1,2]。AML相关基因突变也是AML诊断、预后分层及治疗方案选择的重要依据[3]。目前AML预后判断主要参照美国国立综合癌症网络(NCCN)或欧洲白血病网(ELN)预后分层系统,但我国生活环境、饮食习惯、遗传学背景与欧美人群存在差异,因而本研究基于NGS技术,分析34种常见基因突变在AML患者中的分布情况及其与预后的关系。
回顾性分析2016年5月至2019年12月就诊于我科的225例初诊AML(非急性早幼粒细胞白血病)患者的临床资料,包括男性129例,女性96例;中位年龄50岁(5~85岁)。根据世界卫生组织(WHO)2016版标准进行诊断和分型[4],其中M0型1例,M1型34例,M2型150例,M4型16例,M5型23例,M6型1例。依据NCCN 2019版诊疗指南进行预后分层[5],预后良好组80例,预后中等组71例,预后不良组74例。<60岁组169例,≥60岁组56例,两组患者临床特征比较见表1。本研究经我院医学伦理委员会批准(批准文号:TDLI-KY-202107-04),患者及其家属均知情同意。
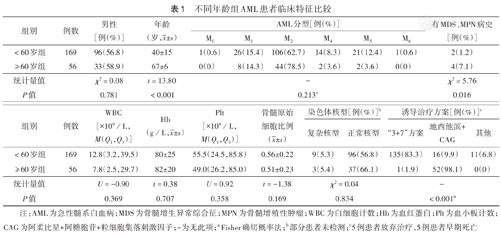
不同年龄组AML患者临床特征比较
不同年龄组AML患者临床特征比较
| 组别 | 例数 | 男性[例(%)] | 年龄(岁, ±s) ±s) | AML分型[例(%)] | 有MDS、MPN病史[例(%)] | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| M0 | M1 | M2 | M4 | M5 | M6 | |||||
| <60岁组 | 169 | 96(56.8) | 40±15 | 1(0.6) | 26(15.4) | 106(62.7) | 14(8.3) | 21(12.4) | 1(0.6) | 2(1.2) |
| ≥60岁组 | 56 | 33(58.9) | 67±6 | 0(0) | 8(14.3) | 44(78.5) | 2(3.6) | 2(3.6) | 0(0) | 4(7.1) |
| 统计量值 | χ2=0.08 | t=13.80 | - | χ2=5.76 | ||||||
| P值 | 0.781 | <0.001 | 0.213a | 0.016 | ||||||
| 组别 | 例数 | WBC [×109/L, M(Q1,Q3)] | Hb (g/L, ±s) ±s) | Plt [×109/L, M(Q1,Q3)] | 骨髓原始细胞比例( ±s) ±s) | 染色体核型[例(%)]b | 诱导治疗方案[例(%)]c | |||
|---|---|---|---|---|---|---|---|---|---|---|
| 复杂核型 | 正常核型 | "3+7"方案 | 地西他滨+CAG | 其他 | ||||||
| <60岁组 | 169 | 12.8(3.2,39.5) | 80±25 | 55.5(24.5,85.8) | 0.56±0.22 | 9(5.3) | 96(56.8) | 135(83.3) | 16(9.9) | 11(6.8) |
| ≥60岁组 | 56 | 7.8(2.5,29.7) | 82±20 | 49.0(26.2,85.0) | 0.51±0.23 | 3(5.4) | 37(66.1) | 1(1.9) | 52(98.1) | 0(0) |
| 统计量值 | U=-0.90 | t=0.38 | U=0.92 | t=-1.38 | χ2=0.04 | - | ||||
| P值 | 0.369 | 0.707 | 0.358 | 0.169 | 0.834 | <0.001a | ||||
注:AML为急性髓系白血病;MDS为骨髓增生异常综合征;MPN为骨髓增殖性肿瘤;WBC为白细胞计数;Hb为血红蛋白;Plt为血小板计数;CAG为阿柔比星+阿糖胞苷+粒细胞集落刺激因子;-为无此项;a Fisher确切概率法;b部分患者未检测;c5例患者放弃治疗,5例患者早期死亡
抽取初诊患者治疗前骨髓液3 ml,提取细胞内DNA,采用扩增法建库,用Illumina测序平台进行桥式扩增生成簇,再进行测序,检测与AML、骨髓增生异常综合征(MDS)、骨髓增殖性肿瘤(MPN)相关的34个基因突变情况,包括ASXL1、CEBPA、NPM1、NRAS、FLT3-ITD、FLT3-TKD、DNMT3A、IDH1、IDH2、TET2、RUNX1、KIT、WT1、TP53、U2AF1、GATA2、BCOR、SRSF2、KRAS、BCORL1、PHF6、CBL、SF3B1、JAK2、ZRSR2、CSF3R、MLL、SETBP1、CALR、EZH2、ETV6、MPL、PDGFRA、SH2B3。应用IGV可视化分析软件进行结果分析,应用COSMIC、ClinVar、HGMD、ExAC、Ensembl等数据库进行变异结果注释。
<60岁患者大多采用标准"3+7"(去甲氧柔红霉素、柔红霉素或吡柔比星等联合阿糖胞苷)方案诱导治疗,≥60岁患者大多采用地西他滨联合CAG[阿柔比星+阿糖胞苷+粒细胞集落刺激因子(G-CSF)]方案诱导治疗,少数患者选用其他方案。诱导治疗获得部分缓解(PR)的患者采用原方案再诱导,未缓解者更换方案。1~2个疗程诱导治疗达形态学完全缓解(CR)者进行巩固治疗,其中<60岁患者采用中、高剂量阿糖胞苷方案,≥60岁患者多采用地西他滨+ CAG方案。225例患者中有5例患者因经济情况及治疗意愿等放弃治疗,另有5例患者早期死亡。根据预后分层、治疗反应、个人治疗意愿、体能状态及经济情况等因素决定是否移植,接受移植的患者共35例。
分析225例患者的基因突变结果。治疗后14~28 d复查骨髓形态,疗效评价依据血液病诊断及疗效标准[6],分为CR、PR及未缓解。通过门诊、住院病历及电话进行随访,随访截止时间为2020年3月20日。总生存(OS)时间为确诊至患者死亡或末次随访(失访)的时间;无复发生存(RFS)时间为从获得CR起至患者复发或CR状态下死亡或末次随访(失访)的时间。
应用SPSS 26.0软件进行统计学分析。符合正态分布的计量资料以 ±s表示,两组间比较采用t检验;非正态分布计量资料以M(Q1,Q3)表示,比较采用Mann-Whitney U检验。计数资料以频数(%)表示,比较采用χ2检验或Fisher确切概率法。采用Kaplan-Meier法进行生存分析,并进行log-rank检验。采用单因素Cox回归模型分析与预后相关的基因突变,将单因素分析中P<0.2的因素纳入多因素Cox回归模型,分析影响预后的基因突变。以P<0.05为差异有统计学意义。
±s表示,两组间比较采用t检验;非正态分布计量资料以M(Q1,Q3)表示,比较采用Mann-Whitney U检验。计数资料以频数(%)表示,比较采用χ2检验或Fisher确切概率法。采用Kaplan-Meier法进行生存分析,并进行log-rank检验。采用单因素Cox回归模型分析与预后相关的基因突变,将单因素分析中P<0.2的因素纳入多因素Cox回归模型,分析影响预后的基因突变。以P<0.05为差异有统计学意义。
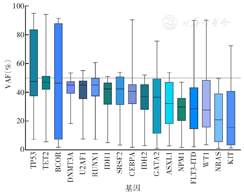
225例患者共检测到496个突变位点,不同年龄组基因突变发生率不同,其中TET2、SRSF2及SF3B1基因突变更易见于≥60岁患者,差异均有统计学意义(均P<0.01)(图1)。所有患者中位变异等位基因频率(VAF)为38.55%(1.00%~94.86%),突变频次>10例的基因VAF均<50%(图2)。所有患者中位突变基因数为3个/例(0~8个/例);与<60岁患者相比,≥60岁患者更易同时发生3种及以上的基因突变[53.6%(30/56)比33.1%(56/169),χ2=7.44,P=0.006]。
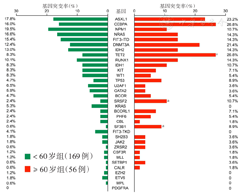

注:两组比较,aP<0.01

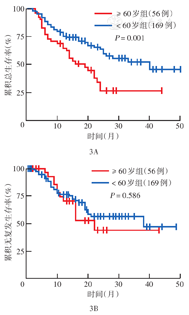
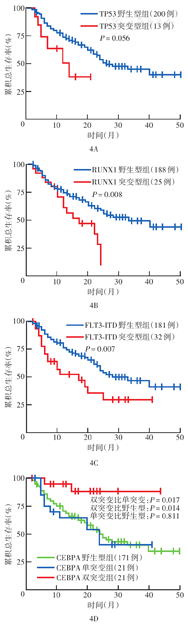
至随访结束,中位随访时间13个月(2~50个月),进入随访的220例患者中失访2例。<60岁和≥60岁患者的中位OS时间分别为38、16个月,2年OS率分别为63.6%和26.4%,差异有统计学意义(P=0.001)(图3A)。<60岁和≥60岁患者的中位RFS时间分别为36、20个月,2年RFS率分别为56.6%和44.0%,差异无统计学意义(P=0.586)(图3B)。与野生型患者相比,TP53、RUNX1或FLT3-ITD基因突变的患者OS较差,差异均有统计学意义(均P<0.05)(图4A、图4B、图4C)。CEBPA双突变患者OS优于其单突变和野生型患者(均P<0.05),CEBPA单突变与野生型患者间OS差异无统计学意义(P=0.811)(图4D)。


单因素Cox回归分析显示,<60岁AML患者中,CEBPA、TET2、TP53突变与生存相关(均P<0.05);≥60岁AML患者中,FLT3-ITD突变与生存相关(P=0.013)(表2)。多因素Cox回归分析结果显示,CEBPA、TET2和TP53突变是<60岁AML患者生存的独立影响因素(均P<0.05)(表3),ASXL1、FLT3-ITD和NRAS突变是≥60岁AML患者生存的独立危险因素(表4)。
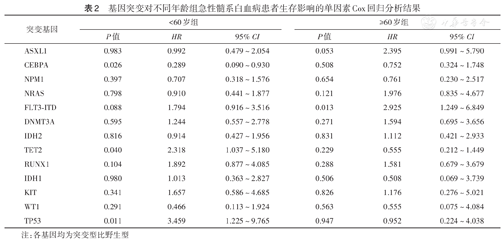
基因突变对不同年龄组急性髓系白血病患者生存影响的单因素Cox回归分析结果
基因突变对不同年龄组急性髓系白血病患者生存影响的单因素Cox回归分析结果
| 突变基因 | <60岁组 | ≥60岁组 | ||||
|---|---|---|---|---|---|---|
| P值 | HR | 95% CI | P值 | HR | 95% CI | |
| ASXL1 | 0.983 | 0.992 | 0.479~2.054 | 0.053 | 2.395 | 0.991~5.790 |
| CEBPA | 0.026 | 0.289 | 0.090~0.930 | 0.508 | 0.752 | 0.324~1.748 |
| NPM1 | 0.397 | 0.707 | 0.318~1.576 | 0.654 | 0.761 | 0.230~2.517 |
| NRAS | 0.798 | 0.910 | 0.441~1.877 | 0.121 | 1.976 | 0.835~4.677 |
| FLT3-ITD | 0.088 | 1.794 | 0.916~3.516 | 0.013 | 2.925 | 1.249~6.849 |
| DNMT3A | 0.595 | 1.244 | 0.557~2.778 | 0.271 | 1.594 | 0.695~3.656 |
| IDH2 | 0.816 | 0.914 | 0.427~1.956 | 0.831 | 1.112 | 0.421~2.933 |
| TET2 | 0.040 | 2.318 | 1.037~5.180 | 0.229 | 0.555 | 0.212~1.449 |
| RUNX1 | 0.104 | 1.892 | 0.877~4.085 | 0.288 | 1.581 | 0.679~3.679 |
| IDH1 | 0.980 | 1.013 | 0.363~2.827 | 0.506 | 0.508 | 0.069~3.739 |
| KIT | 0.341 | 1.657 | 0.586~4.685 | 0.826 | 1.176 | 0.276~5.021 |
| WT1 | 0.291 | 0.466 | 0.113~1.924 | 0.563 | 0.555 | 0.075~4.084 |
| TP53 | 0.011 | 3.459 | 1.225~9.765 | 0.947 | 0.952 | 0.224~4.038 |
注:各基因均为突变型比野生型
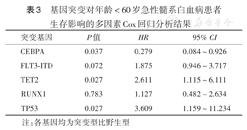
基因突变对年龄<60岁急性髓系白血病患者生存影响的多因素Cox回归分析结果
基因突变对年龄<60岁急性髓系白血病患者生存影响的多因素Cox回归分析结果
| 突变基因 | P值 | HR | 95% CI |
|---|---|---|---|
| CEBPA | 0.037 | 0.279 | 0.084~0.926 |
| FLT3-ITD | 0.072 | 1.875 | 0.946~3.717 |
| TET2 | 0.027 | 2.611 | 1.115~6.111 |
| RUNX1 | 0.783 | 1.127 | 0.482~2.634 |
| TP53 | 0.027 | 3.609 | 1.159~11.234 |
注:各基因均为突变型比野生型
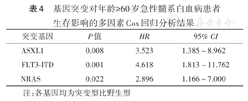
基因突变对年龄≥60岁急性髓系白血病患者生存影响的多因素Cox回归分析结果
基因突变对年龄≥60岁急性髓系白血病患者生存影响的多因素Cox回归分析结果
| 突变基因 | P值 | HR | 95% CI |
|---|---|---|---|
| ASXL1 | 0.008 | 3.523 | 1.385~8.962 |
| FLT3-ITD | 0.001 | 4.618 | 1.813~11.762 |
| NRAS | 0.022 | 2.896 | 1.166~7.000 |
注:各基因均为突变型比野生型
本研究纳入的225例初诊AML患者中,突变发生频率较高的基因是ASXL1、CEBPA、NPM1、NRAS、FLT3-ITD、DNMT3A、IDH2、TET2、RUNX1、IDH1。目前认为DNMT3A、ASXL1、TET2、RUNX1、IDH1、IDH2等基因突变与患者年龄相关,更易见于老年患者,本研究中≥60岁患者多见的突变基因依次为TET2、CEBPA、ASXL1、DNMT3A、RUNX1、NRAS等,与文献[7,8]报道相近。不同年龄组患者的基因突变谱不同,提示AML具有不同的生物学特性,近年来发现ASXL1、TET2、RUNX1、SRSF2等基因突变与年龄呈正相关[9]。施均[10]认为克隆性造血的发生是造血干细胞内在衰老和外在环境因素阳性筛选共同作用的结果,治疗达CR后多数会持续存在,其对缓解率、生存率、耐药或复发的意义不尽相同,值得进一步研究。
NCCN及ELN指南中指出伴有CEBPA双突变者预后良好,伴有TP53、RUNX1或ASXL1突变者预后不良,而FLT3-ITD受突变等位比、是否合并NPM1等因素影响,预后存在一定差别,当RUNX1或ASXL1合并预后良好因素时不作为预后不良指标。这表明随着研究的不断深入和细化,基因突变的等位比及同时发生的基因突变类型不同时,预后差异也较大。近年来关于启动基因、二次打击等研究较多,进一步明确了基因突变的临床意义和诊疗价值。本研究显示AML患者合并FLT3-ITD、RUNX1或TP53基因突变时提示预后不良,考虑到样本量偏少容易造成结果偏倚,故未对突变等位比及合并基因突变细化研究。
TET2突变约见于20%的AML患者,更易见于有MDS或MPN病史的患者[11],还有研究认为TET2基因突变是一次打击,而白血病发生的关键是要有二次打击[12],这可能也是TET2在白血病患者中,尤其是在老年患者中,较常见的原因。目前TET2突变对预后的影响尚不明确,我国有学者认为TET2基因低表达是正常核型AML患者预后不良指标[13]。本研究发现TET2基因突变是<60岁患者的不良预后因素,但不影响老年患者的预后,考虑可能原因是含去甲基化药物的治疗方案使伴有TET2突变的患者获益。
RAS家族成员主要有NRAS、KRAS和HRAS,参与RAS-RAF-MEK和RAS-PIK等信号通路,调控细胞的增殖、分化[14]。其中的NRAS和KRAS与AML相关,突变发生率分别约为12%和5%[15],有研究认为NRAS基因突变对AML患者的预后无明显影响[14],也有研究显示NRAS提示预后不良[16]。本研究发现NRAS基因突变在≥60岁患者中提示预后不良,但需扩大样本量和延长随访时间等进一步追踪研究。
基因突变之间存在协同或拮抗作用,如NPM1基因突变常与FLT3-ITD或NRAS突变合并出现,但NPM1与FLT3-ITD组合突变者预后明显较NPM1与RAS组合突变者差[17];还有研究发现ASXL1-G643W突变加速了CEBPA突变型AML的发生[18];DNMT3a缺失和IDH2同源突变相互促进恶性造血,在白血病的发生中具有协同作用[19]。临床可见到一些中低危AML患者难以缓解或缓解后复发,他们对治疗反应差异较大。提示多种基因突变的相互作用也可能是影响治疗反应及预后的因素,尚需更多的研究数据加以验证。
综上所述,不同年龄AML患者基因突变的分布存在差异,基因突变对患者治疗反应及预后的影响也不同。目前已知CEBPA双突变和TP53、ASXL1、RUNX1等基因突变是影响AML患者预后的重要基因突变,本研究还发现TET2和NRAS突变可能也是影响预后的因素,但有待多中心研究加以验证;此外,基因突变之间的相互作用也值得进一步研究。
所有作者均声明不存在利益冲突



























