
探究溶质载体家族24成员5(SLC24A5)的表达与皮肤黑色素瘤(SKCM)细胞增殖和侵袭的关系,对SLC24A5作为SKCM的潜在生物标志物和治疗靶点的可能性进行初步探讨。
利用生物信息学的方法搜集相关信息,随后建立敲低SLC24A5的MEL-526和SK-HEL-5黑色素瘤细胞模型,通过Western blot与实时定量聚合酶链式反应(qPCR)实验验证SLC24A5的敲低效率,并探讨敲低SLC24A5对SKCM细胞增殖和侵袭的影响。
SLC24A5在SKCM组织中的表达显著高于癌旁正常组织,高表达SLC24A5的患者的预后更差。敲低SLC24A5后,MEL-526和SK-HEL-5细胞的增殖受到抑制。
SLC24A5在SKCM的进展中扮演着重要角色,有成为SKCM的治疗靶点和生物标志物的潜力。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
皮肤黑色素瘤(skin cutaneous melanoma,SKCM)是发病率最高、侵袭性最强的皮肤恶性肿瘤。美国癌症协会的数据表明,近年来男性和女性新发SKCM的病例数分别居于所有癌症的第5位和第6位[1,2,3]。SKCM可发生在身体多处位置,但多数发生在皮肤组织中。由于SKCM倾向于异常增殖以及早期淋巴和血源性转移,其恶性和死亡率很高[4]。目前,靶向疗法,如B-Raf原癌基因、丝氨酸/苏氨酸激酶和MET原癌基因、受体酪氨酸激酶抑制剂[5]和免疫疗法,如抗CTLA4、抗PD-1和抗PD-L1[6,7]已可用于转移性或晚期SKCM,但治疗效果并不理想。目前,用于预测SKCM的生物标志物很少,因此寻找到一种新的生物标志物对SKCM的早期诊断、治疗与预后评估的意义重大。
溶质载体家族24成员5(solute carrier family 24 member 5,SLC24A5)是一种蛋白编码基因,定位于细胞内膜,可能是黑素体或其前体。人类和斑马鱼在这个基因的序列及功能上有很高的同源性[8]。与SLC24A5相关的疾病包括白化病、眼皮肤病、Vi型白化病和眼皮肤白化病[9,10]。已有大量研究结果证实了SLC24A5与皮肤色素沉着相关[11]。也有相关报道揭示了SCL24A5导致的色素沉积与维生素D的缺乏相关[12]。然而,关于SLC24A5在肿瘤中的作用则鲜有报道。Chi等[13]对黑素小体蛋白质组进行比较分析和功能鉴定,在所有阶段的黑素小体中鉴定出大约1 500个蛋白质,在任何给定的阶段中鉴定出大约600个蛋白质。这些蛋白包括16个与小鼠皮毛颜色基因同源的蛋白和许多与人类色素疾病相关的蛋白。该研究结果表明,来自色素和非色素黑色素细胞的黑色素小体共享的大约100种蛋白质定义了必需的黑色素小体蛋白质组,其细胞内定位的蛋白包括色素上皮衍生因子和钠-钾-钙交换蛋白5(K+-dependent Na+/Ca2+ exchanger 5,NCKX5)。上述研究结果均证明SLC24A5与黑色素形成密切相关,具有作为SKCM潜在的生物标志物和可能治疗靶点的潜力。
本研究旨在初步探究SKCM与SLC24A5之间的关系,通过生物信息学分析结合细胞实验,验证SLC24A5在SKCM中的作用,有助于更深入地理解二者之间的关系,为进一步探明SLC24A5在SKCM中的具体机制奠定基础,并为SKCM的早期诊断、治疗及预后评估提供新的思路。
MEL-526和SK-HEL-5细胞系(中国科学院细胞库),Trizol试剂、cDNA逆转录试剂盒(美国Thermo Fisher Scientific公司);胎牛血清(fetal bovine serum,FBS)、RPMI-1640培养基(美国GIBCO公司),SLC24A5引物[生工生物工程(上海)股份有限公司],CCK-8细胞计数试剂盒(日本Dojindo公司)。
Heracell VIOS 160i二氧化碳培养箱(美国Thermo Fisher Scientific公司)。
从癌症基因图谱(the cancer genome atlas,TCGA)数据库下载SKCM患者的临床数据和mRNA表达数据,所下载的数据为FKPM格式,将其转化为TPM格式。随即比较SLC24A5的mRNA在SKCM组织和癌旁正常组织中的表达情况。
将MEL-526和SK-HEL-5人黑色素瘤细胞株在培养箱中在37 ℃、95%相对湿度和5%CO2的条件下培养。MEL-526和SK-HEL-5细胞的培养液由体积分数为10%的FBS和RPMI-1640培养基配制而成。经携带shRNA质粒处理的MEL-526和SK-HEL-5细胞为shRNA组,未做任何处理的细胞为对照组。
建立稳定SLC24A5低表达的MEL-526和SK-HEL-5细胞,所设计的shRNA的序列为5'-AAACATCGCTGTCGTTTCAAGAG-3'。两种细胞的敲低效率通过实时定量聚合酶链式反应(quantitative real-timepolymerase chain reaction,qPCR)和蛋白质免疫印迹(Western blot)验证。选择稳定的敲低SLC24A5的MEL-526和SK-HEL-5细胞用于后续实验。
用Trizol试剂提取MEL-526和SK-HEL-5细胞的总RNA。通过cDNA逆转录试剂盒将总RNA逆转录为cDNA。然后,进行qPCR测试以验证SLC24A5在MEL-526和SK-HEL-5细胞中的表达。SLC24A5引物:正向引物为5'-GGCCAAACATGGGCGAGAA-3';反向引物为5'-CTTCGGGAAACTCCGATGATG-3'。
提取蛋白后测定蛋白质浓度,保证所加入每条跑道的蛋白质的量相同。按照试剂盒说明书制胶,制胶过程中确保上、下胶中没有气泡,并在加入四甲基乙二胺前将胶吹匀。加样后,将电压设为65 V,直到蛋白处于同一水平。随后将电压设为119 V,时间为120 min。取出聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,SDS-PAGE)膜,制作聚偏氟乙烯[poly(vinylidenefluoride),PVDF]膜,进行转膜,确保膜与胶之间不产生气泡。取出PVDF膜,用TBST溶液清洗3次,每次10 min,然后用体积分数为9.5%的脱脂牛奶封闭2 h。随后用TBST溶液清洗PVDF膜3次,之后将PVDF膜放入一抗中,用4 ℃的摇床过夜。第二天,在室温下用TBST溶液清洗PVDF膜3次,之后加入二抗,用摇床孵育1 h,再用TBST溶液清洗3次,在-20 ℃下显影。
采用CCK-8细胞计数试剂盒进行细胞增殖测试,使用10 μl细胞计数溶液,将对照和实验组MEL-526和SK-HEL-5细胞放入37 ℃、95%相对湿度和5%CO2的培养箱中孵育1 h。然后,测量细胞在570 nm处的吸光度。
在培养板上划线标记,细胞铺板划线,随即用无菌磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲洗细胞3次并让留下的间隙肉眼可见,然后更换新鲜无血清或低血清(<2%)的培养基。将shRNA组和对照组的MEL-526和SK-HEL-5细胞放入37 ℃,5%CO2的培养箱中培养。分别在0,6,12,24 h后取出细胞,在显微镜下观察并拍照。
配制0.1%的结晶紫溶液的方法:取质量分数为2.5%的结晶紫乙醇溶液原液,在1 ml结晶紫原液中加入4 ml无水乙醇,配置成0.5%的结晶紫母液;再在1ml结晶紫母液中加入4 ml PBS配制成0.1%的结晶紫溶液。每个小室加入10 000个细胞,上室用纯RPMI-1640培养基,下室用PBS稀释的体积分数为20%的RPMI-1640培养基。固定方法:用PBS浸洗小室,再加入4 ℃甲醇固定15 min。染色方法:用PBS浸洗3 min,加入500 μl结晶紫溶液并染色15 min。擦上室细胞方法:用PBS清洗3次,每次2 min,用棉签擦掉上室细胞。完成上述步骤后,风干小室,并置于显微镜下拍照。
采用R语言(version 3.1.5)对数据进行统计分析,符合正态分布的数据用均数±标准差(Mean±SD)表示。使用t检验对shRNA组和对照组的数据进行比较,使用χ2检验验证SKCM的临床病理特征与SLC24A蛋白表达水平间的关系。以P<0.05为差异具有统计学意义。
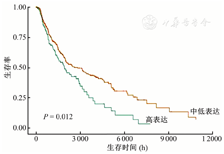
使用TCGA数据库中的SKCM数据集,收集了473例临床样本,其中包括368例SKCM转移样本、104例原发性样本和1例癌旁正常组织样本。在线分析结果显示,SLC24A5的mRNA水平在SKCM组织中明显高于癌旁正常组织(均P<0.05),如图1所示。该结果证实了SLC24A5与SKCM存在相关性。此外,高表达SLC24A5的患者的预后生存期明显短于中低表达SLC24A5的患者(P=0.012),如图2所示。
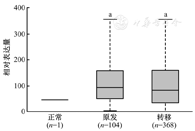

"正常"表示正常组织样本;"原发"表示原发性样本;"转移"表示转移样本;与正常组织样本比较,aP<0.05

使用qPCR和Western blot检测对SLC24A5的敲低效率进行了测试。结果表明,shRNA组SLC24A5的mRNA和蛋白质表达水平均相较于对照组显著降低(图3)。该结果表明,在MEL-526和SK-HEL-5细胞中成功构建了有效的SLC24A5敲低细胞模型。
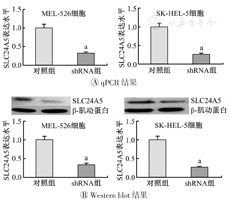

qPCR—实时定量聚合酶链式反应;SLC24A5—溶质载体家族24成员5;对照组为未敲低SLC24A5的皮肤黑色素瘤细胞;shRNA组为敲低SLC24A5的皮肤黑色素瘤细胞;与对照组比较,aP<0.05
采用CCK-8实验探究SLC24A5敲低MEL-526和SK-HEL-5细胞模型的增殖能力。结果显示,敲低SLC24A5的表达显著抑制了MEL-526和SK-HEL-5细胞的增殖(图4)。该结果反向证实SLC24A5的表达会促进SKCM细胞的增殖。
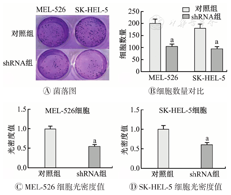

SLC24A5—溶质载体家族24成员5;对照组为未敲低SLC24A5的皮肤黑色素瘤细胞;shRNA组为敲低SLC24A5的皮肤黑色素瘤细胞;与对照组比较,aP<0.05
在稳定敲低SLC24A5后,相比于对照组,shRNA组的MEL-526和SK-HEL-5细胞的相侵袭能力下降(均P<0.05),反向证实SLC24A5的表达会促进SKCM细胞的侵袭。(图5)
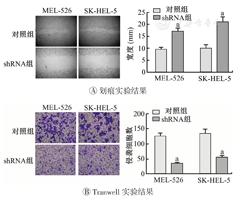

SLC24A5—溶质载体家族24成员5;对照组为未敲低SLC24A5的皮肤黑色素瘤细胞;shRNA组为敲低SLC24A5的皮肤黑色素瘤细胞;与对照组比较,aP<0.05
SKCM已成为世界上最高发的恶性肿瘤之一。与其他恶性肿瘤一样,SKCM通过遗传突变的积累发生和发展[13]。在大多数情况下,SKCM的形成具有线性逐步进展的组织病理学特征。SKCM始于明显的前体病变,然后经历一系列恶性病变,最后形成侵袭程度不同的转移性黑色素瘤[14,15,16,17,18]。研究结果表明,使用相关激酶抑制剂可治疗SKCM,但为了更好地控制SKCM的进展,寻找新的治疗靶点非常重要。
本研究结果初步证实了SLC24A5在SKCM组织中的表达高于癌旁正常组织,且SLC24A5的高表达与SKCM患者的预后密切相关,提示SLC24A5有作为SKCM生物标志物的潜力。本研究中,通过体外细胞实验成功建立了SLC24A5敲低的SKCM细胞模型,并用qPCR和Western blot验证了敲低效率。测试结果表明,敲低SLC24A5后,SKCM细胞的增值与侵袭能力明显下降。上述结果表明,SLC24A5通过影响细胞周期来发挥相应作用,其SLC24A5可促进SKCM细胞的增殖和侵袭。
目前,关于SLC24A5在肿瘤中的作用的研究较少,针对SLC24A5在SKCM细胞层面的研究也鲜见报道。被公认的研究结果是SLC24A5在人类色素沉着中起关键作用[8]。有研究者评估了白化病基因变异(TYR、OCA2、TYRP1、SLC45A2、SLC24A5、LRMDA)和无黑色素/低黑色素瘤、色素黑色素瘤病例和对照组中常见的OCA2内含子变异,发现无黑色素/低黑色素瘤中TYR/OCA2的体细胞突变率高于色素性黑色素瘤样本[18]。Lu等[19]将Sp-Couch杂交鱼和亲本鱼暴露在紫外线B(Ultraviolet B,UVB)中,并使用RNA-Seq方法对其皮肤进行基因表达谱分析。结果表明,在Sp-Couch杂交鱼中有一组独特的UVB应答基因,包括DCT、PMELA、TYR、TYRP1A、SLC2A11B、RAB38A、RAB27、TSPAN10、SLC45A2、OCA2、SLC24A5、PTN和MITFA。上述基因与黑色素产生和黑素细胞增殖有关,且这些基因在Sp-Couch杂交鱼中被上调,表明它们对UVB的反应是杂交启动的。在Sp-Couch杂交鱼中,与黑色素产生和色素沉着相关的基因SLC45A2、TSPAN10、DCT、SLC2A11B和PTN均表现出X. couchianus或X. maculatus等位基因的特异性表达。这些基因在Sp-Couch杂交鱼中表现出等位基因特异性表达调控机制,但在亲本鱼中均未表现出相应的UVB反应,表明这些基因是UVB的作用靶点并暗示了Sp-Couch对诱导黑素瘤发生的敏感性机制。
本研究中利用生物信息学方法结合体外细胞实验初步阐释了SLC24A5与SKCM之间的关系,为进一步探索SLC24A5对SKCM的具体作用机制提供了基础依据,也为SKCM的早期诊断和治疗提供了新的思路。但本研究中的部分数据来自生物信息数据库,样本可能存在不足并产生抽样误差等。此外,本研究中未能从分子水平解释相关的现象和生物学功能等。因此,未来将从分子水平探究SLC24A5对SKCM的作用机制。
所有作者均声明不存在利益冲突



























