
系统评价艾曲波帕治疗免疫性血小板减少症(ITP)成年患者的有效性及安全性。
计算机检索PubMed、Embase、Cochrane图书馆等英文数据库,以及万方数据知识服务平台、维普中文科技期刊数据库、中国知网(CNKI)及中国生物医学文献数据库(CBM)等中文数据库中,关于艾曲波帕治疗ITP成年患者的临床研究文献。随机对照试验(RCT)中,研究组患者接受口服艾曲波帕治疗,对照组接受安慰剂治疗;单臂临床试验中,患者接受口服艾曲波帕治疗。文献检索时间设定为上述数据库建库至2020年10月30日。由2位研究者按照本研究设定的文献纳入和排除标准独立筛选文献,评价纳入文献的质量并提取资料。采用Revman 5.3软件对艾曲波帕治疗ITP成年患者的有效性和安全性进行Meta分析。艾曲波帕治疗ITP成年患者有效性及安全性的主要结局评价指标包括有效性指标:总反应率(ORR)、其他ITP治疗药物减低剂量或停药发生率;安全性指标:总不良反应发生率、严重不良反应率、出血事件发生率。
通过文献筛选,共计10篇临床研究文献符合本研究纳入标准,其中包含RCT 7项,单臂临床试验3项。纳入Meta分析的ITP成年患者为872例,其中研究组患者为663例,对照组为209例。针对艾曲波帕治疗ITP成年患者有效性和安全性的Meta分析结果如下。①与对照组ITP成年患者相比,研究组患者的ORR较高,并且差异有统计学意义(15.1%比65.1%,RR=4.18,95%CI:3.03~5.78,P<0.001)。艾曲波帕治疗ITP成年患者期间其他ITP治疗药物减低剂量或停药发生率为47%(95%CI:39%~56%)。②研究组与对照组患者的总不良反应(69.1%比67.4%)、严重不良反应发生率(8.9%比8.8%)分别比较,差异均无统计学意义(RR=1.01,95%CI:0.85~1.21,P=0.90;RR=0.93,95%CI:0.56~1.55,P=0.79)。研究组患者出血事件发生率低于对照组,并且差异有统计学意义(50.6%比65.3%,RR=0.79,95%CI:0.70~0.89,P<0.01)。
艾曲波帕治疗ITP成年患者总有效率较高,并且安全性较好,患者出血风险较低。对于接受艾曲波帕治疗的ITP成年患者,可减少其其他ITP药物治疗剂量。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
免疫性血小板减少症(immune thrombocytopenia, ITP)是一种由多种原因引起自身免疫功能紊乱,进而造成血小板过度破坏和生成不足的自身免疫性出血性疾病,约占出血性疾病的1/3[1]。ITP发病机制主要包括血小板膜糖蛋白相关的特异性自身抗体所介导的体液及细胞免疫途径失衡。免疫失衡亦造成骨髓巨核细胞成熟障碍及造血微环境异常。ITP的治疗目标为恢复血小板计数>50×109/L或者消除出血症状[1]。目前,ITP的一线治疗药物为糖皮质激素及静脉注射免疫球蛋白(intravenous immunoglobulin,IVIG)。其他ITP治疗方案包括重组人血小板生成素(recombinant human thrombopoietin,rhTPO),利妥昔单抗,以及脾切除术。但是,上述治疗方案均受到药物相关不良反应等多种因素的限制,大部分ITP患者难以耐受。此外,治疗ITP的新型药物,如全反式维A酸、小剂量地西他滨等的疗效证据尚不充足。艾曲波帕(eltrombopag)是近年来研发上市的第2代血小板生成素受体激动剂(thrombopoietin receptor agonists,TPO-RA)。艾曲波帕的主要药理机制是作用于血小板生成素(thrombopoietin, TPO)受体跨膜区第499位组氨酸,并激活TPO受体相关的信号通路,促进骨髓巨核细胞的增殖及分化[2,3]。近年来,艾曲波帕的新作用机制被陆续发现,如调节Fc受体亚型的比例,提高可溶性细胞毒性T淋巴细胞相关抗原(soluble cytotoxic T-lymphocyte-associated antigen, sCTLA)-4及转化生长因子(transforming growth factor,TGF)-β1水平[4,5,6]。并且艾曲波帕可口服给药,给药方便。艾曲波帕于2008年经美国食品与药品监督管理局(Food and Drug Administration,FDA)批准在美国上市,用于治疗ITP。该药也于2019年经国家药品监督管理局(National Medical Products Administration,NMPA)批准在我国上市。目前,有关艾曲波帕在中国人群中应用的临床观察及研究,特别是艾曲波帕长期使用的有效性及安全性报道不多。而临床开始关注ITP成年患者长期应用艾曲波帕的有效性及安全性。因此,本研究旨在应用系统评价的方法分析艾曲波帕治疗ITP成年患者的有效性及安全性,从而为临床提供更可靠的证据。现将研究结果报道如下。
根据本研究设定的文献检索策略(检索范围、关键词、检索时间),采取计算机检索包含艾曲波帕治疗ITP成年患者的随机对照试验(randomized controlled trial,RCT)及单臂临床试验文献。最终选择符合本研究纳入标准的文献为研究对象。
本研究的纳入标准包括以下4个方面。①研究内容:艾曲波帕治疗ITP成年患者的临床研究;②研究类型:RCT及单臂临床试验,无论是否为前瞻性研究、是否采用盲法、有无退出及失访;③受试对象:年龄≥18岁的ITP患者;④干预措施:RCT中,研究组采用口服艾曲波帕治疗,对照组采用安慰剂治疗;单臂临床试验中,患者接受口服艾曲波帕治疗。
本研究纳入文献的排除标准包括以下4个方面。①研究对象为特定人群,如老年患者、儿童患者、合并妊娠患者等;②无法获得研究原始资料数据;③研究原始资料数据不完整,研究设计不严谨;④重复发表的文献。
本研究采用的艾曲波帕治疗ITP成年患者结局评价指标如下。有效性指标如下。①总反应率(overall response rate, ORR):接受艾曲波帕治疗后,血小板计数≥50×109/L患者例数占总患者例数的百分比;②其他ITP治疗药物减低剂量或停药发生率:治疗结束时,减少或者停用其他ITP药物的患者占接受艾曲波帕治疗患者的百分比。安全性指标如下。①总不良反应发生率:接受艾曲波帕治疗后,出现恶心、肌肉酸痛、呕吐及肝功能异常等患者占接受艾曲波帕治疗患者的百分比;②严重不良反应率:接受艾曲波帕治疗后,发生血栓等患者占接受艾曲波帕治疗患者的百分比;③出血事件发生率:接受艾曲波帕治疗后,有出血症状患者占接受艾曲波帕治疗患者的百分比。
计算机检索国内、外已发表的艾曲波帕治疗ITP成年患者的临床研究文献。检索数据库包括:PubMed、Embase、Cochrane图书馆等英文数据库,以及万方数据知识服务平台,维普中文科技期刊数据库,中国知网(China National Knowledge Infrastructure,CNKI)及中国生物医学文献数据库(Chinese Biomedical Literature Datebase,CBM)等中文数据库。检索时间设定为以上数据库建库至2020年10月30日,文献语种为中文和英文。英文检索词包括:"ITP""revolade""idiopathic thrombocytopenic purpura""idiopathic thrombocytopenic purpuras""purpura, thrombocytopenic, autoimmune""SB-497 115""promacta"及"eltrombopag"。中文检索词包括:"原发免疫性血小板减少症""特发性血小板减少性紫癜""ITP""艾曲波帕"及"艾曲泊帕"。通过检索期刊全文数据库或直接与文献作者联系获取原文。
由2位血液科专业ITP研究方向研究生按照本研究制定的检索策略分别独立进行文献检索、浏览文献文题、摘要及全文内容,参照文献纳入与排除标准,判断文献是否被纳入分析,并按照预先设计的表格提取、填写数据。在文献筛选过程中,若2位研究者出现意见分歧,则通过讨论或者由第3位ITP研究方向副高级以上职称研究者裁定。对文献中缺乏的重要信息,通过电话或邮件与文献作者联系予以补充完整。制定表格并从文献资料中提取以下内容:①总纳入研究文献的一般资料:文题、作者姓名、发表日期、研究机构、文献来源;②研究特征:包括研究对象的一般情况、研究组与对照组的患者例数、研究组与对照组所用药物剂量、治疗时间、失访和退出情况;③结局指标:有效性指标为ORR和其他ITP治疗药物减低剂量或停药发生率;安全性指标为不良反应发生率、严重不良反应发生率、出血时间发生率。文献质量评价依据改良Jadad评分量表及非随机对照研究方法学指数(methodological index for non-randomized studies,MINORS)评分标准,2位研究者对所有纳入研究的文献进行方法学质量评价。改良Jadad得分为0~7分,其中1~3分为低质量,4~7分为高质量文献;MINORS得分为0~24分,其中0~12分为低质量,13~18分为中等质量,19~24分为高质量文献。文献质量评价由2位研究者独立进行,如遇分歧通过讨论或者由第3位研究者协助解决。
采用RevMan 5.3软件进行Meta分析。纳入研究间异质性采用χ2检验进行分析,同时结合I2定量判断异质性的大小。若纳入研究间存在统计学异质性,采用随机效应模型进行Meta分析,分析其异质性来源,对可能导致异质性的因素进行亚组分析及敏感性分析。反之,则采用固定效应模型分析。对于二分类资料,如ORR、不良反应发生率、严重不良反应发生率、其他ITP治疗药物减低剂量或停药发生率等,采用相对危险度(relative risk,RR)及其95%CI表示。采用Eggers检验估计发表偏倚。本研究所有统计学检验采用双侧检验,以P<0.05表示差异有统计学意义。
按照本研究设定的文献检索策略,最初检索得到艾曲波帕治疗ITP成年患者的相关文献450篇,其中171篇为中文文献,279篇为英文文献。通过阅读文献文题、摘要、全文,最终符合本研究文献纳入、排除标准的文献共计10篇文献。其中,包括8篇英文文献,2篇中文文献。本研究文献检索与筛选流程及结果,见图1。
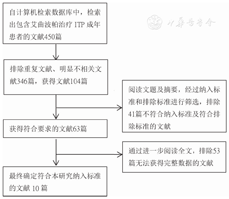

注:ITP为免疫性血小板减少症
本研究纳入的10篇文献,报道7项RCT,3项单臂临床试验;涉及872例ITP成年患者,其中研究组为663例,对照组为209例。根据改良Jadad评分量表评分标准,对纳入的7篇RCT文献[7,8,9,10,11,12,13]进行质量评价的结果显示,7项研究均为高质量研究,均被纳入Meta分析。根据MINORS评分标准,对纳入的3篇单臂临床试验文献[14,15,16]进行质量评价的结果显示,3项研究均为中等质量研究,但由于相关文献报道较少,因此均被纳入Meta分析。本研究纳入文献的基本特征与质量评价,见表1,表2。
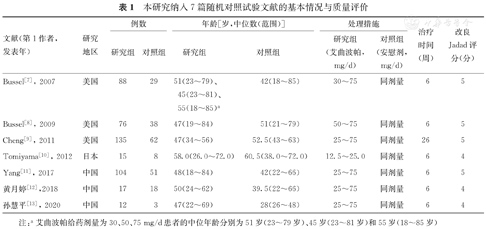
本研究纳入7篇随机对照试验文献的基本情况与质量评价
本研究纳入7篇随机对照试验文献的基本情况与质量评价
| 文献(第1作者,发表年) | 研究地区 | 例数 | 年龄[岁,中位数(范围)] | 处理措施 | 治疗时间(周) | 改良Jadad评分(分) | |||
|---|---|---|---|---|---|---|---|---|---|
| 研究组 | 对照组 | 研究组 | 对照组 | 研究组(艾曲波帕,mg/d) | 对照组(安慰剂,mg/d) | ||||
| Bussel[7], 2007 | 美国 | 88 | 29 | 51(23~79)、45(23~81)、55(18~85)a | 42(18~85) | 30~75 | 同剂量 | 6 | 5 |
| Bussel[8], 2009 | 美国 | 76 | 38 | 47(19~84) | 51(21~79) | 50~75 | 同剂量 | 6 | 5 |
| Cheng[9], 2011 | 美国 | 135 | 62 | 47(34~56) | 52.5(43~63) | 25~75 | 同剂量 | 26 | 5 |
| Tomiyama[10], 2012 | 日本 | 15 | 8 | 58.0(26.0~72.0) | 60.5(38.0~72.0) | 12.5~25.0 | 同剂量 | 6 | 4 |
| Yang[11], 2017 | 中国 | 104 | 51 | 48(18~84) | 42(22~66) | 25~75 | 同剂量 | 6 | 5 |
| 黄月婷[12],2018 | 中国 | 17 | 18 | 50(24~62) | 39.5(22~66) | 25~75 | 同剂量 | 6 | 4 |
| 孙慧平[13], 2020 | 中国 | 12 | 3 | 47(22~69) | 28(26~48) | 25~75 | 同剂量 | 6 | 4 |
注:a艾曲波帕给药剂量为30、50、75 mg/d患者的中位年龄分别为51岁(23~79岁)、45岁(23~81岁)和55岁(18~85岁)
本研究纳入的7项RCT文献[7,8,9,10,11,12,13]报道艾曲波帕治疗ITP成年患者的ORR,涉及643例患者,其中研究组为438例,对照组为205例。对这7项研究进行异质性检验结果显示,各项研究间不存在异质性(P=0.38,I2=6%),采用固定效应模型对ORR进行分析。与对照组相比,研究组ITP成年患者的ORR较高,并且差异有统计学意义(15.1%比65.1%,RR=4.18,95%CI:3.03~5.78,P<0.001)。2组患者ORR的Meta分析结果,见图2。这7篇文献的Eggers检验结果显示,无发表偏倚(t=1.97,P=0.106)。
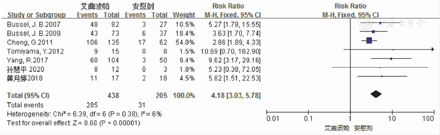

注:ITP为免疫性血小板减少症,ORR为总有效率
本研究纳入的6篇临床研究文献[9,10,13,14,15,16]报道艾曲波帕治疗ITP成年患者期间其他药物减低剂量或停药的发生率,其中5篇为单臂试验研究,1篇为RCT研究,涉及248例患者。对这6项研究进行异质性检验结果显示,不同研究间存在异质性(P=0.08,I2=49.0%),因此采用随机效应模型对其他ITP治疗药物减低剂量或停药发生率进行分析。Meta分析结果显示,艾曲波帕治疗ITP成年患者期间其他药物减低剂量或停药发生率为47%(95%CI:39%~56%)。艾曲波帕治疗ITP成年患者期间其他药物减低剂量或停药发生率的Meta分析结果,见图3。这6篇文献的Eggers检验结果显示,无发表偏倚(t=-0.21,P=0.845)。
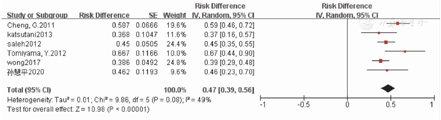

注:ITP为免疫性血小板减少症
6篇RCT文献[7,8,9,10,11,13]报道艾曲波帕治疗ITP的总不良反应,涉及患者617例。其中研究组为430例,对照组为187例。对这6项研究进行异质性检验结果显示,各项研究间存在异质性(P=0.08,I2=49%),因此采用随机效应模型对不良反应率进行分析。Meta分析结果显示,研究组与对照组患者的总不良反应发生率相比,差异无统计学意义(69.1%比67.4%,RR=1.01,95%CI:0.85~1.21,P=0.90)。2组患者不良反应发生率的Meta分析结果,见图4。这6篇文献的Eggers检验结果显示,无发表偏倚(t=1.99, P=0.321)。
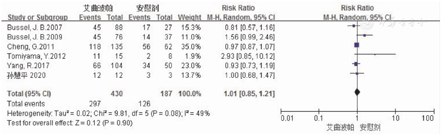

注:ITP为免疫性血小板减少症
本研究纳入的7篇RCT文献[7,8,9,10,11,12,13]报道艾曲波帕治疗ITP成年患者的严重不良反应率,涉及652例患者,其中研究组为447例,对照组为205例。对这7项研究进行异质性检验结果显示,各项研究间不存在异质性(P=0.78,I2=0),因此采用固定效应模型对严重不良反应率进行分析。Meta分析结果显示,研究组与对照组患者严重不良反应发生率相比,差异无统计学意义(8.9%比8.8%,RR=0.93,95%CI:0.56~1.55,P=0.79)。2组患者不良反应发生率的Meta分析结果,见图5。这7篇文献的Eggers检验结果显示,无发表偏倚(t=0.07,P=0.945)。
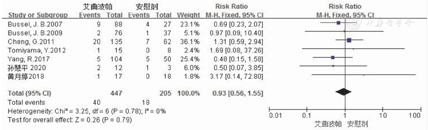

注:ITP为免疫性血小板减少症
本研究纳入的4项RCT文献[7,8,9,12]报道艾曲波帕治疗ITP患者的出血事件发生率,涉及460例患者,其中研究组为316例,对照组为144例。对这4项研究进行异质性检验结果显示,各项研究间不存在异质性(P=0.22,I2=33%),因此采用固定效应模型对出血事件发生率进行分析。Meta分析结果显示,研究组患者出血事件发生率低于对照组,并且差异有统计学意义(50.6%比65.3%,RR=0.79,95%CI:0.70~0.89,P<0.01)。2组患者出血事件发生率的Meta分析结果,见图6。这4项研究Eggers检验结果显示,无发表偏倚(t=-2.98,P=0.097)。
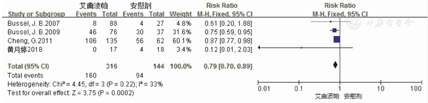

注:ITP为免疫性血小板减少症
目前,ITP的一线治疗药物中,糖皮质激素与IVIG的主要机制为调节失衡的免疫反应。糖皮质激素的使用可导致多种不良反应,如继发性糖尿病、骨质疏松、感染风险增加等,且长期应用糖皮质激素的ITP患者疾病缓解率较低,为10%~30%,疗效难以持续[1]。大剂量IVIG治疗ITP,短期疗效明显,但是治疗费用高,并且停药后疗效难以维持,患者血小板计数在停药后3~4周内降至治疗前水平[1]。其他ITP治疗方案包括rhTPO、利妥昔单抗及脾切除术。长期应用rhTPO可导致相关抗体产生。约50%接受利妥昔单抗治疗的患者可发生畏寒、发热等不良反应,其中约10%患者发生低血压及支气管痉挛等不良反应。接受脾切除术的患者术后则面临血栓及感染风险增加的问题[1]。此外,治疗ITP的新型药物,如全反式维A酸、小剂量地西他滨等的疗效证据尚不充足。因此,由于药物相关不良反应等多种因素的限制,大部分ITP患者难以耐受长期应用有不良反应的药物控制病情。新型口服药物艾曲波帕因其较好的疗效、较少的不良反应使ITP患者长期服药成为可能。虽然艾曲波帕作用机制与TPO不同,但是体外实验发现TPO与艾曲波帕共同培养的巨核细胞增殖更为显著,且艾曲波帕发挥作用依赖于TPO与其受体的结合[2,3]。艾曲波帕的免疫调节机制可使长期口服该药物的ITP患者获得较好的疗效。并且由于艾曲波帕为小分子非肽类物质,可以通过消化道壁进入血液循环,相较于需静脉给药的罗米司亭(romiplostim)及我国《成人原发免疫性血小板减少症诊断与治疗中国指南(2020年版)》[1]中推荐的其他ITP治疗药物,给药方便。本研究纳入的10篇艾曲波帕治疗ITP成年患者的临床研究文献经相关质量工具评价结果显示,RCT文献总体研究质量较高,单臂临床试验质量中等。本研究观察指标包括ORR、其他ITP治疗药物减低剂量或停药发生率、总不良反应发生率、严重不良反应发生率、出血事件发生率。除其他ITP治疗药物减低剂量或停药发生率外,其余观察指标数据皆来源于双盲、安慰剂对照的RCT。
本研究纳入患者均为慢性非妊娠的ITP成年患者。Meta分析结果显示,ITP患者接受艾曲波帕的ORR达65.1%,优于接受安慰剂者的15.1%(RR=4.18,95%CI:3.03~5.78,P<0.01)。但是纳入研究患者部分合并使用其他治疗ITP的药物,因此艾曲波帕单药治疗和艾曲波帕联合其他ITP治疗药物治疗不同类型ITP患者的总有效率还需要更多研究探索。
本研究中,其他ITP治疗药物减低剂量或停药发生率有关数据均来源于艾曲波帕长期用药(>6个月)的临床研究。艾曲波帕治疗ITP成年患者期间其他ITP治疗药物减低剂量或停药发生率为47%(95%CI:39%~56%)。本研究纳入RCT中,Tomiyama等[10]进行的研究为由第1阶段艾曲波帕疗效及安全性RCT的拓展研究,对于研究设计的描述存在不足(文献中没有说明试验预估样本量等),并且其他ITP治疗药物减低剂量或停药发生率的研究多为非RCT。因此,本研究中其他ITP治疗药物减低剂量或停药发生率可能存在偏倚。近年来,临床研究结果显示,约30%的ITP成年患者在长期口服艾曲波帕后,即使停止口服艾曲波帕,也可以获得持续缓解[17,18,19]。艾曲泊帕停药后能否实现疾病持续缓解与白细胞介素(interleukin,IL)-10、-4,肿瘤坏死因子(tumor necrosis factor,TNF)-α和骨桥蛋白水平有一定相关性[20]。
本研究结果显示,接受艾曲波帕与安慰剂治疗ITP患者的总不良反应发生率、严重不良反应发生率分别比较,差异均无统计学意义(总不良反应发生率:69.1%比67.4%,RR=1.01,95%CI:0.85~1.21,P=0.90;严重不良反应发生率:8.9%比8.8%,RR=0.93,95%CI:0.56~1.55,P=0.79)。这提示,艾曲波帕治疗ITP患者具有较高的安全性。虽然研究中部分患者合并使用其他ITP治疗药物,这可能影响对不良反应的观察,但是在艾曲波帕治疗如丙型肝炎肝硬化引起血小板减少和再生障碍性贫血等其他原因造成的血小板减少症研究中,亦观察到常见治疗相关不良反应[21,22,23],本研究中艾曲波帕治疗成年人ITP的总不良反应发生率、严重不良反应发生率等安全性指标与既往文献报道相一致[24,25]。
本研究中,仅有4篇文献包含接受艾曲波帕的ITP成年患者出血事件发生率相关数据。结果显示,接受艾曲波帕治疗的ITP患者出血事件发生率低于接受安慰剂治疗者,并且差异有统计学意义(50.6%比65.3%,RR=0.79,95%CI:0.70~0.89,P<0.01)。由于纳入研究的ITP成年患者较少,结果可能存在偏倚。一项纳入5篇RCT文献、261例ITP患儿的Meta分析结果提示,虽然罗米司亭和艾曲波帕在治疗ITP患儿时疗效相近,但是艾曲泊帕在降低患儿全部出血症状(出血评分等级1~4级)(RR=0.43,95%CI:0.23~0.80,P<0.05),以及临床明显的出血症状(出血评分等级2~4级)(RR=0.33, 95%CI:0.12~0.89, P<0.05)上较罗米司亭展现出优势[26]。但是另一项Meta分析结果显示,尚不能认为艾曲泊帕和罗米司亭治疗ITP成年患者的疗效不同(全部出血症状:RR=1.15,95%CI:0.52~2.57,P=0.72;临床明显的出血症状:RR=1.09,95%CI: 0.37~3.20,P=0.87)[27]。艾曲波帕治疗儿童ITP或是较为理想的选择,但是其治疗ITP成年患者的疗效及安全性是否优于其他治疗药物有待进一步研究证实。
Johanna等[28]进行的RCT结果显示,安慰剂患者与口服艾曲波帕的ITP患者的体外血小板功能无明显差异,但是患者血栓发生风险与血小板计数呈正相关关系。而血栓是艾曲波帕治疗ITP成年患者的严重不良反应之一。其他相关不良反应的研究,如骨髓网状蛋白和胶原沉积与艾曲波帕的关系,近年相关研究较少。Russell等[29]进行了一项为期2年的开放标签单臂临床试验,未发现骨髓网状蛋白和胶原沉积与艾曲波帕应用的相关性。但是尚待大样本、多中心、高质量临床研究对艾曲波帕治疗成年人ITP相关血栓形成、骨髓纤维化、白内障发生风险等进行评估。
本研究存在一定的局限性。首先,纳入的部分文献的样本量较小,可能存在偏倚。同时,艾曲波帕的相关不良反应发生率低,在样本量不足的情况下得到的结果可能与真实情况存在偏差;其次,纳入文献治疗时间不同,不能很好反映研究组与对照组之间的差异,可能造成研究结果和实际存在偏差;此外,纳入研究的时间跨度长,2007-2020年间药物应用方法的改进等可能造成各研究间差异。
近年关于阿伐曲波帕(avatrombopag)治疗ITP的临床研究被陆续报道。相较于艾曲波帕,阿伐曲波帕不需要空腹口服,目前未见肝不良反应的文献报道,较为常见的不良反应为头痛,并且血栓形成风险更低[30,31]。在慢性肝病相关血小板减少症患者的临床药物试验中,阿伐曲波帕没有增加患者体内活化的血小板数目和体外血小板的反应性[32]。国内目前可选择的第2代TPO-RA较少,而艾曲波帕临床效果明显,可长期服用。本研究为临床医师对于ITP成年患者的治疗决策选择提供一定依据。
所有作者均声明不存在利益冲突




























