
探讨血清8-羟基脱氧鸟苷(8-OHdG)对脓毒症患者病情进展及预后预测的作用。
采用前瞻性观察性研究方法。2015年4月—2016年7月,温州医科大学附属第一医院急诊科收治124例符合入选标准的脓毒症患者,其中男79例、女45例,年龄(62±15)岁。计算所有患者入院第2天及入院时脓毒症相关性器官功能衰竭评价(SOFA)评分及二者的差值ΔSOFA评分,并将患者分为ΔSOFA评分<2分的非进展组(101例)和ΔSOFA评分≥2分的进展组(23例)。根据患者住院期间存活情况将患者分为生存组(85例)和死亡组(39例)。分别比较非进展组与进展组及生存组与死亡组患者性别、年龄、住急诊重症监护病房(ICU)天数、是否吸烟、有无高血压、有无糖尿病,入院时血清白细胞计数、C反应蛋白及降钙素原,入院24 h内血清8-OHdG。采用多因素logistic回归分析筛选124例脓毒症患者病情进展和住院期间死亡的独立危险因素并根据独立危险因素,绘制受试者操作特征(ROC)曲线,计算曲线下面积(AUC)和最佳阈值及最佳阈值下的敏感度、特异度。根据住院期间死亡ROC曲线中的最佳阈值将患者分为高8-OHdG组(35例)和低8-OHdG组(89例),比较2组患者性别、年龄、入院时SOFA评分、入院第2天SOFA评分和ΔSOFA评分,采用Kaplan-Meier法分析2组患者入院90 d内存活率差异。对数据行独立样本t检验、Mann-Whitney U检验、χ2检验、Log-rank检验。
非进展组和进展组患者性别、年龄、住急诊ICU天数、吸烟情况、合并高血压情况、合并糖尿病情况及入院时血清白细胞计数、C反应蛋白、降钙素原均相近(P>0.05)。进展组患者入院24 h内血清8-OHdG水平明显高于非进展组(Z=-2.31,P<0.05)。多因素logistic回归分析显示,入院24 h内血清8-OHdG为124例脓毒症患者病情进展的独立危险因素(比值比=1.06,95%置信区间为1.01~1.11,P<0.05)。入院24 h内血清8-OHdG预测124例脓毒症患者住院期间病情进展的ROC的AUC为0.65(95%置信区间为0.52~0.79,P<0.05),最佳阈值为32.88 ng/mL,最佳阈值下的敏感度、特异度分别为52.2%、79.2%。生存组和死亡组患者性别、年龄、住急诊ICU天数、吸烟情况、合并高血压情况、合并糖尿病情况及入院时血清白细胞计数、C反应蛋白和降钙素原均相近(P>0.05)。死亡组患者入院24 h内血清8-OHdG水平明显高于存活组(Z=-2.37,P<0.05)。多因素logistic回归分析显示,入院24 h内血清8-OHdG为124例脓毒症患者住院期间死亡的独立危险因素(比值比=1.04,95%置信区间为1.00~1.09,P<0.05)。入院24 h内血清8-OHdG水平预测124例脓毒症患者住院期间死亡的ROC的AUC为0.63(95%置信区间为0.52~0.75,P<0.05),最佳阈值为32.43 ng/mL,最佳阈值下的敏感度、特异度分别为51.3%、84.7%。高8-OHdG组与低8-OHdG组患者性别和年龄均相近(P>0.05),高8-OHdG组患者入院时SOFA评分、入院第2天SOFA评分、ΔSOFA评分均明显高于低8-OHdG组(Z值分别为-2.49、-3.01、-2.64,P<0.05或P<0.01)。低8-OHdG组患者入院90 d内存活率明显高于高8-OHdG组(χ2=14.57,P<0.01)。
早期血清8-OHdG水平是脓毒症患者病情进展及预后的独立危险因素,预测患者病情进展及预后的能力有限。患者血清8-OHdG水平越高,入院90 d内死亡风险越大。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脓毒症是指宿主对感染的反应失调所产生的危及生命的器官功能损伤。脓毒症进一步发展可导致脓毒性休克、MOF,最终导致死亡[1]。在全球范围内,每年仍约有530万人死于脓毒症,脓毒症目前仍是危重病临床救治的重点和难点[2]。关于脓毒症病理生理学机制的研究表明,脓毒症状态下机体活性氮产生过多,且清除能力下降,引起氧化应激,一方面直接引起组织细胞和器官损伤,另一方面可加剧炎症反应和免疫麻痹,是脓毒症预后不良的重要原因[3, 4, 5, 6]。鉴于此,近期包括应用维生素C在内的抗氧化治疗越发受到重视,但其临床效用仍有争议[7]。究其原因,关键是对脓毒症机体,特别是细胞内氧化损伤的认识和评估尚存不足。
8-羟基脱氧鸟苷(8-OHdG)是氧自由基攻击人DNA中鸟嘌呤碱基第8位碳原子后,由DNA内切酶切除损伤的碱基后所产生[8, 9]。8-OHdG形成后在人体内不会被进一步代谢,并能在血液、尿液中被检测到,是细胞内DNA氧化损伤的重要标志物[10, 11]。目前,8-OHdG在职业暴露、肿瘤、心血管疾病、神经退行性疾病中已被用于评估氧化状态和预后[12, 13, 14, 15]。本研究在检测脓毒症患者血清8-OHdG水平基础上,分析其在预测脓毒症患者病情进展和预后中的作用,以期为脓毒症患者的氧化损伤评估和抗氧化治疗提供依据。
本研究为前瞻性观察性研究,经温州医科大学附属第一医院伦理委员会批准(批号:2014066),患者本人或其直系亲属签署知情同意书。
纳入标准:(1)年龄>18岁且<90岁;(2)住院时间>24 h;(3)符合脓毒症3.0诊断标准[16]。排除标准:患有严重影响8-OHdG结果的疾病,如肿瘤、肝硬化、慢性心衰、终末期肾病、神经退行性疾病及长期免疫治疗者[17, 18]。
2015年4月—2016年7月温州医科大学附属第一医院急诊ICU收治124例符合入选标准的脓毒症患者,其中男79例、女45例,年龄(62±15)岁,吸烟者32例,既往合并高血压62例、糖尿病38例,肺部感染24例、胃肠道感染34例、泌尿道感染23例、颅内感染6例、皮肤软组织感染19例、其他感染(包括感染灶不明者)18例。计算所有患者入院第2天及入院时脓毒症相关性器官功能衰竭评价(SOFA)评分及二者的差值ΔSOFA评分,并根据ΔSOFA评分进行分组,ΔSOFA评分<2分为非进展组(101例),ΔSOFA评分≥2分为进展组(23例)[19, 20]。根据患者住院期间存活情况,将患者分为生存组(85例)和死亡组(39例)。
记录生存组、死亡组及进展组、非进展组患者以下临床资料:(1)一般资料,包括性别、年龄、住急诊ICU天数、是否吸烟、有无高血压、有无糖尿病;(2)生化指标,包括入院时血清白细胞计数、C反应蛋白及降钙素原,正常范围分别为(3.5~9.5)×109/L、1.04~1.55 mmol/L、0~0.5 ng/mL。
于患者入院24 h内抽取静脉血2 mL于乙二胺四乙酸抗凝管内,2 h内在离心机中以2 400×g离心5 min后取上清液,ELISA法测定血清8-OHdG水平(正常范围为0.94~60.00 ng/mL),操作步骤严格按照试剂盒(英国Abcam公司)说明书进行。
采用SPSS 23.0统计软件进行数据分析。计量资料数据中符合正态分布和方差齐性者以表示,采用独立样本t检验;不符合正态分布及方差齐性者,以M(Q1,Q3)表示,采用Mann-Whitney U检验。计数资料以频数(百分比)表示,采用χ2检验。采用多因素logistic回归分析进一步分析组间有明显差异的指标对病情进展及住院期间死亡的影响。对病情进展及住院期间死亡的预测效果采用受试者操作特征(ROC)曲线分析,计算曲线下面积(AUC)最佳阈值及最佳阀值下的敏感度、特异度。根据住院期间死亡的ROC曲线中的最佳阈值将患者分为高8-OHdG组和低8-OHdG组,根据数据情况采用前述统计方法比较2组患者性别、年龄、入院时SOFA评分、入院第2天SOFA评分和ΔSOFA评分;采用Kaplan-Meier法分析2组患者入院90 d内存活率差异,对数据行Log-rank检验。P<0.05为差异有统计学意义。
非进展组和进展组患者性别、年龄、住急诊ICU天数、吸烟情况、合并高血压情况、合并糖尿病情况及入院时血清白细胞计数、C反应蛋白、降钙素原均相近(P>0.05)。进展组患者入院24 h内血清8-OHdG水平明显高于非进展组(P<0.05)。见表1。
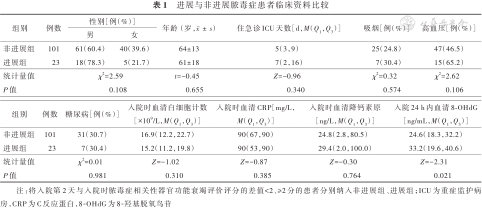
进展与非进展脓毒症患者临床资料比较
进展与非进展脓毒症患者临床资料比较
| 组别 | 例数 | 性别[例(%)] | 年龄(岁,) | 住急诊ICU天数[d,M(Q1,Q3)] | 吸烟[例(%)] | 高血压[例(%)] | |
|---|---|---|---|---|---|---|---|
| 男 | 女 | ||||||
| 非进展组 | 101 | 61(60.4) | 40(39.6) | 64±13 | 5(3,9) | 25(24.8) | 47(46.5) |
| 进展组 | 23 | 18(78.3) | 5(21.7) | 61±18 | 7(2,16) | 7(30.4) | 15(65.2) |
| 统计量值 | χ2=2.59 | t=-0.45 | Z=-0.96 | χ2=0.32 | χ2=2.62 | ||
| P值 | 0.108 | 0.655 | 0.340 | 0.574 | 0.106 | ||
| 组别 | 例数 | 糖尿病[例(%)] | 入院时血清白细胞计数[×109/L,M(Q1,Q3)] | 入院时血清CRP[mg/L,M(Q1,Q3)] | 入院时血清降钙素原[ng/L,M(Q1,Q3)] | 入院24 h内血清8-OHdG[ng/mL,M(Q1,Q3)] |
|---|---|---|---|---|---|---|
| 非进展组 | 101 | 31(30.7) | 16.9(12.2,22.7) | 90(67,90) | 24.8(2.8,80.5) | 24.6(18.3,32.2) |
| 进展组 | 23 | 7(30.4) | 15.2(11.2,19.8) | 90(53,90) | 29.4(2.0,100.0) | 33.2(19.6,40.6) |
| 统计量值 | χ2=0.01 | Z=-1.02 | Z=-0.87 | Z=-0.30 | Z=-2.31 | |
| P值 | 0.981 | 0.310 | 0.385 | 0.764 | 0.021 |
注:将入院第2天与入院时脓毒症相关性器官功能衰竭评价评分的差值<2、≥2分的患者分别纳入非进展组、进展组;ICU为重症监护病房,CRP为C反应蛋白,8-OHdG为8-羟基脱氧鸟苷
多因素logistic回归分析显示,入院24 h内血清8-OHdG为脓毒症患者病情进展的独立危险因素(β=0.06,Wald=5.40,比值比=1.06,95%置信区间为1.01~1.11,P=0.020)。
入院24 h内血清8-OHdG预测124例脓毒症患者住院期间病情进展的ROC的AUC为0.65(95%置信区间为0.52~0.79,P=0.021),最佳阈值为32.88 ng/mL,最佳阈值下的敏感度、特异度分别为52.2%、79.2%。见图1。
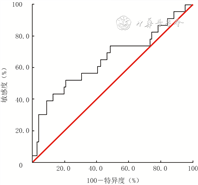

注:图中直线为参考线,曲线为入院24 h内血清8-羟基脱氧鸟苷(8-OHdG)水平
生存组和死亡组患者性别、年龄、住急诊ICU天数、吸烟情况、合并高血压情况、合并糖尿病情况及入院时血清白细胞计数、C反应蛋白和降钙素原均相近(P>0.05)。死亡组患者入院24 h内血清8-OHdG水平明显高于生存组(P<0.05)。见表2。
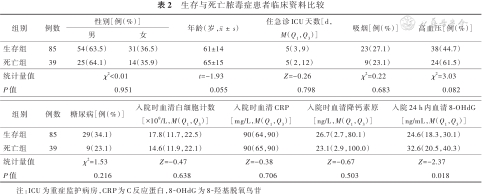
生存与死亡脓毒症患者临床资料比较
生存与死亡脓毒症患者临床资料比较
| 组别 | 例数 | 性别[例(%)] | 年龄(岁,) | 住急诊ICU天数[d,M(Q1,Q3)] | 吸烟[例(%)] | 高血压[例(%)] | |
|---|---|---|---|---|---|---|---|
| 男 | 女 | ||||||
| 生存组 | 85 | 54(63.5) | 31(36.5) | 61±14 | 5(3,9) | 23(27.1) | 38(44.7) |
| 死亡组 | 39 | 25(64.1) | 14(35.9) | 65±15 | 5(2,12) | 9(23.1) | 24(61.5) |
| 统计量值 | χ2<0.01 | t=-1.93 | Z=-0.26 | χ2=0.22 | χ2=3.03 | ||
| P值 | 0.951 | 0.055 | 0.798 | 0.683 | 0.082 | ||
| 组别 | 例数 | 糖尿病[例(%)] | 入院时血清白细胞计数[×109/L,M(Q1,Q3)] | 入院时血清CRP[mg/L,M(Q1,Q3)] | 入院时血清降钙素原[ng/L,M(Q1,Q3)] | 入院24 h内血清8-OHdG[ng/mL,M(Q1,Q3)] |
|---|---|---|---|---|---|---|
| 生存组 | 85 | 29(34.1) | 17.8(11.7,22.5) | 90(64,90) | 26.7(2.7,80.1) | 24.6(18.3,30.1) |
| 死亡组 | 39 | 9(23.1) | 14.6(11.9,22.1) | 90(65,90) | 23.1(2.9,100.0) | 32.6(20.5,40.3) |
| 统计量值 | χ2=1.53 | Z=-0.47 | Z=-0.38 | Z=-0.67 | Z=-2.37 | |
| P值 | 0.216 | 0.638 | 0.706 | 0.503 | 0.018 |
注:ICU为重症监护病房,CRP为C反应蛋白,8-OHdG为8-羟基脱氧鸟苷
多因素logistic回归分析显示,入院24 h内血清8-OHdG为124例脓毒症患者住院期间死亡的独立危险因素(β=0.04,Wald=4.74,比值比=1.04,95%置信区间为1.00~1.09,P=0.030)。
入院24 h内血清8-OHdG水平预测124例脓毒症患者住院期间死亡的ROC的AUC为0.63(95%置信区间为0.52~0.75,P=0.018),最佳阈值为32.43 ng/mL,最佳阈值下的敏感度、特异度分别为51.3%、84.7%。见图2。
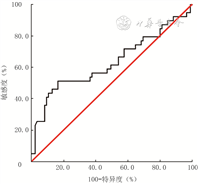

注:图中直线为参考线,曲线为入院24 h内血清8-羟基脱氧鸟苷(8-OHdG)水平
高8-OHdG组与低8-OHdG组患者性别和年龄相近(P>0.05),高8-OHdG组患者入院时SOFA评分、入院第2天SOFA评分、ΔSOFA评分均明显高于低8-OHdG组(P<0.05或P<0.01)。见表3。
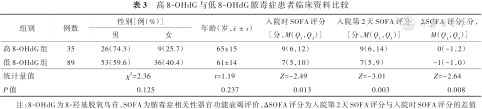
高8-OHdG与低8-OHdG脓毒症患者临床资料比较
高8-OHdG与低8-OHdG脓毒症患者临床资料比较
| 组别 | 例数 | 性别[例(%)] | 年龄(岁,) | 入院时SOFA评分[分,M(Q1,Q3)] | 入院第2天SOFA评分[分,M(Q1,Q3)] | ΔSOFA 评分[分,M(Q1,Q3)] | |
|---|---|---|---|---|---|---|---|
| 男 | 女 | ||||||
| 高8-OHdG组 | 35 | 26(74.3) | 9(25.7) | 65±15 | 9(6,12) | 9(6,14) | 0(-1,2) |
| 低8-OHdG组 | 89 | 53(59.6) | 36(40.4) | 61±14 | 7(5,10) | 7(5,9) | -1(-1,0) |
| 统计量值 | χ2=2.36 | t=1.19 | Z=-2.49 | Z=-3.01 | Z=-2.64 | ||
| P值 | 0.125 | 0.237 | 0.013 | 0.003 | 0.008 | ||
注:8-OHdG为8-羟基脱氧鸟苷,SOFA为脓毒症相关性器官功能衰竭评价,ΔSOFA评分为入院第2天SOFA评分与入院时SOFA评分的差值
低8-OHdG组患者入院90 d内存活率明显高于高8-OHdG组(χ2=14.57,P<0.001),见图3。
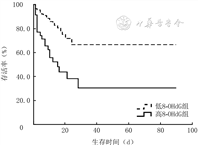

注:低8-羟基脱氧鸟苷(8-OHdG)组和高8-OHdG组患者例数分别为89、35例
氧化应激是指机体内环境改变导致活性氧和活性氮产生过多而不能有效清除,最终导致机体损伤[21]。脓毒症患者线粒体电子传递链损伤,中性粒细胞和巨噬细胞呼吸爆发,黄嘌呤/次黄嘌呤氧化酶活化等过程产生大量氧自由基,激活核因子κB等炎症信号通路,表达TNF-α、IL-6等多种炎症介质,参与炎症反应[22, 23, 24]。因此,氧化应激作为脓毒症发生的重要机制,与脓毒症病情严重程度及预后密切相关[25, 26]。脓毒症抗氧化治疗对部分患者有一定的疗效,有研究显示,脓毒症患者应用抗氧化剂后,氧自由基对蛋白质、脂质和DNA的损伤程度降低[27, 28]。近年也有研究探讨应用维生素C等抗氧化措施对脓毒症的治疗效果[29, 30]。
DNA对氧化损伤极为敏感。在人淋巴细胞中,过氧化氢作用于细胞1~6 h即可检测到DNA氧化损伤[31]。在动物实验中,将小牛胸腺DNA暴露于2-氨基丙烷产生的氧自由基缓冲液中1 h,8-OHdG水平即明显升高[32]。临床研究表明,8-OHdG作为DNA氧化损伤标志物在房颤的早期诊断、乳腺癌病情严重程度的预测及心血管疾病的预后预测中有广泛应用[13, 14, 15]。
预测脓毒症病情进展并开展针对性治疗,是改善脓毒症患者预后的重要措施。但迄今,用于脓毒症患者病情进展的早期预警标志物较鲜见。本研究显示,进展组患者入院24 h内血清8-OHdG水平明显高于非进展组,且入院24 h内血清8-OHdG为患者病情进展的独立危险因素。ROC曲线分析显示,入院24 h内血清8-OHdG预测124例脓毒症患者住院期间病情进展的AUC为0.65,这说明血清8-OHdG水平能对脓毒症患者病情进展有一定的预测作用。脓毒症患者体内广泛存在氧化应激、炎症反应、细胞凋亡和坏死[33]。研究表明,小鼠巨噬细胞在高糖作用后,细胞活性氧和活性氮水平升高,进而使血清8-OHdG水平明显升高,且与TNF-α、IL-1及趋化因子10的变化一致[34]。另外,在严重脓毒症或脓毒性休克患者中,随着血清8-OHdG水平的升高,细胞凋亡和坏死增加[35]。临床研究表明,与健康志愿者相比,慢性心力衰竭患者血清中8-OHdG含量明显增高,且心力衰竭越严重,8-OHdG含量越高[36]。也有研究显示,血清8-OHdG水平能预测慢性阻塞性肺疾病患者病情进展[37]。由此可见,细胞内氧化应激标志物血清8-OHdG与炎症反应、细胞凋亡和坏死密切相关,并能预测脓毒症病情进展。另外,血清8-OHdG也能预测社区获得性肺炎患者的预后[38]。有研究者检测脓毒症患者血清8-OHdG等DNA氧化损伤产物,结果表明,死亡组患者血清8-OHdG等DNA氧化损伤产物浓度明显高于存活组[39]。本研究结果显示,因脓毒症死亡的患者入院24 h内血清8-OHdG水平明显高于存活患者,且入院24 h内血清8-OHdG为患者住院期间死亡的独立危险因素。ROC曲线分析显示,入院24 h内血清8-OHdG预测124例脓毒症患者住院期间死亡的AUC为0.63,这说明入院血清8-OHdG水平能在一定程度上预测脓毒症患者预后。为进一步探讨入院早期血清8-OHdG水平对脓毒症患者入院90 d内存活率的预测作用,将患者分为高8-OHdG组和低8-OHdG组,结果显示高8-OHdG组入院时SOFA评分、入院第2天SOFA、ΔSOFA 评分均明显高于低8-OHdG组,入院90 d内存活率明显低于低8-OHdG组。这说明高8-OHdG组患者入院时病情更重,入院90 d内死亡风险更大。
本研究存在一定局限性:本研究为单中心的研究,患者数量相对较少,研究的结论有待多中心、大样本的临床研究进一步验证。另外,本研究的目的是探讨早期血清8-OHdG对脓毒症患者的预测价值,但未动态监测脓毒症患者血清8-OHdG水平,而动态监测可能有助于了解脓毒症不同阶段氧化损伤情况。
综上所述,血清8-OHdG作为细胞内氧化损伤标志物,能早期预测脓毒症患者病情进展及预后,早期血清8-OHdG较高患者入院90 d内死亡风险更大。但其在指导脓毒症抗氧化治疗中的作用值得进一步研究。
所有作者均声明不存在利益冲突



























