
分析组织学胃炎评价系统(OLGA)胃炎评价标准在胃癌前病变随访过程中的价值。
纳入2016年1至7月在嘉兴市第一医院行胃镜检查的患者682例,其中男352例,女330例,年龄(48.2±12.3)岁。采用组织学OLGA胃炎评价标准进行分组(Stage-0~Ⅳ),非萎缩性胃炎412例,萎缩性胃炎270例。比较5年随访过程中不同OLGA组间萎缩进展率/逆转率,上皮内瘤变检出率以及胃癌检出率的差异。
共有437例患者完成内镜随访,其中Stage-0组207例,Stage-Ⅰ组158例,Stage-Ⅱ组47例,Stage-Ⅲ组18例,Stage-Ⅳ组7例。共有24例发生萎缩进展,78例发生萎缩逆转,共检出5例上皮内瘤变及2例胃癌。伴随OLGA分组等级的升高萎缩进展率逐步升高(χ2=19.14,P<0.001);OLGA高危组萎缩逆转率明显低于低危组(χ2=4.96,P=0.026);OLGA高危组上皮内瘤变检出率以及胃癌检出率均明显高于低危组,(χ2=29.63、11.60,均P<0.05)。
组织学OLGA胃炎评价标准有助于实现胃癌前状态和癌前病变的风险分层评估。对OLGA高危组人群制定个体化的内镜/组织学随访方案存在其实际意义。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胃癌是全球发病率第5位、病死率第3位的恶性肿瘤[1],其预后与分期密切相关,早期胃癌术后5年生存率>95%,进展期胃癌则通常<30%[2]。因此,对高危人群定期进行个体化胃癌风险筛查评估是胃癌预防工作的重点。近年来,由国家消化系疾病临床医学研究中心牵头,先后制定了相应的早期胃癌筛查流程[3],进一步细化并确定适合我国国情的早期胃癌筛查方案。事实上,如何处理胃黏膜癌前状态以及癌前病变一直是早期胃癌筛查工作中的重点环节。基于此,最近由国家消化系疾病临床医学研究中心牵头制订了《中国胃黏膜癌前状态和癌前病变的处理策略专家共识》[4]。共识指出,胃黏膜萎缩和肠化生均属于癌前状态,胃上皮内瘤变属于癌前病变,二者均有胃癌发生风险,应对病灶进行定期内镜监测随访。与此同时,共识也认为判断萎缩性胃炎的严重程度建议采用胃炎评价系统(operative link on gastritis assessment,OLGA),而后者在2007年由国际胃炎萎缩工作小组首次提出,通过将胃炎萎缩程度与范围相结合,将胃黏膜萎缩分为0~Ⅳ期,以期较好地预测癌变风险[5]。
本研究根据OLGA胃炎评价系统将人群分层,旨在通过对纳入人群为期5年的内镜随访,评价OLGA胃炎评价系统在胃黏膜癌前状态及癌前病变风险评估中的价值。
2016年1至7月在嘉兴市第一医院行胃镜检查并取5处活组织行病理检查的患者纳入研究。
1. 入组标准:(1)年龄为30~75岁,男女不限;(2)愿意接受胃镜、内镜活组织病理(胃窦小弯、胃体小弯、胃角、胃体小弯、胃体大弯各1块)以及后续随访工作;(3)经患者及家属知情同意。
2. 排除标准:(1)胃镜检查前1个月内服用过H2受体拮抗剂、质子泵抑制剂等抑酸药;(2)本次内镜检查发现并病理检查最终确诊胃癌;(3)胃或十二指肠手术史;(4)一级亲属胃癌病史;(5)伴有严重心肺系统疾病。
3. 终止研究标准:(1)入组后发现不符合纳入标准;(2)发生严重不良事件,如内镜操作严重并发症;(3)主动要求退出研究。
本研究为病例随访研究,方案经嘉兴市第一医院伦理委员会审核批准(2016-095),入组患者均签署知情同意书。
指定3名医师进行内镜检查(内镜操作年限>10年)。行胃镜检查时于固定位置取5块活组织(胃窦小弯、胃窦大弯、胃角、胃体小弯、胃体大弯各1块),4%甲醛固定,常规石蜡包埋、切片,苏木精-伊红(hematoxylin-eosin staining,HE)染色,由固定2名病理科医师根据新悉尼系统进行诊断[6]。萎缩根据严重程度分为轻度、中度和重度:轻度为固有腺体数减少不超过原有腺体的1/3;中度为固有腺体数减少介于原有腺体的1/3~2/3;重度为固有腺体数减少超过2/3,仅残留少数腺体,甚至完全消失。
按OLGA胃炎评价标准分为5组(Stage-0~Ⅳ)。要求入组患者每年完成1次内镜复查,同样位置取5块活组织,安排专人电话随访,记录具体复查时间、胃镜报告及病理结果。若随访期间出现不适,由临床医师评估处理,对于计划外内镜检查的,做好相应记录。
比较不同OLGA分组患者随访过程中萎缩进展情况、上皮内瘤变及早期胃癌发生率。
应用SPSS 22.0统计学软件,符合正态分布的计量资料以表示,两组间比较采用两独立样本t检验。计数资料以例数和百分比表示,组间比较采用χ2检验以及Fisher精确检验;采用双侧检验,检验水准a=0.05。
1. 本项研究共纳入700例患者,其中8例失访,10例入组阶段因个人原因退出,故最终实际纳入682例。包括男352例,女330例,年龄(48.2±12.3)岁,体质指数(BMI)(24.1±3.9)kg/m2。入组阶段,非萎缩性胃炎412例(60.4%),萎缩性胃炎270例(39.6%)。
2. 按照OLGA分组,其中Stage-0组412例,Stage-Ⅰ组190例,Stage-Ⅱ组54例,Stage-Ⅲ组19例,Stage-Ⅳ组7例。
共有437例患者完成内镜随访,具体如下:
1. Stage-0组中,5年内共有207例完成内镜随访(50.2%)。共有6例发生胃黏膜萎缩(2.9%),无上皮内瘤变及胃癌检出。
2. Stage-Ⅰ组中,5年内共有158例完成内镜随访(83.2%)。共有14例发生OLGA分期进展(8.9%),59例出现OLGA分期的逆转(37.3%),85例停留在Stage-Ⅰ期(53.8%),无上皮内瘤变及胃癌检出。
3. Stage-Ⅱ组中,5年内共有47例完成内镜随访(87.0%)。共有5例发生OLGA分期进展(10.6%),16例出现OLGA分期的逆转(34.0%),26例停留在Stage-Ⅱ期(55.3%),无上皮内瘤变及胃癌检出。
4. Stage-Ⅲ组中,5年内共有18例完成内镜随访(94.7%)。共有5例发生OLGA分期进展(27.8%),2例出现OLGA分期的逆转(11.1%),11例停留在Stage-Ⅲ期(61.1%),上皮内瘤变检出2例(11.1%),1例早期胃癌检出(5.6%)。
5. Stage-Ⅳ组中,5年内共有7例完成内镜随访(100%)。共有1例出现OLGA分期的逆转(14.3%),6例停留在Stage-Ⅳ期(85.7%),上皮内瘤变检出3例(42.9%),1例早期胃癌检出(14.3%)。
1. 萎缩进展方面,随访过程中随分组等级的升高萎缩进展率逐步升高(2.9%、8.9%、10.6%、27.8%)(χ2=19.14,P<0.001)。
2. 萎缩逆转方面,随访过程中随分组等级的升高萎缩逆转率逐步降低(37.3%、34.0%、11.1%、14.3%),但整体趋势差异无统计学意义(χ2=6.21,P=0.098);将Stage-Ⅰ与Stage-Ⅱ归类为低危组,Stage-Ⅲ与Stage-Ⅳ归类为高危组,可见高危组萎缩逆转率明显低于低危组(34.1%、12.0%),差异有统计学意义(χ2=4.96,P=0.026)(表1)。
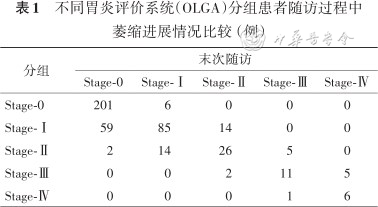
不同胃炎评价系统(OLGA)分组患者随访过程中萎缩进展情况比较(例)
不同胃炎评价系统(OLGA)分组患者随访过程中萎缩进展情况比较(例)
| 分组 | 末次随访 | ||||
|---|---|---|---|---|---|
| Stage-0 | Stage-Ⅰ | Stage-Ⅱ | Stage-Ⅲ | Stage-Ⅳ | |
| Stage-0 | 201 | 6 | 0 | 0 | 0 |
| Stage-Ⅰ | 59 | 85 | 14 | 0 | 0 |
| Stage-Ⅱ | 2 | 14 | 26 | 5 | 0 |
| Stage-Ⅲ | 0 | 0 | 2 | 11 | 5 |
| Stage-Ⅳ | 0 | 0 | 0 | 1 | 6 |
可以看到,低危组Stage-0、Stage-Ⅰ、Stage-Ⅱ未见上皮内瘤变及胃癌检出。高危组Stage-Ⅲ、Stage-Ⅳ共检出上皮内瘤变5例,早期胃癌2例。5例低级别上皮内瘤变病例中,2例属于Stage-Ⅲ组,3例属于Stage-Ⅳ组。2例早期胃癌病例,分别属于Stage-Ⅲ和Stage-Ⅳ组,检出时间分别为入组后第4年以及第2年。
高危组上皮内瘤变检出率明显高于低危组(20.0%、与0)(χ2=29.63,P<0.001),高危组胃癌检出率明显高于低危组(8.0%与0)(χ2=11.60,P=0.003)。其中5例均为低级别上皮内瘤变,2例胃癌后经内镜黏膜下剥离术(ESD)治疗病理证实均为早期胃癌(表2)。
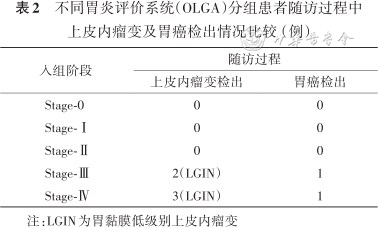
不同胃炎评价系统(OLGA)分组患者随访过程中上皮内瘤变及胃癌检出情况比较(例)
不同胃炎评价系统(OLGA)分组患者随访过程中上皮内瘤变及胃癌检出情况比较(例)
| 入组阶段 | 随访过程 | |
|---|---|---|
| 上皮内瘤变检出 | 胃癌检出 | |
| Stage-0 | 0 | 0 |
| Stage-Ⅰ | 0 | 0 |
| Stage-Ⅱ | 0 | 0 |
| Stage-Ⅲ | 2(LGIN) | 1 |
| Stage-Ⅳ | 3(LGIN) | 1 |
注:LGIN为胃黏膜低级别上皮内瘤变
胃癌的发生、发展是一个多步骤、渐进的过程,如何应对胃癌前状态和癌前病变逐渐成为胃癌筛查工作中的重要环节[4]。胃黏膜萎缩和胃黏膜上皮内瘤变是胃癌发生的独立危险因素,为胃癌的发生提供了基础条件[7]。近年来提出的OLGA胃炎评价标准,通过对胃炎萎缩程度和范围进行综合评估,能起到较好的预测作用。有研究表明,高等级分期(Ⅲ、Ⅳ期)的患者通常意味着更高的胃癌发生风险,需接受内镜和病理随访[8, 9]。然而上述研究并无明确细化的内镜随访设计,虽然可以得到高等级分期意味着更高胃癌发生风险的结论,但忽略了病灶病理状态的动态演变过程,对临床随访时间的界定帮助有限。其次,OLGA虽然在欧美国家被广泛证明其适用性,但是否同样适用于包括中国在内的胃癌高风险地区人群的随访仍需进一步明确。国内相关研究,更多关注于某一时期不同分组的病灶检出情况[10],类似于横断面研究,而对于OLGA应用于临床随访的研究少见报道。
关于我国内镜随访的具体方案,在新近发布的《中国胃黏膜癌前状态和癌前病变的处理策略专家共识》中已经给出相应建议。对于局限于胃窦的病理性轻中度萎缩性胃炎患者,建议每3年复查胃镜;对于累及全胃的重度萎缩性胃炎伴肠化生患者,随访时间应相应缩短,每1~2年完善一次内镜复查。
本研究发现,在随访期间OLGA高危组上皮内瘤变与胃癌检出率明显高于低危组,这也证实了上文提到的OLGA高等级分期意味着更高的胃癌发生风险。需要看到的是,低危组人群上皮内瘤变及胃癌5年内无病例检出,这可能也从侧面证明共识中对轻中度萎缩人群的3年随访时间窗设定是安全可靠的。而对于高危组,尤其是Stage-Ⅳ人群,上皮内瘤变及胃癌的检出率占比甚至超过50%。这当然与本研究纳入病例数过少,结论可能存在偏倚有关,但依然提示高危组,尤其是Stage-Ⅳ组内镜复查的必要性。2例胃癌的检出时间分别为入组后第2年以及第4年。因此,对于这部分高危人群,笔者认为2年的内镜随访时间设定是相对合理的。部分合并存在低级别上皮内瘤变的人群,可能需要每年内镜随访。
在另一方面,伴随着OLGA分组等级的升高,人群在随访过程中的胃黏膜萎缩进展率逐渐升高,逆转率逐渐降低。在轻中度萎缩的Stage-Ⅰ和Stage-Ⅱ组,约有1/3的人群在5年随访过程中发生了萎缩逆转,而这比例在重度萎缩的Stage-Ⅲ组则明显下降至约1/10。从这一点可以看到,阻断“经典Correa肠型胃癌演变”进程的关键节点可能在于轻中度萎缩人群。其次,本研究发现胃黏膜萎缩进展率与OLGA等级呈现正相关,低危组,尤其是无萎缩人群,5年内出现萎缩的概率不足3%,而高危组萎缩进展的概率接近上述人群的10倍,并检出2例上皮内瘤变。因此,对于非萎缩性胃炎人群,内镜随访并非必需,而高危组人群内镜随访对于监测胃癌前状态的进展以及癌前病变的发生也有其现实意义。
另外,本研究的不足之处主要在于样本量较小,尤其是OLGA高危组的人数少,且属于单中心研究,个体在地域环境、生活习惯、饮食结构等方面的差异可能会造成结果的偏倚。其次,本项研究并未将人群治疗用药情况纳入统计范畴,尤其在于幽门螺杆菌的有无及治疗情况,考虑到根除幽门螺杆菌可能会延缓或部分逆转胃黏膜萎缩,这一部分数据的缺失可能会影响部分结论的可靠性。
总之,本研究探讨了组织学OLGA胃炎评价标准在胃癌前病变随访过程中的价值,并通过比较5年随访过程中不同OLGA组间萎缩进展率/逆转率,上皮内瘤变检出率以及胃癌检出率的差异,肯定了其在胃癌前状态和癌前病变的风险分层评估中的价值。对于OLGA高分层等级人群,制定个体化的内镜/组织学随访方案存在其实际意义。未来需要开展更多大样本、多中心、高质量的临床研究加以证实,并将卫生经济效益纳入考虑范畴,逐步建立、完善适合我国国情的胃癌防治体系。
所有作者均声明不存在利益冲突



























