
随着再生医学的飞速发展,以及生物材料和细胞技术的不断进步,3D打印技术和干细胞运用到组织工程研究已经成为新的趋势。这一策略可以模拟原生组织或器官的原生态结构,在心脏外科、肺部疾病、气道重建方面应用的研究日渐增多。该技术为未来器官移植学科的基础研究、疾病诊治等方面提供了新的思路。本文现通过综述近三年3D生物打印结合干细胞在心胸外科等领域中的前沿研究及临床应用,评价其优势与不足,总结今后的应用前景和发展趋势。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
3D打印是近年来飞速发展的热门学科,在再生医学领域中得到了广泛应用[1,2]。为进一步构建出仿生型结构用于器官移植,3D生物打印技术应运而生,即使用活性细胞和生物相容性好的材料作为"生物墨水"打印的所需结构[3,4]。干细胞具有生长旺盛和低免疫原性的特点,可进行多向诱导分化,一直以来都是组织工程研究中的"明星"细胞[3,5]。将诱导和分化后的干细胞经生物打印技术接种,可以模拟原生组织中的分布与功能[6,7]。基于该理论基础,目前研究人员已经初步实现了多种组织和器官的结构重建和功能修复[8]。具体如表1所示。但如何构造更加完美的3D替代结构,并将其推广于临床治疗还面临着诸多挑战,如打印结构的生物相容性较差,移植后不能形成稳定有效的血供,以及远期随访显示不能匹配患者自身组织的代谢生长等[9]。未来3D生物打印技术的研究重点应在于优化出可实现复杂器官移植的打印技术,研制出满足生物活性和规模化培育的新型"生物墨水",从而构造出生物性能好且具有自我修复增殖功能的移植替代物;以及设计出合理可行的修复重建方案,为心胸外科未来的研究、治疗、术前规划、医学教育等提供新的策略。
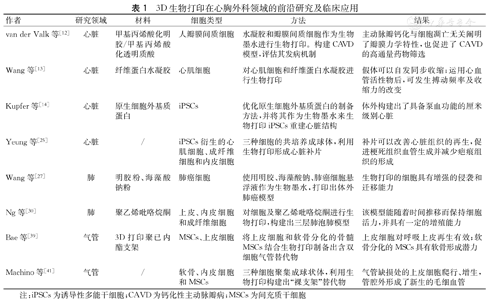
3D生物打印在心胸外科领域的前沿研究及临床应用
3D生物打印在心胸外科领域的前沿研究及临床应用
| 作者 | 研究领域 | 材料 | 细胞类型 | 方法 | 结果 |
|---|---|---|---|---|---|
| van der Valk等[12] | 心脏 | 甲基丙烯酸化明胶/甲基丙烯酸化透明质酸 | 人瓣膜间质细胞 | 水凝胶和瓣膜间质细胞作为生物墨水进行生物打印。构建CAVD模型,评估其发病机制 | 主动脉瓣钙化与细胞凋亡无关阐明了瓣膜力学特性,也促进了CAVD的高通量药物筛选 |
| Wang等[13] | 心脏 | 纤维蛋白水凝胶 | 心肌细胞 | 对心肌细胞和纤维蛋白水凝胶进行生物打印 | 假体可以自发同步收缩;运用心血管活性物后,可发生搏动频率及收缩力的改变 |
| Kupfer等[14] | 心脏 | 原生细胞外基质蛋白 | iPSCs | 优化原生细胞外基质蛋白的制备方法,并将其作为生物墨水来生物打印iPSCs重建心脏结构 | 体外构建出了具备泵血功能的厘米级别心脏 |
| Yeung等[25] | 心脏 | / | iPSCs衍生的心肌细胞、成纤维细胞和内皮细胞 | 三种细胞的共培养成球体,利用生物打印形成心脏补片 | 补片可以改善心脏组织的再生,促进梗死组织血管生成并减少疤痕组织的形成 |
| Wang等[27] | 肺 | 明胶粉、海藻酸钠粉 | 肺癌细胞 | 使用明胶、海藻酸钠、肺癌细胞悬浮液作为生物墨水,打印出体外肺癌模型 | 生物打印的细胞具有增强的侵袭和迁移能力 |
| Ng等[30] | 肺 | 聚乙烯吡咯烷酮 | 上皮、内皮细胞和成纤维细胞 | 对细胞及聚乙烯吡咯烷酮进行生物打印,构建出三层肺泡肺模型 | 该模型能随着时间推移而保持细胞活力,并具有一定的增殖能力 |
| Bae等[39] | 气管 | 3D打印聚已内酯支架 | MSCs、上皮细胞 | 将上皮细胞和软骨分化的骨髓MSCs结合生物打印制备出含双细胞气管替代物 | 上皮细胞对呼吸上皮再生有效;软骨分化的MSCs具有软骨形成潜力 |
| Machino等[41] | 气管 | / | 软骨、内皮细胞和MSCs | 三种细胞聚集成球状体,利用生物打印构建出"裸支架"替代物 | 气管缺损处的上皮细胞爬行、增生,管腔外形成了新生的毛细血管 |
注:iPSCs为诱导性多能干细胞;CAVD为钙化性主动脉瓣病;MSCs为间充质干细胞
3D生物打印的心脏模型是推进心脏疾病机制研究、促进临床相关科室发展和医学教育进步的理想工具[10,11]。由于瓣膜生物力学特性较复杂,钙化性主动脉瓣病(calcific aortic valve disease,CAVD)的发病机制尚不清楚,目前尚无合适的治疗方案。van der Valk等[12]测量了主动脉瓣的力学特性,以甲基丙烯酸明胶水凝胶作为瓣膜间质细胞的载体,通过3D打印技术成功构建了与主动脉瓣力学特性相似的体外CAVD模型,并在对比观察模型中的结构变化后发现主动脉瓣钙化与细胞凋亡无关。该研究不仅阐明了瓣膜力学的生物学特性,也促进了CAVD的高通量药物筛选[12]。利用类似的研究思路,学者可以更便捷及深入的探讨心脏疾病的发病机制。近年来,生物打印心脏模型取得了一定成果,但重建组织成熟度低,肌肉纤维定向分化障碍,导致收缩力弱。为使生物打印的心脏组织能够发育成具有同步收缩功能的结构,Wang等[13]采用复合水凝胶作为心肌细胞的载体,设计了由富含心肌细胞的水凝胶和聚己内酯(polycaprolactone,PCL)聚合物框架组成的心脏模型。体外实验证明,由致密且均匀排列的心肌细胞组成的结构可以自主和同步收缩,且在心血管活性药物作用后发生了搏动频率及收缩力的改变;免疫荧光染色进一步证实该结构存在渐进性的心脏组织发育[13]。该结构不仅可应用于组织工程,还为药理学等学科提供了良好的体外模型[13]。虽然制备的心脏模型中的细胞出现了收缩功能,但尚未实现心脏泵血。为进一步构建出具有泵血功能的"心脏",2020年Kupfer等[14]改良了原生细胞外基质蛋白的制备方法,将其作为诱导多能干细胞(induced pluripotent stem cells,iPSCs)的载体,促进iPSCs增殖和分化,结合3D打印技术制备出厘米级的"人类心脏"。该体外模型模拟了心脏特有的泵血生理功能,被认为具有里程碑式的意义,为体外心脏病学分析、损伤和疾病建模、医疗器械测试和心脏移植等再生医学研究提供了重要指引[14]。
临床心脏疾病患者死亡的主要原因之一是心脏结构和功能损伤引起的病理改变[15]。如心脏瓣膜疾病、冠心病等均可导致心功能进行性损伤,并最终发展为不可逆的心力衰竭[16,17]。对于需要进行瓣膜替代治疗的患者,经导管瓣膜置换术是目前开展较为广泛的诊疗手段。但该法不能直视心脏内部结构,更无法获得其解剖学参数,通过3D打印技术构建个体心脏瓣膜模型可以高度还原解剖结构,为术前评估和制定手术方案提供帮助,并可缩短手术时间[18,19]。虽然3D打印的心脏瓣膜实现了解剖结构的复现,但并不具有良好的生物活性。过往常用假体瓣膜为异种生物合成或机械假体,存在耐久性差、易出现结构功能障碍和退化、需二次手术和终身抗凝治疗等缺点。为进一步实现功能性瓣膜重建,3D生物打印技术应时而生。3D生物打印瓣膜可以在生理环境中保持瓣膜弹性及开合功能复原[20]。今后瓣膜置换的研究需立足于提高其生物学活性,如对体液及神经调节做出反馈。心脏移植是治疗终末期患者的可行方法,但临床中的供体数量远少于受体数量,同时移植术后易发生并发症和免疫排斥反应,使得受者心功能的理想恢复仍无法实现[21]。3D生物打印的出现有望克服以上难题,塑造出生物功能好的心脏结构为患者带来福音,给心脏外科研究领域注入新的治疗方案[22,23,24]。近年来,心脏替代治疗的策略往往是将细胞种植在支架上,再将支架植入体内。尽管取得了一些成果,但支架的快速降解和免疫原性等不足限制了其应用。为解决这类弊端,研究人员设计了新的方案——"裸支架"结构。Yeung等[25]将iPSCs衍生的心肌细胞、内皮细胞和成纤维细胞混合培养成球体,利用生物打印技术将球体制备成心脏补片,并在体外环境中观察到该补片具有"自主跳动"的功能。后续的动物实验进一步证实该心脏补片可以促进梗死部位血管生成并减少瘢痕组织形成,为心力衰竭和心肌梗死等疾病研究提供了新方案。心肌祖细胞具有修复心肌的潜力,但直接注射细胞疗法存在细胞滞留性和功能性较差的缺点。为避免细胞植入后的低潴留率,并改善细胞生存的局部微环境,Bejleri等[26]制备了一种新型"生物墨水",作为小儿心肌祖细胞的载体,再通过3D打印技术制备出心脏补片。体外实验发现,心肌祖细胞可在补片内保持高度增殖及分化活性;研究人员将补片移植入大鼠体内14 d后发现,该结构仍有效附着在心外膜上,并且在补片上观察到了血管形成,表明其与原生心肌可有机整合[26]。这提示我们该补片不仅可以根据需求,定制个体化的心脏补片,用于修复受损的心肌,还具备诱导血管生成的潜力。未来该补片有望用于治疗患有心力衰竭的儿童,为先天性心脏病的治疗与研究做出贡献。目前后续临床试验正在进行中,未来还需进一步研究该补片在疾病模型中的功效。
肺癌是全球范围内发病率和死亡率增长最快,对人群健康和生命威胁最大的恶性肿瘤之一。由于肺癌具有高侵袭且易转移的特点,目前临床上仍缺乏理想的治疗方法。为提高患者的远期生存率,设计出可模拟癌细胞生物学行为的体外模型势在必行。Wang等[27]使用其改良的"生物墨水"结合3D打印设计出了新的肺癌模型。该模型具有细胞分布均匀、存活率高、可持续培养的特点,进一步研究和应用有望为肺部肿瘤的诊疗提供一定帮助。另外,目前由传染性呼吸系统疾病(新型冠状病毒肺炎)引起的全球大流行,使得对合适的体外肺泡呼吸模型的需求日益增加。肺泡是亚毫米级的半球形囊泡,其外壁系气体交换的膜性结构,其内含有多种常驻细胞类型。这一复杂的解剖结构,对生物打印提出了更高要求。为进一步制备出具有生理活性及功能的肺泡结构,Grigoryan等[28]通过使用可光聚合水凝胶作为"生物墨水",打印出了具有血液和气体交换功能的"肺泡"结构,尝试通过量化模型中的血液灌注后氧合状态,评价这一体系的实用性。虽然该"模拟肺泡"的规模不大,但这种改良的"Weaire-Phelan"泡沫拓扑结构的3D血管系统极具创造性。近年已有研究通过3D生物打印技术成功重建出具有一定生理功能的肺泡模型,但还无法验证其保持长期活性的能力[28,29]。因此,有研究者使用3D生物打印技术构建了由上皮细胞、内皮细胞和成纤维细胞组成的三层肺泡模型,该模型能随时间推移而保持细胞活性,并具有一定的增殖分化潜能[30]。这对于呼吸道病原体有关的研究至关重要,也能帮助探索相关呼吸系统疾病的病理生理机制[30]。
治疗终末期慢性阻塞性肺疾病、特发性肺纤维化等慢性肺病的有效方法之一是肺移植。但可用的供体短缺以及术后并发症[如闭塞性细支气管炎(obliterative bronchiolitis,OB)]的高发生率,是其相较于其他器官移植后5年存活率低的重要原因[31,32]。进一步研究OB的发病机制,研究者们发现,随着OB进展,各级支气管结构内的干细胞逐渐耗竭,其增殖能力也逐渐下降,这表明干细胞的耗竭可能是肺移植失败的原因,但对于干细胞如何影响肺移植的机制还需进一步探索[33,34,35]。总体来说,由于肺组织的复杂解剖结构,3D生物打印在重建肺组织的进展仍较局限。相信随着今后技术的更新以及理论基础的深入研究,会很快推广运用于临床。
气管缺损可切除后行端端吻合,但当切除长度超过成人气管总长度的一半或儿童的1/3,就没有足够长度的原生气管来进行安全的修复重建[9,36]。在这种情况下就需要移植气管替代物,从来源看,可分为自体组织复合物、同种异体、合成假体和组织工程移植物[2,37]。干细胞结合3D打印是构建气管结构替代和功能缺陷修复的有效方法。虽然已有部分研究通过3D生物打印技术在动物模型中实现了气管缺损的修复重建,但仍存在管腔表面上皮再生、基质内软骨分化、移植物的血管重塑等诸多问题[37]。软骨和黏膜的不完全再生是气道再次狭窄的重要原因。针对这一问题,Kim等[38]在节段性气管缺损动物模型中设计了一种新型的双层管状支架,由电纺纳米纤维(内层)和3D打印微纤维(外层)组成,将人支气管上皮细胞种植到支架内表面,将iPSCs来源的间充质干细胞(mesenchymal stem cells,MSCs)和软骨细胞种植到支架外表面。在体外生物反应器内培养2 d后,将该仿生型替代物移植到气管缺损中,术后观察到移植物与接种的细胞有机结合,形成功能性、软骨化及上皮化的替代气道[38]。研究者未来还需使用大型动物进行研究,进一步探究种子细胞在软骨和黏膜再生过程中的分化机制。无独有偶,为了更好的模拟天然气管的原生态结构,Bae等[39]将软骨分化的骨髓MSCs和呼吸道上皮细胞为种子细胞,结合材料制备了5层"夹心"结构的人工气管,并在植入体内环境后观察到该气管替代物形成了新生上皮和软骨,同时移植物周围有滋养血管再生。该研究制备出了结构与功能均较理想的组织工程气管,丰富的新血管形成考虑与骨髓MSCs的血管生成潜力有关,但具体的分子生物学机制还有待研究[39]。
支架是气管重建的一个重要环节,基于支架制备的多种气管结构虽然取得了一定的疗效,但仍存在潜在感染、毒性、移位、生物相容性低等诸多缺点。基于3D生物打印技术的升级,有研究者使用由细胞富集而成的聚集体结合3D打印的方法来实现"裸支架"气管结构[40,41,42]。这一技术的优点是可以保留细胞活力及其旁分泌的活性物质,并使其在移植环境下发挥作用。为探索构建"裸支架"结构所需的最佳细胞组合和培养条件,有研究者利用3D生物打印技术将人软骨细胞、内皮细胞和间充质干细胞富集成的聚集体制备成气管替代物;目前已在体内实验观察到移植该气管替代物后,气管缺损处的上皮细胞爬行、增生,同时管腔外形成了新生的毛细血管网络[40,41,42]。上述研究表明,干细胞结合3D生物打印的方法在气管重建方面具有很大潜力。对于临床上姑息治疗的终末期气管疾病患者,生物打印的气管替代物也可以是一种选择。有效的气道置换可以使更多患者受益,并满足对包括隆突重建在内的高风险胸外科手术的需要。但要实现更理想的组织工程替代物,必须更贴近原生组织的解剖结构,克服重建气管良好血管化和移植后感染等方面的问题。今后,研究者可以从种子细胞的活性发挥、材料改进、技术优化等角度来研究如何进一步促进气管替代物远期功能恢复。
综上所述,3D生物打印在解决当前再生医学难题中显示出很大的潜力,利用该技术制备组织移植物及模型的技术正在迅速成熟,带来了独特治疗方法。该技术在心胸外科的基础前沿研究有着广泛进展,随着运用到临床的3D生物打印替代研究越来越多,其功能和安全性也得到了肯定。同时,该技术的临床及教育应用前景极为可观:(1)为心胸外科疾病的替代治疗提供了切实可行的方案,解决供体来源问题的同时实现了个体化治疗。(2)3D仿生模型可用于术前规划与评估,便于术者熟悉解剖变异并进行手术模拟,降低了围手术期并发症发生率,保障了患者的生命安全。(3)3D生物打印模型可以重现靶器官的解剖及内在结构,因此可以辅助对疾病的发生发展机制及诊疗靶点等问题的深入研究,同时可用于临床教学,提高医务人员的专业知识与素养,进而推动医学事业发展。但该技术也存在着一些不足:(1)由于细胞生存的微环境不同,不同细胞所需的"生物墨水"种类及浓度也是不同的,故需大量研究以开发出适合不同细胞类型的"生物墨水"。(2)3D生物打印是一个多学科交叉的领域,还缺乏可供各领域研究者交流合作的平台以及成熟的人才培养体系。(3)3D生物打印过程中,细胞必须承受压力,但并不是所有细胞经过3D生物打印后仍能保持自身活性。为了获得较高的细胞活力和可印刷性,还需优化细胞的分离、培养和增殖技术,调试出最适合的打印条件及参数,以及对"生物墨水"进行进一步优化。(4)3D生物打印设备及打印耗材成本均较高,且设备体积大,工作空间小,未来还需进一步改良。相信随着研究的不断深入,未来会有更多的技术成果得到应用,为外科领域各种疾病的治疗提供新方法与新思路。
所有作者声明无利益冲突



























