
基于弥漫大B细胞淋巴瘤(DLBCL)基因芯片表达数据库,分析肿瘤相关巨噬细胞及亚型浸润情况,探讨其与患者预后的相关性。
数据来源于PubMed基因表达数据库(GEO)中的DLBCL患者微阵列(Affymetrix U133 plus 2.0)数据库(编号GSE10846)。该数据库共包含414例患者,其中306例有完整的临床、细胞起源分型(COO分型)及治疗随访信息。通过基于评估RNA转录本相对占比进行细胞类型识别(CIBERSORT)的在线计算机程序进行数据分析;从生成的分析结果文件中识别出GSE10846数据库中所有患者包含各亚型巨噬细胞在内的免疫细胞在微环境中所有可识别免疫细胞中的比例。以巨噬细胞亚群占微环境所有免疫细胞比例中位值为临界值:≥临界值为高浸润。基于GSE10846数据库中所有414例DLBCL患者的myc、bcl-2、程序性死亡受体配体1(PD-L1)及程序性死亡受体配体2(PD-L2)基因表达量的中位值为临界值,≥临界值者为高表达。分析各型及总体巨噬细胞水平与临床因素、一些基因表达及生存的相关性,采用Cox比例风险模型对DLBCL患者预后进行多因素分析。采用R 4.0.4中surv_miner包中的surv_cutpoint函数确定各项巨噬细胞亚群占微环境所有免疫细胞比例的最佳临界值,<最佳临界值为统计学低浸润,≥最佳临界值为统计学高浸润。
经CIBERSORT分析,414例DLBCL患者中识别出肿瘤微环境中M0型巨噬细胞[15.00%(0~44.41%)]、M1型巨噬细胞[7.46%(0~23.00%)]、M2型巨噬细胞[6.28%(0~43.35%)]。具有完整的临床和随访资料的306例患者中,M0、M1、M2型和总巨噬细胞高浸润患者分别有155例(50.7%)、152例(49.7%)、156例(51.0%)、152例(49.7%),M0型巨噬细胞高浸润与COO分型为生发中心B细胞(GCB)型、PD-L1基因高表达及无myc、bcl-2 RNA水平双高表达(R-DEL)有关(均P<0.05),M1型巨噬细胞高浸润与女性、PD-L1基因高表达、PD-L2基因高表达有关(均P<0.05),M2型巨噬细胞高浸润与COO分型为GCB型、PD-L2基因高表达有关(均P<0.05),总巨噬细胞高浸润与女性、COO分型为GCB型、PD-L1基因高表达、PD-L2基因高表达、无R-DEL有关(均P<0.05)。PD-L1基因高表达与M0、M1型及总巨噬细胞高浸润相关(均P<0.01),PD-L2基因高表达与M1、M2型巨噬细胞及总巨噬细胞高浸润相关(均P<0.01)。M0型巨噬细胞高浸润组总生存(OS)较低浸润组好(P=0.002);M2型巨噬细胞低浸润组OS较高浸润组好(P=0.019)。R-DEL组OS较无R-DEL组差(P=0.001)。国际预后指数(IPI)评分低(0~2分)、COO分型为GCB型、治疗中采用利妥昔单抗的患者OS更好(均P<0.01)。多因素Cox回归分析结果显示,年龄≥60岁、COO分型为非GCB分型、治疗方案中不含利妥昔单抗、M0型巨噬细胞低浸润、M2型巨噬细胞高浸润为DLBCL患者OS的独立不良影响因素(均P<0.05)。M0型巨噬细胞最佳临界值为4.3%,M2型巨噬细胞最佳临界值为4.8%;M0型巨噬细胞统计学低浸润组OS更差(P<0.001),M2型巨噬细胞统计学高浸润组OS更差(P=0.001)。
DLBCL肿瘤微环境的免疫细胞中肿瘤相关巨噬细胞含量最高。M2型巨噬细胞高浸润患者预后较差,而M0型巨噬细胞高浸润患者预后较好。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
弥漫大B细胞淋巴瘤(DLBCL)是最常见的淋巴瘤类型[1],具有较高的侵袭性。传统的DLBCL细胞起源分型(COO分型)基于免疫组织化学染色结果,对于预后分层具有较好的临床指导意义[2]。利妥昔单抗及蒽环类药物极大改善DLBCL患者的生存情况,并使得COO分型的指导意义逐渐弱化。尽管如此,仍存在约40%复发难治DLBCL患者。除了"双重打击淋巴瘤""双高表达"DLBCL外[3],许多研究也提出DLBCL微环境中免疫细胞,尤其是M2型巨噬细胞浸润密度差异与DLBCL预后相关[4,5,6,7],但各研究均基于CD68、CD163等巨噬细胞免疫标记分析结果,具有一定局限性。基于评估RNA转录本相对占比进行细胞类型识别(CIBERSORT)算法可以在复杂的肿瘤背景成分中准确识别出22种不同类型免疫细胞,并对巨噬细胞M0、M1、M2亚型定量分析[8]。本研究基于已发表的DLBCL患者基因芯片表达数据库信息,应用CIBERSORT技术分析不同亚型巨噬细胞浸润情况及与DLBCL患者预后的关系。
数据来源于PubMed基因表达数据库(GEO),获取号GSE10846,始于2008年3月,2019年9月更新[9],DLBCL患者微阵列(Affymetrix U133 plus 2.0)数据库。该数据库共包含414例患者,其中306例有完整的临床、COO分型及治疗随访信息,包括男性172例,女性134例;中位年龄62岁(14~92岁),<60岁146例,≥60岁160例;Ⅰ~Ⅱ期144例,Ⅲ~Ⅳ期162例;乳酸脱氢酶水平正常157例,升高149例;有结外侵犯23例,无结外侵犯283例;美国东部肿瘤协作组(ECOG)评分≤1分231例,>1分75例;国际预后指数(IPI)评分3~5分90例,0~2分216例;COO分型为活化B细胞型(ABC型)125例,生发中心B细胞型(GCB型)134例,难以分类42例;CHOP方案治疗142例,R-CHOP方案治疗164例。患者总生存(OS)相关的随访数据同样来源于GSE10846数据库,定义为患者从确诊至任何原因导致死亡或末次随访时间。
从GEO公共库下载用于分析的原始数据库GSE10846,又称为混合文件数据库。登录CIBERSORT网站,按照要求将待分析的混合性文件整理为规定格式。整理好的数据库中每列含有单个患者所有基因RNA表达(对数)值,每行含有特定基因在所有患者中的RNA表达值。此外CIBERSORT分析需标准化数据库作为数据分析参照标准,本研究选用滤泡淋巴瘤微阵列(Affymetrix U133)数据库(编号GSE11103)分析结果作为标准化数据库。按照网站要求上传所需分析的混合文件数据库。运行CIBERSORT程序,从其最终分析结果文件中可以得到GSE10846数据库中所有患者包含各亚型巨噬细胞在内的免疫细胞在微环境中所有识别的免疫细胞类型中所占比例。以巨噬细胞亚群占微环境所有免疫细胞比例中位值为临界值:<临界值为低浸润,≥临界值为高浸润。
基于GSE10846数据库中所有414例DLBCL患者的myc、bcl-2、程序性死亡受体配体1(PD-L1)及程序性死亡受体配体2(PD-L2)基因RNA表达量数值(如有2个及以上表达值结果,则取最高数值),以上述基因表达量中位值为临界值,≥临界值为高表达,<临界值为低表达。
采用SPSS17.0统计学软件进行统计学分析。符合正态分布的计量资料以 ±s表示;不符合正态分布的计量资料以中位数(范围)表示。计数资料以频数(%)表示,比较采用χ2检验或Fisher确切概率法。采用Kaplan-Meier法进行生存分析,并行log-rank检验。采用Cox比例风险回归模型对预后影响因素进行多因素分析。采用R 4.0.4中surv_miner包中的surv_cutpoint函数确定各巨噬细胞亚群占微环境所有免疫细胞比例的最佳临界值,<最佳临界值为统计学低浸润,≥最佳临界值为统计学高浸润。P<0.05为差异具有统计学意义。
±s表示;不符合正态分布的计量资料以中位数(范围)表示。计数资料以频数(%)表示,比较采用χ2检验或Fisher确切概率法。采用Kaplan-Meier法进行生存分析,并行log-rank检验。采用Cox比例风险回归模型对预后影响因素进行多因素分析。采用R 4.0.4中surv_miner包中的surv_cutpoint函数确定各巨噬细胞亚群占微环境所有免疫细胞比例的最佳临界值,<最佳临界值为统计学低浸润,≥最佳临界值为统计学高浸润。P<0.05为差异具有统计学意义。
经CIBERSORT分析,414例DLBCL患者中识别出肿瘤微环境中免疫细胞22种,其中记忆性B细胞[17.36%(0~63.56%)]和初始B细胞[15.26%(0~60.94%)]比例最高。由于DLBCL为成熟B细胞来源的肿瘤,故而CIBERSORT计算出的B细胞与肿瘤性B细胞密切相关且难以准确区分,本研究中未进一步讨论。其余免疫细胞分别为M0型巨噬细胞[15.00%(0~44.41%)]、M1型巨噬细胞[7.46%(0~23.00%)]、CD8+ T细胞[6.88%(0~32.97%)]、滤泡辅助性T细胞[6.76%(0~31.47%)]、M2型巨噬细胞[6.28%(0~43.35%)]、活化CD4+记忆性T细胞[4.80%(0~26.45%)]、γδT细胞[4.48%(0~35.05%)]、静息肥大细胞[1.59%(0~11.38%)]、活化NK细胞[0.35%(0~12.56%)]、浆细胞[0(0~47.37%)]、CD4+初始T细胞[0(0~19.28%)]、静息CD4+记忆性T细胞[0(0~20.49%)]、调节性T细胞[0(0~11.60%)]、静息NK细胞[0(0~10.37%)]、单核细胞[0(0~13.46%)]、静息树突细胞[0(0~8.01%)]、活化树突细胞[0(0~11.16%)]、活化肥大细胞[0(0~7.36%)]、嗜酸粒细胞[0(0~6.06%)]、嗜中性粒细胞[0(0~14.85%)]。若单纯计算各型巨噬细胞(包括M0、M1和M2),则总巨噬细胞所占比例中位值28.81%(1.36%~73.71%)。
306例患者具有完整的临床资料,M0、M1、M2型巨噬细胞及总巨噬细胞高浸润患者分别为155例(50.7%)、152例(49.7%)、156例(51.0%)、152例(49.7%),低浸润患者分别为151例(49.3%)、154例(50.3%)、150例(49.0%)、154例(50.3%)。M0型巨噬细胞高浸润与COO分型为GCB型、PD-L1基因高表达及无myc、bcl-2 RNA水平双高表达(R-DEL)有关(均P<0.05),M1型巨噬细胞高浸润与女性、PD-L1基因高表达、PD-L2基因高表达有关(均P<0.05),M2型巨噬细胞高浸润与COO分型为GCB型、PD-L2基因高表达有关(均P<0.05),总巨噬细胞高浸润与女性、COO分型为GCB型、PD-L1基因高表达、PD-L2基因高表达、无R-DEL有关(均P<0.05)(表1)。
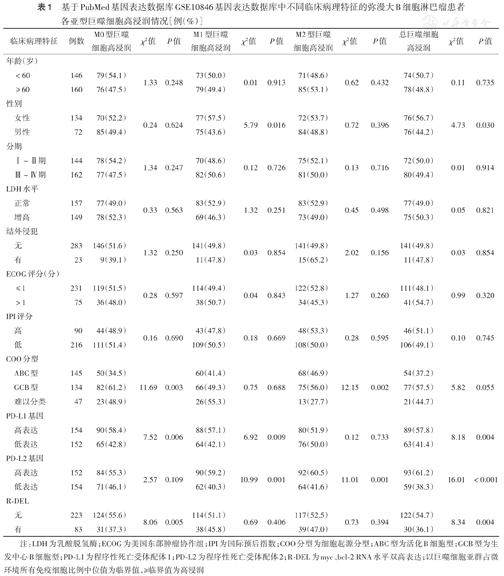
基于PubMed基因表达数据库GSE10846基因表达数据库中不同临床病理特征的弥漫大B细胞淋巴瘤患者各亚型巨噬细胞高浸润情况[例(%)]
基于PubMed基因表达数据库GSE10846基因表达数据库中不同临床病理特征的弥漫大B细胞淋巴瘤患者各亚型巨噬细胞高浸润情况[例(%)]
| 临床病理特征 | 例数 | M0型巨噬细胞高浸润 | χ2值 | P值 | M1型巨噬细胞高浸润 | χ2值 | P值 | M2型巨噬细胞高浸润 | χ2值 | P值 | 总巨噬细胞高浸润 | χ2值 | P值 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 年龄(岁) | ||||||||||||||
| <60 | 146 | 79(54.1) | 1.33 | 0.248 | 73(50.0) | 0.01 | 0.913 | 71(48.6) | 0.62 | 0.432 | 74(50.7) | 0.11 | 0.735 | |
| ≥ 60 | 160 | 76(47.5) | 79(49.4) | 85(53.1) | 78(48.8) | |||||||||
| 性别 | ||||||||||||||
| 女性 | 134 | 70(52.2) | 0.24 | 0.624 | 77(57.5) | 5.79 | 0.016 | 72(53.7) | 0.72 | 0.396 | 76(56.7) | 4.73 | 0.030 | |
| 男性 | 72 | 85(49.4) | 75(43.6) | 84(48.8) | 76(44.2) | |||||||||
| 分期 | ||||||||||||||
| Ⅰ~Ⅱ期 | 144 | 78(54.2) | 1.34 | 0.247 | 70(48.6) | 0.12 | 0.726 | 75(52.1) | 0.13 | 0.716 | 72(50.0) | 0.01 | 0.914 | |
| Ⅲ~Ⅳ期 | 162 | 77(47.5) | 82(50.6) | 81(50.0) | 80(49.4) | |||||||||
| LDH水平 | ||||||||||||||
| 正常 | 157 | 77(49.0) | 0.33 | 0.563 | 83(52.9) | 1.32 | 0.251 | 83(52.9) | 0.45 | 0.498 | 77(49.0) | 0.05 | 0.821 | |
| 增高 | 149 | 78(52.3) | 69(46.3) | 73(49.0) | 75(50.3) | |||||||||
| 结外侵犯 | ||||||||||||||
| 无 | 283 | 146(51.6) | 1.32 | 0.250 | 141(49.8) | 0.03 | 0.854 | 141(49.8) | 2.02 | 0.156 | 141(49.8) | 0.03 | 0.854 | |
| 有 | 23 | 9(39.1) | 11(47.8) | 15(65.2) | 11(47.8) | |||||||||
| ECOG评分(分) | ||||||||||||||
| ≤ 1 | 231 | 119(51.5) | 0.28 | 0.597 | 114(49.4) | 0.04 | 0.843 | 122(52.8) | 1.27 | 0.260 | 111(48.1) | 0.99 | 0.320 | |
| >1 | 75 | 36(48.0) | 38(50.7) | 34(45.3) | 41(54.7) | |||||||||
| IPI评分 | ||||||||||||||
| 高 | 90 | 44(48.9) | 0.16 | 0.690 | 43(47.8) | 0.18 | 0.669 | 48(53.3) | 0.28 | 0.595 | 46(51.1) | 0.10 | 0.745 | |
| 低 | 216 | 111(51.4) | 109(50.5) | 108(50.0) | 106(49.1) | |||||||||
| COO分型 | ||||||||||||||
| ABC型 | 145 | 50(34.5) | 11.69 | 0.003 | 60(41.4) | 0.75 | 0.688 | 68(46.9) | 12.15 | 0.002 | 54(37.2) | 5.82 | 0.055 | |
| GCB型 | 134 | 82(61.2) | 66(49.3) | 75(56.0) | 77(57.5) | |||||||||
| 难以分类 | 47 | 23(48.9) | 26(55.3) | 13(27.7) | 21(44.7) | |||||||||
| PD-L1基因 | ||||||||||||||
| 高表达 | 154 | 90(58.4) | 7.52 | 0.006 | 88(57.1) | 6.92 | 0.009 | 80(51.9) | 0.12 | 0.733 | 89(57.8) | 8.18 | 0.004 | |
| 低表达 | 152 | 65(42.8) | 64(42.1) | 76(50.0) | 63(41.4) | |||||||||
| PD-L2基因 | ||||||||||||||
| 高表达 | 152 | 84(55.3) | 2.57 | 0.109 | 90(59.2) | 10.99 | 0.001 | 92(60.5) | 11.01 | 0.001 | 93(61.2) | 16.01 | <0.001 | |
| 低表达 | 154 | 71(46.1) | 62(40.3) | 64(41.6) | 59(38.3) | |||||||||
| R-DEL | ||||||||||||||
| 无 | 223 | 124(55.6) | 8.06 | 0.005 | 114(51.1) | 0.69 | 0.406 | 117(52.5) | 0.73 | 0.394 | 122(54.7) | 8.34 | 0.004 | |
| 有 | 83 | 31(37.3) | 38(45.8) | 39(47.0) | 30(36.1) | |||||||||
注:LDH为乳酸脱氢酶;ECOG为美国东部肿瘤协作组;IPI为国际预后指数;COO分型为细胞起源分型;ABC型为活化B细胞型;GCB型为生发中心B细胞型;PD-L1为程序性死亡受体配体1;PD-L2为程序性死亡受体配体2;R-DEL为myc、bcl-2 RNA水平双高表达;以巨噬细胞亚群占微环境所有免疫细胞比例中位值为临界值,≥临界值为高浸润
GSE10846数据库中414例患者中myc、bcl-2、PD-L1(CD274)、PD-L2基因RNA表达量中位对数值分别为11.306(8.056~14.860)、10.248(6.810~13.967)、9.890(6.771~14.779)、5.847(2.561~10.970)。306例临床资料完整患者中,myc、bcl-2、PD-L2基因高表达均为152例(49.7%),低表达均为154例(50.3%);PD-L1基因高表达154例(50.3%),低表达152例(49.7%)。R-DEL 83例(27.1%)。PD-L1基因高表达与M0、M1及总巨噬细胞高浸润相关(均P<0.01),PD-L2基因高表达与M1、M2及总巨噬细胞高浸润相关(均P<0.01)(表1)。
414例DLBCL患者中,M0型巨噬细胞高浸润组OS较低浸润组好(P=0.002)(图1A);M2型巨噬细胞低浸润组OS较高浸润组好(P=0.019)(图1B)。不同M1型巨噬细胞、总巨噬细胞浸润程度患者OS差异均无统计学意义(P值分别为0.417、0.476)。R-DEL组OS较无R-DEL组差(P=0.001),PD-L1基因和PD-L2基因基因水平不同DLBCL患者OS差异无统计学意义(P值分别为0.539、0.475)。IPI评分低(0~2分)、COO分型为GCB型、治疗中采用利妥昔单抗的患者OS更好(P值分别为<0.001、<0.001及0.002)。IPI评分包含的具体因素中,年龄<60岁、分期Ⅰ~Ⅱ期,LDH水平正常及ECOG评分≤1的患者OS均较好(均P<0.01),有无结外侵犯的患者OS差异无统计学意义(P=0.054)。不同性别患者OS差异无统计学意义(P=0.718)。
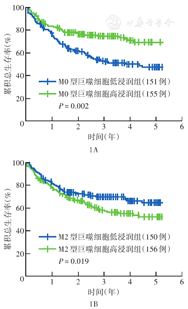

注:以巨噬细胞亚群占微环境所有免疫细胞比例中位值为临界值,<临界值为低浸润,≥临界值为高浸润
将M0及M2型巨噬细胞浸润程度、R-DEL、性别、年龄、分期、血清LDH水平、ECOG评分、IPI评分、COO分型、是否使用利妥昔单抗治疗等可能影响预后的因素纳入多因素生存分析显示,年龄≥60岁、COO分型为非GCB分型、治疗方案中不含利妥昔单抗、M0型巨噬细胞低浸润、M2型巨噬细胞高浸润为影响DLBCL患者OS的独立不良预后因素(均P<0.05)(表2)。
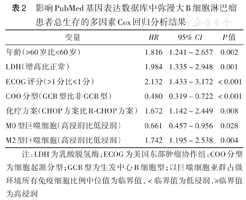
影响PubMed基因表达数据库中弥漫大B细胞淋巴瘤患者总生存的多因素Cox回归分析结果
影响PubMed基因表达数据库中弥漫大B细胞淋巴瘤患者总生存的多因素Cox回归分析结果
| 变量 | HR | 95% CI | P值 |
|---|---|---|---|
| 年龄(≥60岁比<60岁) | 1.816 | 1.241~2.657 | 0.002 |
| LDH(增高比正常) | 1.984 | 1.335~2.948 | 0.001 |
| ECOG评分(>1分比≤1分) | 2.132 | 1.433~3.172 | <0.001 |
| COO分型(GCB型比非GCB型) | 0.480 | 0.319~0.722 | <0.001 |
| 化疗方案(CHOP方案比R-CHOP方案) | 1.672 | 1.142~2.449 | 0.008 |
| M0型巨噬细胞(高浸润比低浸润) | 0.661 | 0.457~0.956 | 0.028 |
| M2型巨噬细胞(高浸润比低浸润) | 1.742 | 1.195~2.538 | 0.004 |
注:LDH为乳酸脱氢酶;ECOG为美国东部肿瘤协作组;COO分型为细胞起源分型;GCB型为生发中心B细胞型;以巨噬细胞亚群占微环境所有免疫细胞比例中位值为临界值,<临界值为低浸润,≥临界值为高浸润
采用R软件的surv_miner包计算M0及M2型巨噬细胞亚群占微环境所有免疫细胞比例最佳临界值。M0型巨噬细胞最佳临界值为4.3%,据此分为统计学高浸润组274例,统计学低浸润组32例,统计学低浸润组OS更差(P<0.001)(图2A)。M2型巨噬细胞最佳临界值为4.8%,据此分为统计学高浸润组194例,统计学低浸润组112例,统计学高浸润组OS更差(P=0.001)(图2B)。
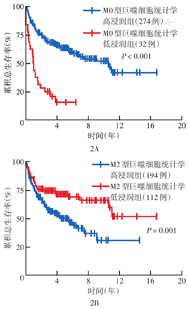

注:采用R软件的surv_miner包计算M0及M2型巨噬细胞亚群占微环境所有免疫细胞比例最佳临界值,M0型巨噬细胞最佳临界值为4.3%,M2型巨噬细胞最佳临界值为4.8%;<最佳临界值为统计学低浸润,≥最佳临界值为统计学高浸润
包含淋巴瘤在内的很多恶性肿瘤背景中浸润的某些特定类型肿瘤相关免疫细胞(如巨噬细胞、T细胞等)可影响患者预后,并可作为潜在治疗靶点[10,11,12]。然而上述研究多基于免疫组织化学染色分析结果,往往仅使用1~2种标志物来标记某种感兴趣的细胞类型,易受到使用抗体特异性、细胞抗原保存状态、评判标准等多种主观及客观因素影响,研究结论可能具有一定局限性。CIBERSORT技术首先将标准化基因表达谱数据库中已知比例的某种特定类型免疫细胞相关的多种转录RNA亚群表达量进行分析,然后从需要研究的目标基因表达数据库中识别出与该细胞类型相关的所有RNA亚群表达量,将两者进行比对分析,从而识别出待分析目标数据库中特定细胞类型及其占微环境所有免疫细胞的相对比例,并进行细胞类型识别。相较于免疫组织化学染色等传统手段,CIBERSORT技术在肿瘤微环境研究中可以提供更为丰富和量化的信息。
巨噬细胞属于固有免疫系统,参与炎症和肿瘤等疾病病理过程,在疾病的发病过程具有可塑性及多重功能[13]。肿瘤浸润的巨噬细胞(又称肿瘤相关巨噬细胞,TAM)具有促肿瘤和抗肿瘤的双重功能,其促肿瘤功能在肿瘤发生、转移过程中具有重要作用[13]。长期以来,人们一直认为TAM起源于循环单核细胞,但小鼠和人类研究的证据表明TAM起源有两种:来自胚胎时期和成人体内循环的髓系前体细胞[13],由此推测不同起源TAM可存在功能差异。来源于胚胎时期的巨噬细胞在细胞外基质的改建中起到重要作用,在一些类型的肿瘤中,TAM主要源自骨髓源性单核细胞,如部分淋巴瘤患者进行骨髓移植的过程中,证实其TAM来源于骨髓前体细胞[14]。在小鼠乳腺癌模型中,肿瘤生长与TAM成分中固有组织细胞丧失和源自骨髓的单核/巨噬细胞浸润替代有关[15]。胚胎源性组织固有巨噬细胞在胰腺导管腺癌中纤维化和进展中发挥关键作用[16]。
目前尚缺乏可靠的生物标志物来评估各种肿瘤中不同亚型巨噬细胞的含量,继而明确是何种亚型的巨噬细胞在促进肿瘤发生中发挥关键作用。CIBERSORT基于基因表达谱分析结果,使用22种特定细胞标准品,测定类型相关的RNA转录本表达量;对待测病变组织中基因表达频谱分析,依据其中包含所有的免疫细胞类型相关的RNA转录本表达量,使用计算机建模分析,最终计算得出22种免疫细胞所占比例[8]。所以CIBERSORT分析给出了一个较好的解决方案来客观定量评价包括肿瘤组织的巨噬细胞在内的各型免疫细胞的含量,并优于传统上使用CD163标记M2型巨噬细胞含量、CD68标记总巨噬细胞含量并进行定量研究,以及随后肉眼评估或计算机数字扫描定量分析的研究评价方案[17]。
DLBCL是最常见的淋巴瘤类型[1],肿瘤微环境中由谱系复杂免疫细胞(主要由T细胞、巨噬细胞、NK细胞、非肿瘤性B细胞等)以及间质细胞和血管等构成,其中T细胞和组织细胞是最主要的成分[18]。本研究基于DLBCL基因表达谱数据库,采用CIBERSORT对DLBCL的微环境成分进行了较为全面的分析。与既往基于形态和免疫表型评估的结果一致,进一步证实了巨噬细胞和T细胞是最主要的肿瘤微环境中的免疫细胞成分[11,18],尤其巨噬细胞是DLBCL肿瘤微环境中最主要的细胞成分,平均含量高于T细胞及其他免疫细胞。TAM是DLBCL最为重要的免疫细胞类型,M0型巨噬细胞为静息状态的巨噬细胞,M1型巨噬细胞及M2型巨噬细胞是极化的功能性巨噬细胞。各型巨噬细胞所占比例从高至低依次为M0型、M1型及M2型,所有DLBCL患者M0型比例最高,超过50%,而M1型巨噬细胞及M2型巨噬细胞在总巨噬细胞中比例均<1/3。
本研究依据数据库提供的资料进行OS分析结果显示,M2型巨噬细胞所占比例高的患者预后变差,与文献[4,5,6,7,19]报道一致,尽管文献中评价M2型巨噬细胞含量采用免疫组织化学法标记CD163并通过数字扫描切片定量分析或者人工判读结果,并且从蛋白水平证实了CIBERSORT分析结果的准确性和可靠性。同时进一步证实TAM向M2型方向极化会导致淋巴瘤进展。具体机制可能与M2型组织细胞可促进DLBCL和相关肿瘤发生、播散及免疫逃逸有关[5,6]。
本研究中M0型巨噬细胞高的DLBCL患者OS较好,而在肝癌、肺癌中有相反的结论[10,20]。提示不同类型肿瘤中M0型巨噬细胞含量对预后的影响存在差异,可能与M0型巨噬细胞的来源不同有关,DLBCL中巨噬细胞更多为骨髓起源的外周血单核细胞,而肺癌和肝癌中巨噬细胞更多为固有的胚胎源性巨噬细胞;也不排除与不同肿瘤中肿瘤细胞本身的生物学特性差异有关,具体机制有待进一步深入研究。此外,本研究结果提示M0及M2型巨噬细胞高浸润与COO分型为GCB型有关,但多因素分析显示COO分型、M2型巨噬细胞高浸润及M0型巨噬细胞高浸润均是独立的预后因素。COO分型为GCB型的DLBCL患者预后差可能与M2型巨噬细胞高浸润有关。
总之,本研究结果证实巨噬细胞是DLBCL肿瘤微环境中最主要的TAM,TAM各亚型中M2型巨噬细胞在所有巨噬细胞亚型中所占比例最低,其高浸润提示患者OS差;M0型巨噬细胞是TAM所占比例最高的类型,其高浸润提示患者OS较好。本研究结果基于国外发表数据,我国DLBCL患者中各型巨噬细胞所占比例、对生存的影响有待进一步研究,深入研究TAM各亚型影响预后的内在机制,从而针对肿瘤免疫微环境中的特定巨噬细胞亚型进行靶向干预和治疗。
所有作者均声明无利益冲突



























