
口腔黏膜炎是肿瘤放射治疗和(或)化学治疗过程中最常见的并发症之一,以疼痛性黏膜广泛充血、糜烂、溃疡形成为特征,严重影响患者生存质量甚至延误肿瘤治疗进程。因此,放化疗性口腔黏膜炎的预防与治疗必须贯穿于肿瘤治疗的全过程,包括全面的口腔卫生宣教、积极的治疗前口腔处置和物理预防、及时促进愈合和感染防控介入、必要的饮食调整与营养维持、适度的情感关怀,以提高患者生存质量,确保肿瘤治疗的顺利进行。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,2022年从第2期至第8期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
放化疗性口腔黏膜炎(radiotherapy-induced/chemotherapy- induced oral mucositis,RIOM/CIOM)是指肿瘤患者在接受放疗和(或)化疗后出现的以口腔黏膜糜烂、溃疡为主的急慢性口腔黏膜损伤[1, 2]。在放化疗过程中,口腔黏膜上皮细胞的生长和分化受到干扰,导致黏膜上皮细胞周期异常及细胞凋亡,引起黏膜急慢性炎症。据统计,口腔黏膜炎在接受头颈部肿瘤放疗患者中的发生率接近100%,在接受传统化疗患者中为20%~40%,在接受造血干细胞移植预处理患者中约为80%[1, 2]。RIOM/CIOM严重影响患者生存质量甚至延误肿瘤治疗进程,因此,RIOM/CIOM的预防与治疗必须贯穿于肿瘤治疗的全过程。RIOM/CIOM的预防和治疗涉及口腔医学、肿瘤学、放射医学、护理学、药理学等多学科,本文主要从口腔医师的角度阐述RIOM/CIOM的防治措施。
无论是放疗还是化疗,口腔黏膜炎的临床表现都相似,分为红斑期、溃疡期、愈合期。在红斑期,受累黏膜弥漫充血、水肿;随后病损迅速萎缩,发生弥漫性糜烂、不规则形状的溃疡,并可伴有假膜形成,溃疡周围可有红斑,到达溃疡期[3, 4];在放化疗结束后受损黏膜逐渐愈合,称愈合期。在此过程中,患者伴发黏膜疼痛、口干、吞咽困难等一系列症状。RIOM主要发生在辐射暴露部位[5],而CIOM则常见于非角化黏膜。
RIOM/CIOM可分为急性和慢性口腔黏膜炎。急性口腔黏膜炎主要发生在放射治疗期间,累积辐射量达15~20 Gy时典型症状和体征开始出现,在累积辐射剂量达30 Gy时,疼痛等症状最严重,黏膜出现广泛的糜烂、溃疡伴有假膜形成,此时患者往往伴发口干、口臭,而在放疗完成2~4周后,受累的黏膜逐渐自行痊愈[4, 5]。放疗结束后2年出现的黏膜损害称为慢性口腔黏膜炎,为唾液腺广泛萎缩引起的继发性损害,主要表现为口腔黏膜尤其是舌乳头的广泛萎缩、充血,伴有持续的口干和味觉异常。
CIOM发生于化疗开始后的3~5 d,此时患者口腔黏膜灼热和刺痛感明显、出现口腔黏膜充血水肿;在化疗7~10 d,患者疼痛症状加剧,黏膜出现较明显的糜烂、溃疡并伴有假膜,在接受化疗2周后达高峰。如病损未发生继发感染,口腔黏膜炎的黏膜损害可在化疗结束3周后逐渐痊愈。
在RIOM/CIOM的发生发展过程中,由于口腔黏膜屏障受到不同程度的破坏,部分患者黏膜可发生白色念珠菌感染、单纯疱疹病毒感染等继发感染,严重者可出现菌血症、败血症等[6, 7]。
除口腔损伤外,RIOM/CIOM的发生还可引发一系列不良后果,需引起临床医师的重视。例如口腔黏膜疼痛影响进食,引起患者全身营养不良,生存质量降低;患者对放化疗失去耐心和信心,导致肿瘤治疗延迟、中断甚至停止,患者生存年限缩短;治疗周期延长导致治疗成本提高,社会经济负担增加[3, 4]。
RIOM/CIOM的诊断主要根据患者的肿瘤治疗病史和口腔黏膜损害的特征得出。RIOM/CIOM需要进行鉴别的疾病包括药物过敏性口炎、多形红斑、干燥综合征等,根据患者肿瘤治疗病史,诊断与鉴别诊断并不困难。
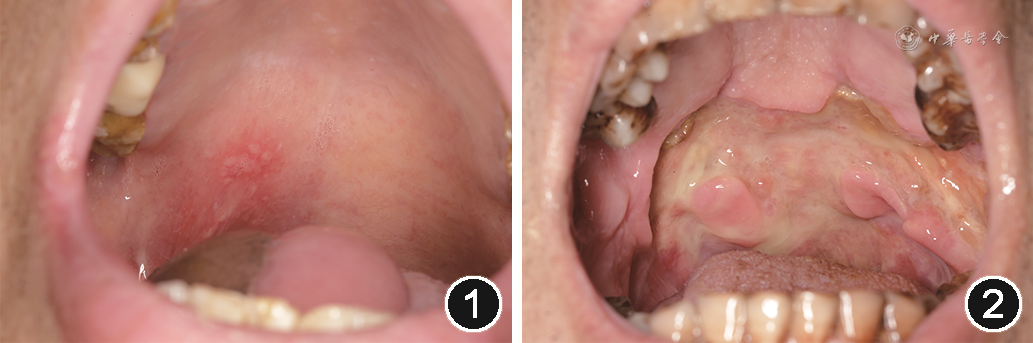
目前RIOM/CIOM的临床评估,主要采用的分级标准见表1[4],典型病例见图1,2。

肿瘤患者口腔黏膜炎常用的评估分级标准[4]
肿瘤患者口腔黏膜炎常用的评估分级标准[4]
| 分级标准 | 0级 | 1级 | 2级 | 3级 | 4级 | 5级 |
|---|---|---|---|---|---|---|
| WHO | 无症状 | 黏膜疼痛、红斑 | 疼痛性红斑,能进食固体 | 疼痛性红斑,仅能进流食 | 疼痛性红斑,由于黏膜炎而无法进食 | - |
| NCI-CTCAE | - | 无症状或有轻微疼痛的溃疡、红斑,无需干预 | 形成直径≤1.5 cm的片状假膜,疼痛的溃疡、红斑、水肿,疼痛可忍耐,不影响进食 | 疼痛的溃疡、红斑、水肿,疼痛严重,影响进食,需要静脉补液 | 严重的溃疡,危及生命,需要肠外营养和(或)预防性气管插管 | 死亡 |
注:WHO为世界卫生组织;NCI-CTCAE为美国国家癌症研究所不良事件术语评价标准;-表示无数据

1.口腔局部因素:口腔状况与口腔黏膜炎的发生风险密切相关。例如,不良口腔卫生状况,残根残冠、设计或制作不当的修复体等慢性刺激,放化疗前已经存在的牙髓炎、根尖周炎、牙周炎等牙体牙周疾病,以及唾液腺功能障碍导致的唾液分泌减少[1,5],均可显著增加RIOM/CIOM发生的风险,口腔医师需尽可能在放化疗前彻底处理相关口腔疾病。
2.全身因素:患者全身状况,包括遗传背景、营养状况、肝肾功能、是否合并糖尿病等系统疾病,均与口腔黏膜炎的发生密切相关。例如,缺乏二氢嘧啶脱氢酶的患者患CIOM的风险更高[3,7, 8]。
3.肿瘤因素:肿瘤类型和发生的部位、分期、分级,均与口腔黏膜炎的发生风险和严重程度相关。例如,造血系统恶性肿瘤患者患RIOM/CIOM的风险及严重程度均增加[3, 4]。
4.治疗相关因素:放疗技术、分割模式、放疗剂量、是否联合化疗和(或)分子靶向药物,均可影响RIOM/CIOM的疾病分级。CIOM的治疗相关危险因素主要为药物的种类与剂量,如使用5-氟尿嘧啶、甲氨蝶呤、阿糖胞苷、依托泊苷等药物发生口腔黏膜炎的概率高于其他放疗药;治疗的剂量越大、周期越长、药物毒性越大,以及短时间、大剂量使用化疗药物等,均可使口腔黏膜炎发生的风险及严重程度增加[3,6, 7, 8, 9, 10]。
RIOM/CIOM发生率高和持续时间长的特征,决定了其预防与治疗必须贯穿于肿瘤治疗的全过程。有关RIOM/CIOM防治的指南和共识包括:《2020 MASCC/ISOO临床实践指南:癌症治疗继发性黏膜炎的管理》[11]、《2015 ESMO临床实践指南:口腔和胃肠道黏膜损伤的诊断,治疗和随访》[6]、《放射性口腔黏膜炎防治策略专家共识(2019)》[7]、《抗肿瘤治疗引起急性口腔黏膜炎的诊断和防治专家共识》[12]。前两个指南为目前国际公认的指导RIOM/CIOM治疗的临床指南,后两个共识则是以肿瘤学专家为主体、以国际指南为基础的RIOM/CIOM防治专家共识,上述4个指南与共识各有侧重,但无论如何,全周期、防治一体化的疾病管理,是RIOM/CIOM处置的基本原则。
良好口腔卫生可显著降低RIOM/CIOM的发生风险及严重程度,因此对患者进行口腔卫生知识宣教及自我口腔保健技术指导尤为重要。虽然在国外指南中,口腔卫生宣教由于证据不充分未形成指南条目,但国内外专家均认为对患者进行口腔卫生教育可提高肿瘤治疗期间患者对口腔护理方案的依从性,建议对RIOM/CIOM患者及时进行口腔卫生宣教[7,11, 12]。
口腔卫生宣教内容包括:①建议患者选购含氟非刺激性牙膏,选用刷头小、刷柄长度合适、宽度适中的软毛牙刷,刷毛末端应进行过磨圆处理,细软、柔韧易弯,减少对黏膜的刺激,同时牙刷应每月更换1次,防止细菌堆积;②建议患者每天餐后和睡前使用改良Bass刷牙法刷牙,应注意舌苔的清洁,有条件者可选用带有舌苔清洁器的牙刷或舌苔刷;③建议患者采取合适的牙间隙清洁工具,如牙线、牙间隙刷、电动冲牙器等,及时清除牙间隙滞留的食物残渣和菌斑,使用过程中应注意避免损伤牙龈和黏膜;④建议患者每天餐后使用漱口水,清除食物碎屑,每次含漱2~4 min,清洁使用的漱口水不应含有乙醇,推荐使用生理盐水、2%~4%碳酸氢钠等温和的漱口水;若使用药物漱口水,如抑菌类漱口水(如西吡氯铵含漱液、氯己定含漱液)和抗炎类漱口水(如地塞米松含漱液),应至少含漱1 min,每小时含漱1~2次,每次约15 ml,当口腔黏膜炎痊愈后应停止使用;⑤建议患者戒除烟草、酒精、槟榔等,避免对口腔黏膜产生不良刺激[13]。
肿瘤治疗前进行全面的口腔状况评估和处置有利于减少患者牙源性感染,虽然其在国外指南中证据不充分未能形成指南条目,但国内外专家均推荐在治疗前对肿瘤患者进行相应的口腔处置[7,11, 12]。
在放化疗开始前,首先应进行全面系统的口腔检查并对口腔内存在的可能危险因素及时治疗,消除潜在的口腔黏膜危害。①检查全口牙体及牙周状况,对龋病、牙髓病患牙进行充填和根管治疗,磨除尖锐的边缘嵴和牙尖,及时拔除松动和预后不佳、无保留价值的患牙;②检查口内固定和活动义齿,拆除不良修复体,检查活动义齿就位及固位情况,及时调改或更换设计、制作不当的活动义齿,还需要拆除放疗患者的金属全冠,放疗过程中摘除金属活动义齿;③检查患者唾液分泌功能,对唾液分泌较少的患者,可建议患者多喝水,也可使用口腔保湿剂或人工唾液、水溶性果冻等润滑口腔,维持口腔黏膜的湿润;④在肿瘤治疗开始前为患者制订合适的口腔保健方案,如进行系统的牙周治疗、定期复查口腔健康状况等[1,5,11,13]。
国内外的指南、共识均提出在肿瘤治疗期间维持营养健康是减轻口腔黏膜炎的关键之一[6, 7,12]。因此,在肿瘤患者的饮食与营养方面提出以下建议:①建议患者食用质地软、小块、易吞咽的食物,细嚼慢咽,避免过冷、过热及过硬、松脆的食物,防止损伤口腔黏膜;②建议患者多吃清淡、营养丰富的食物,少食多餐,荤素搭配,选择热量、蛋白含量、维生素含量高的软食或流食,如鸡蛋、牛奶、肉类、新鲜蔬菜水果等,确保肿瘤治疗过程中的营养支持,必要时可进行营养支持治疗;③建议患者尽量避免酸性和辛辣食物,减少对口腔黏膜的刺激和伤害[7,14]。
1.冷冻疗法:冷冻疗法可使浅表血管收缩,从而限制细胞毒性药物对口腔组织的作用,减少化疗药物对口腔黏膜的损伤,国内外指南、共识均推荐使用冷冻疗法用于预防CIOM[11]。由于冷冻时间较短,口腔冷冻疗法更适用于预防半衰期较短的化疗药物引起的口腔黏膜炎,如接受氟尿嘧啶类药物化疗的患者及干细胞移植前使用高剂量化疗的患者[11,15]。在化疗开始前5 min及化疗30 min内给予患者冰块口含,可以降低CIOM的发生率[3]。
2.低强度激光疗法:低强度激光治疗可减少口腔黏膜炎的发生,并有镇痛、抗炎作用[16]。使用低强度激光(波长:650 nm,功率:40 mW,组织能量剂量:2 J/cm2)治疗,可以预防口腔黏膜炎,在肿瘤治疗期间定期接受低强度激光治疗可降低口腔黏膜炎的严重程度[11]。国外指南与国内专家共识均推荐使用低强度激光疗法用于预防口腔黏膜炎[11, 12]。
非甾体抗炎药具有消炎、解热、镇痛作用,含有此类药物的漱口水,如卞达明漱口水,可迅速、暂时性缓解口腔或咽喉疼痛,国内外指南和共识均推荐使用[7,11, 12]。对于放化疗患者,应在进行放疗前一天开始使用,并在整个治疗期间及治疗后坚持使用,直至黏膜炎痊愈或明显改善[6]。
国外指南中建议使用锌补充剂以预防口腔黏膜炎,锌对上皮细胞的修复和增殖有重要作用,口服补锌有助于促进口腔黏膜上皮细胞增殖,可使用左旋肌肽锌漱口水漱口,4次/d,每次1 min以上,或口服左旋肌肽锌制剂[6,17]。
国外指南推荐口服左旋肌肽锌制剂或同时使用左旋肌肽锌漱口水(37 mg/dl)漱口,4次/d,每次1 min以上[6,17]。每日口服不高于10 g的谷氨酰胺[18],在放化疗前后使用纯天然蜂蜜直接涂抹于口腔或将其稀释后漱口,3次/d,均可缓解放化疗导致的口腔黏膜疼痛[19, 20]。
1.控制症状:疼痛是口腔黏膜炎患者最显著的症状,2020 MASCC/ISOO临床实践指南建议使用含吗啡的漱口水治疗口腔黏膜炎引起的疼痛;除吗啡以外国内专家共识推荐利多卡因漱口水、阿片类药物、口腔黏膜保护剂、激素类药物和中医中药制剂均可用于缓解患者的疼痛症状[7,11, 12]。
口腔黏膜保护剂如别嘌呤醇、前列腺素E2、维生素E等也有缓解口腔黏膜疼痛的作用。别嘌呤醇作为自由基清除剂,可清除活性氧,抑制细胞对氟尿嘧啶的特异性激活;前列腺素E2可缩短再上皮化的时间;维生素E具有抗氧化和膜稳定的作用[3]。
糖皮质激素类药物具有减轻黏膜水肿、抑制炎症反应、缓解疼痛的作用,可使用0.1%曲安奈德口腔软膏涂布于溃疡处或含0.3 mg的醋酸地塞米松口腔贴片贴于溃疡处[21]。但长期使用糖皮质激素类药物可增加口腔真菌感染的风险,应控制其用量和时间。
现代中药复方制剂,包括双花百合片、口炎清颗粒和康复新液等,均可在一定程度上降低口腔黏膜炎的严重程度和缓解疼痛[22]。
对于严重的RIOM/CIOM患者,可以结合患者具体情况,给予口服非甾体类消炎镇痛药,例如洛索洛芬钠片(60 mg,3次/d);必要时可使用经皮芬太尼、吗啡等止痛药,以及使用抗焦虑药[14]。
2.促进愈合:促进愈合是口腔黏膜炎治疗的主要目标,2020 MASCC/ISOO临床实践指南推荐静脉注射人角质形成细胞生长因子用于预防口腔黏膜炎,在治疗前3天和后3天使用,每天剂量为60 μg/kg[11,23]。国内专家共识推荐细胞因子类药物局部或全身使用治疗口腔黏膜炎,如局部喷涂重组牛碱性成纤维细胞成长因子[7,11, 12]。
3.控制感染:感染是RIOM/CIOM最常见的并发症之一。国外临床指南对抗菌药物的使用未形成推荐意见,国内专家共识建议在微生物培养及药物敏感试验结果的指导下使用抗感染药物[7,11, 12]。
若RIOM/CIOM患者继发感染应给予局部或全身抗感染治疗[24]。广谱的局部用药包括0.12%~0.2%氯己定含漱液、3%过氧化氢含漱液、0.1%西吡氯铵含漱液、0.5%聚维酮碘含漱液等。但应提前告知患者长期使用氯己定漱口可使舌苔及牙齿变色。对于念珠菌感染,局部应用碳酸氢钠含漱液含漱,必要时全身应用氟康唑(0.1 g,1次/d)1~2周;对于单纯疱疹感染,局部用含有利多卡因的含漱液,全身可应用阿昔洛韦(0.2 g,1次/5 h)或泛昔洛韦(0.125 g,2次/d)等抗病毒药物;对于细菌感染,根据药敏结果合理选用抗生素,可联合应用广谱抗生素和替硝唑。
4.情感关怀:临床研究发现49%的头颈部肿瘤患者患有抑郁症,而RIOM/CIOM的发生可引发或加剧患者的精神和心理问题[25]。因此,国内专家共识强调心理治疗在口腔黏膜炎防治中的重要作用[7,12]。口腔医师应对RIOM/CIOM患者进行积极、适度的心理干预。在接诊时应注意心理疏导,积极与患者沟通,帮助其了解口腔黏膜炎是抗肿瘤治疗过程中常见的并发症,可防可治可控,治疗结束后可痊愈;帮助患者克服恐惧心理,积极面对肿瘤治疗过程中的不适症状,促进其坚持抗肿瘤治疗。
RIOM/CIOM是头颈部放疗、恶性肿瘤化疗难以避免的并发症之一,是口腔医师不可回避的口腔疾病。为履行医师的神圣职责、减缓肿瘤患者的痛苦,口腔医师应对RIOM/CIOM高度重视,早期介入,放化疗前实施积极的口腔预防措施,放化疗过程中密切观察、准确诊断、及时处置,减轻症状、促进愈合、防治继发感染,阻止RIOM/CIOM进一步发展,关注患者心理健康,提高患者生存质量,确保恶性肿瘤放化疗的顺利进行。
所有作者声明不存在利益冲突
1.口腔黏膜炎的危险因素不包括()
A.放射线的刺激
B.化疗药物的毒性作用
C.烟酒刺激
D.口腔卫生状况差
2.放化疗治疗患者在接受治疗前应进行的检查包括()
A.牙体的形态
B.唾液腺分泌功能
C.义齿固位和就位状况
D.松动牙数量
E.以上都是
3.口腔黏膜炎的治疗措施包括()
A.控制感染
B.减轻疼痛
C.促进黏膜愈合
D.心理疏导
E.以上都是
4.放化疗患者牙刷更换周期为()
A.1个月
B.2个月
C.3个月
D.半年
5.下列哪种漱口水没有镇痛作用()
A.多虑平漱口水
B.卞达明漱口水
C.吗啡漱口水
D.聚维酮碘漱口水



























