
探讨转化治疗后手术切除和直接手术切除对转移性胰腺神经内分泌肿瘤(PanNET)的疗效。
回顾性收集2010年 1月至2021年5月在复旦大学附属肿瘤医院手术治疗的转移性PanNET患者的病理资料和预后信息,分析其临床病理因素和预后的关系。并采用倾向评分匹配分析接受转化治疗后手术与直接手术的预后差异。
共纳入转移性PanNET患者101例,其中男58例,女43例,年龄18~74岁,中位年龄51岁。其中88例术式为原发灶联合肝转移灶切除,12例为原发灶联合其他器官或肝外转移灶切除,1例为原发灶切除。多因素分析显示,R2切除(HR=1.943,95%CI:1.262~2.990,P=0.003)及G3分级(HR=1.876,95%CI:1.001~3.516,P=0.05)为转移性患者术后进展的独立危险因素。63例(62.4%)患者直接手术,38例(37.6%)接受术前转化治疗。转化治疗组比直接手术组有更高比例的T3/T4期(68.1% 比39.7%,P=0.007)、联合器官与肝外转移切除术式(26.3% 比9.5%,P=0.005)及R2切除(71.1% 比42.9%,P=0.005)。转化治疗组和直接手术组的中位无进展生存期(mPFS)差异无统计学意义(P>0.005),但倾向评分重新匹配后,转化治疗组的mPFS优于直接手术组(HR=0.442,95%CI:0.207~0.943,P=0.027)。
转移性PanNET行转化治疗再手术切除患者预后优于直接手术,切缘和分级是影响转移性PanNET预后的独立危险因素。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
神经内分泌瘤(neuroendocrine tumor,NET)是一类异质性很强的肿瘤,它可以起源于全身的各个器官,胰腺NET(pancreatic NET,PanNET)是中国NET发病率最高的器官[1]。根据Ki-67指数和核分裂象可以将PanNET分为G1、G2和G3。根据分期和能否手术切除可以将PanNET分为局限期、临界可切除、局部进展期和晚期转移性。对于转移性PanNET能否直接手术切除仍需要综合评估原发灶部位、生物学行为和肿瘤负荷,由多学科协作组(multi-disciplinary team,MDT)给予综合治疗方案。系统药物治疗(如靶向药物、化疗药物等)是控制转移性PanNET疾病进展和降低瘤负荷的主要手段,对于部分肝转移PanNET可首选手术切除,包括根治性切除和减瘤手术,肝转移性PanNET行减瘤手术(切除瘤负荷70%~90%)仍有利于患者的预后[2, 3]。因此肝转移PanNET经系统治疗后手术切除或直接手术切除是临床中常面临的不同治疗决策,本研究对于肝转移PanNET行系统药物治疗后再行手术切除与直接手术切除的疗效进行倾向评分匹配分析的比较。
回顾性队列研究。收集2010年1月至2021年5月在复旦大学附属肿瘤医院胰腺外科行手术治疗的转移性PanNET患者,根据术前有无转化治疗分成转化治疗后手术组和直接手术组。纳入标准:(1)原发灶为胰腺;(2)病理记录均出自复旦大学附属肿瘤医院病理科;(3)组织病理学证实为NET;(4)由MDT制定治疗方案。排除标准:(1)未行手术治疗或只行探查或活检手术;(2)5年内患有其他恶性肿瘤或转移灶为其他病理类型;(3)疾病为遗传综合征的一部分,如多发内分泌肿瘤综合征等;(4)病理类型为混合性神经内分泌-非神经内分泌肿瘤。本研究符合《赫尔辛基宣言》原则及相关伦理要求。
每个患者收集的临床病理因素包括基本信息(年龄、性别)、功能性(有功能和无功能)、病理报告(T分期、N分期、肿瘤分级和分化)、远处转移的部位、生长抑素受体成像(包括In111-奥曲肽显象或Ga68-PET/CT)、术前治疗及用药。肿瘤分期依据2017年美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版胰腺神经内分泌瘤TNM分期系统[4]。肿瘤分级和分化依据 2017年世界卫生组织(World Health Organization,WHO)消化系统肿瘤病理学分类[5]。
所有患者均通过门诊就诊或电话联系方式随访其治疗和预后,截止时间至2021年6月。总生存期(overall survival,OS)定义为从确诊到任何原因引起的死亡的时间。无进展生存期(progression-free survival,PFS)定义为从手术后到疾病进展或死亡的时间。在本院定期治疗和随访的患者每3~6个月接受一次增强CT或增强MRI的检查。在外院治疗复查的患者在电话随访中询问治疗和检查的结果。对于手术前后接受其他药物或局部治疗的患者,治疗药物的具体名称和使用时长均记录在数据集中。治疗疗效评估根据实体瘤反应评估标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1 版[6],定义为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)及疾病进展(progressive disease,PD)。
数据录入统一采用Microsoft Excel 2019软件,使用 SPSS 22.0软件对数据进行分析。采用率和频数描述定性资料,组间比较采用χ²检验。如有最小理论频数<1或总样本量<40,则用Fisher确切概率法。用Kaplan-Meier 法绘制疾病进展生存曲线,使用对数秩检验分析不同组间生存曲线之间的差异。使用Cox风险比例回归模型分析影响复发风险的危险因素,通过单因素分析确定有统计学意义者纳入多因素分析。采用倾向评分匹配方法对转化治疗组与直接手术组患者进行匹配,均衡两组之间的混杂因素。以是否转化治疗为因变量,以转化治疗组与直接手术组差异有统计学意义的临床病理因素(T分期、是否根切、切除范围)为自变量,通过logistic回归模型计算每例患者的倾向评分,抽样方式为不放回抽样,匹配方式为最优化执行性能及抽取匹配项时随机排列个案顺序,随机数种子为123456。以1∶1的比例匹配转化治疗组和直接手术组,卡钳值(匹配容差)设为0.02。双侧检验,检验水准α=0.05。
共纳入符合条件的转移性PanNET患者101例,患者中位年龄为51岁(18~74岁),其中男58例、女43例,男女比例为1.35∶1。其中4例(3.9%)为功能性PanNET,包括3例胰岛素瘤和1例胃泌素瘤;其余均为无功能性PanNET。G1、G2和G3级分别为9例(8.9%)、69例(68.3%)和23例(22.8%)。T2和T3期患者占多数,分别为38例(37.6%)和42例(41.6%);N1和N0的患者分别为51例(50.5%)和48例(47.5%)。
根据是否行术前转化治疗,将所有患者分成直接手术组(63例)和转化治疗后手术组(38例)。表1总结了两组患者的临床病理特征。转化治疗组有更高比例的不良危险因素和扩大手术切除,包括T3/T4分期(68.1%比39.7%,P=0.007),联合器官与肝外转移切除(26.3% 比9.5%,P=0.005),以及R2切除(71.1%比42.9%,P=0.005)。此外,转化治疗组的G3患者比例和胰头颈原发灶的比例也高于直接手术组,但差异无统计学意义(31.6%比17.5%,P=0.101;31.6% 比19%,P=0.164)。
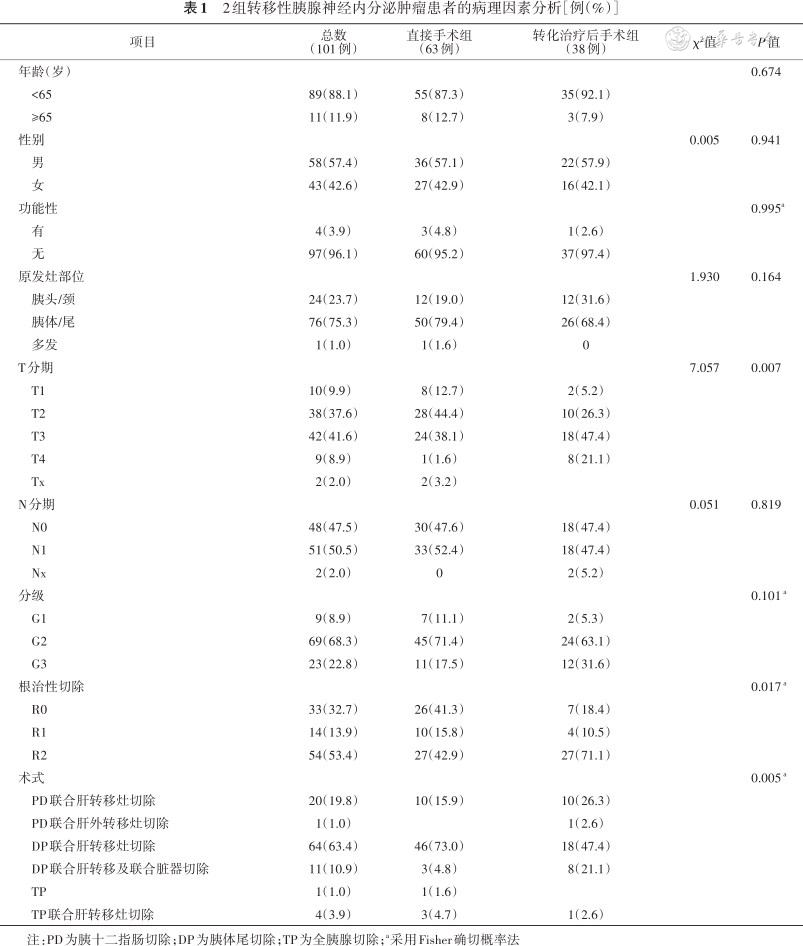
2组转移性胰腺神经内分泌肿瘤患者的病理因素分析[例(%)]
2组转移性胰腺神经内分泌肿瘤患者的病理因素分析[例(%)]
| 项目 | 总数 (101例) | 直接手术组 (63例) | 转化治疗后手术组 (38例) | χ²值 | P值 |
|---|---|---|---|---|---|
| 年龄(岁) | 0.674 | ||||
<65 | 89(88.1) | 55(87.3) | 35(92.1) | ||
≥65 | 11(11.9) | 8(12.7) | 3(7.9) | ||
| 性别 | 0.005 | 0.941 | |||
男 | 58(57.4) | 36(57.1) | 22(57.9) | ||
女 | 43(42.6) | 27(42.9) | 16(42.1) | ||
| 功能性 | 0.995a | ||||
有 | 4(3.9) | 3(4.8) | 1(2.6) | ||
无 | 97(96.1) | 60(95.2) | 37(97.4) | ||
| 原发灶部位 | 1.930 | 0.164 | |||
胰头/颈 | 24(23.7) | 12(19.0) | 12(31.6) | ||
胰体/尾 | 76(75.3) | 50(79.4) | 26(68.4) | ||
多发 | 1(1.0) | 1(1.6) | 0 | ||
| T分期 | 7.057 | 0.007 | |||
T1 | 10(9.9) | 8(12.7) | 2(5.2) | ||
T2 | 38(37.6) | 28(44.4) | 10(26.3) | ||
T3 | 42(41.6) | 24(38.1) | 18(47.4) | ||
T4 | 9(8.9) | 1(1.6) | 8(21.1) | ||
Tx | 2(2.0) | 2(3.2) | |||
| N分期 | 0.051 | 0.819 | |||
N0 | 48(47.5) | 30(47.6) | 18(47.4) | ||
N1 | 51(50.5) | 33(52.4) | 18(47.4) | ||
Nx | 2(2.0) | 0 | 2(5.2) | ||
| 分级 | 0.101 a | ||||
G1 | 9(8.9) | 7(11.1) | 2(5.3) | ||
G2 | 69(68.3) | 45(71.4) | 24(63.1) | ||
G3 | 23(22.8) | 11(17.5) | 12(31.6) | ||
| 根治性切除 | 0.017 a | ||||
R0 | 33(32.7) | 26(41.3) | 7(18.4) | ||
R1 | 14(13.9) | 10(15.8) | 4(10.5) | ||
R2 | 54(53.4) | 27(42.9) | 27(71.1) | ||
| 术式 | 0.005 a | ||||
PD联合肝转移灶切除 | 20(19.8) | 10(15.9) | 10(26.3) | ||
PD联合肝外转移灶切除 | 1(1.0) | 1(2.6) | |||
DP联合肝转移灶切除 | 64(63.4) | 46(73.0) | 18(47.4) | ||
DP联合肝转移及联合脏器切除 | 11(10.9) | 3(4.8) | 8(21.1) | ||
TP | 1(1.0) | 1(1.6) | |||
TP联合肝转移灶切除 | 4(3.9) | 3(4.7) | 1(2.6) |
注:PD为胰十二指肠切除;DP为胰体尾切除;TP为全胰腺切除;a采用Fisher确切概率法
根据原发灶部位不同,将所有患者分成3类,24例(23.8%)原发灶位于胰头颈,所行手术包括20例胰十二指肠切除术(pancreaticoduodenectomy,PD)联合肝转移切除及术中肝转移灶射频消融,1例PD联合肝转移及盆腔转移灶切除,3例全胰腺切除术(total pancreatectomy,TP)联合肝转移灶切除。76例(75.2%)原发灶位于胰体尾,所行手术包括64例远端胰腺切除术(distal pancreatectomy,DP)联合肝转移切除及术中肝转移灶射频消融,1例TP,11例DP联合肝转移灶及其他组织器官或肝外转移灶扩大切除,器官涉及门静脉人工血管置换,胃部分切除,结肠部分切除,小肠部分切除,盆腔肿瘤切除,肾上腺切除,腹壁转移结节及肠系膜转移结节切除。1例(1%)原发灶为胰腺多发(胰头,胰体),行TP联合肝转移灶切除。
转化治疗组在术前接受药物治疗,包括8例(21.1%)生长抑素类似物(somatostatin analogs,SSA),21例(55.2%)卡培他滨联合替莫唑胺(CAPTEM)方案和9例(23.7%)肝脏局部介入/射频消融。其中疗效评估18例(47.4%)为PR,20例(52.6%)SD;术后治疗类型包括SSA、CAPTEM、舒尼替尼和肝局部治疗。直接手术组患者术前无任何治疗直接手术切除,术后有17例无治疗,6例行舒尼替尼,9例行肝局部治疗联合SSA,8例行CAPTEM方案,23例行SSA治疗。
整体人群的术后中位PFS(median PFS,mPFS)为15个月,其中转化治疗组和直接手术组的mPFS分别为20个月和15个月,差异无统计学意义(HR=0.75,95%CI:0.421~1.335,P=0.564,图1A)。因转化治疗后手术的患者具有更多不良危险因素,两组临床病理因素不均衡,采用倾向评分匹配平衡混杂因素,共有40例配对患者,匹配后的患者基线特征见表2。匹配后的转化治疗组和直接手术组的mPFS分别22个月和12个月,转化治疗组的mPFS显著长于直接手术组(HR=0.442,95%CI;0.207~0.943,P=0.027,图1B)。在转化治疗组的术前治疗评估中,PR亚组的mPFS优于SD亚组,分别为20个月和12个月(HR=0.517,95%CI:0.194~2.381,P=0.032,图1C)。
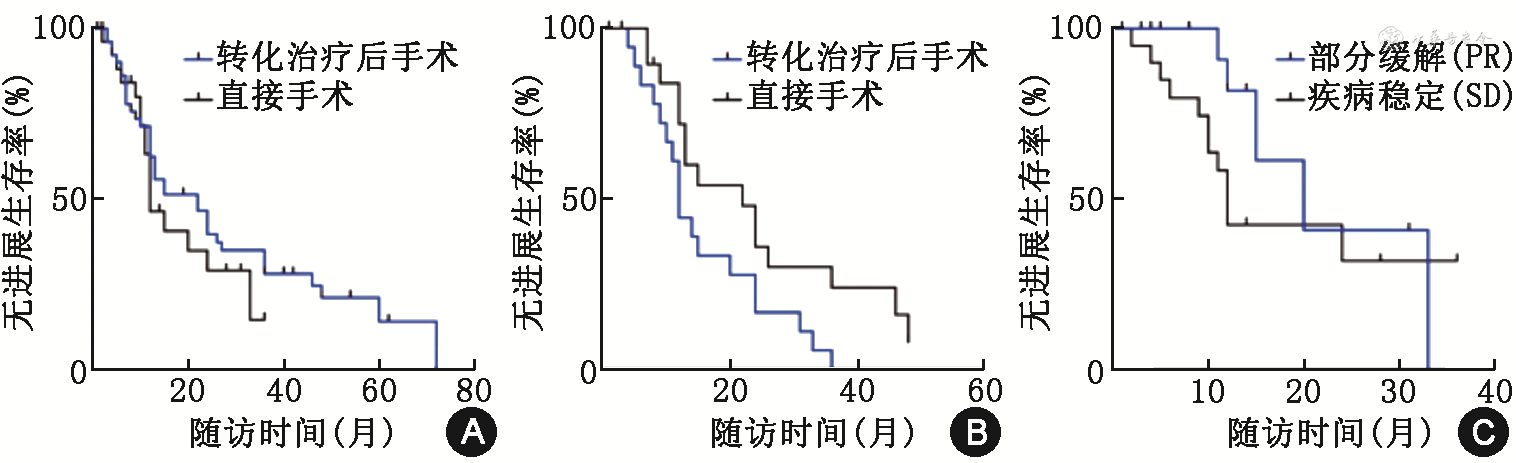

倾向评分匹配后2组转移性胰腺神经内分泌肿瘤患者的病理因素分析
倾向评分匹配后2组转移性胰腺神经内分泌肿瘤患者的病理因素分析
| 项目 | 直接手术组(例) | 转化治疗后手术组(例) | χ²值 | P值 | 项目 | 直接手术组(例) | 转化治疗后手术组(例) | χ²值 | P值 | |||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 功能性 | 卡钳匹配法 | 0.104 | 0.746 | |||||||||
匹配前 | 0.095 | N0 | 9 | 7 | ||||||||
有 | 3 | 1 | N1 | 11 | 13 | |||||||
无 | 60 | 37 | 分级 | |||||||||
卡钳匹配法 | 1.000 | 匹配前 | 2.190 | 0.139 | ||||||||
有功能 | 0 | 0 | G2 | 45 | 24 | |||||||
无功能 | 20 | 20 | G3 | 11 | 12 | |||||||
| 原发灶部位 | 卡钳匹配法 | <0.001 | 1.000 | |||||||||
匹配前 | 1.930 | 0.164 | G2 | 17 | 17 | |||||||
胰头/颈 | 12 | 12 | G3 | 3 | 3 | |||||||
胰体/尾 | 50 | 26 | 是否根治性切除 | |||||||||
卡钳匹配法 | <0.001 | 0.301 | 匹配前 | 5.525 | 0.017 | |||||||
胰头/颈 | 8 | 4 | R0 | 26 | 7 | |||||||
胰体/尾 | 12 | 16 | R1 | 10 | 4 | |||||||
| T分期 | R2 | 27 | 27 | |||||||||
匹配前 | 7.057 | 0.007 | 卡钳匹配法 | 0.143 | 0.704 | |||||||
T1 | 8 | 2 | R0 | 5 | 4 | |||||||
T2 | 28 | 10 | R1 | 1 | 3 | |||||||
T3 | 24 | 18 | R2 | 14 | 13 | |||||||
T4 | 1 | 8 | 术式 | |||||||||
卡钳匹配法 | 1.000 | 匹配前 | 4.848 | 0.027 | ||||||||
T1 | 1 | 1 | PD联合肝转移灶切除 | 10 | 10 | |||||||
T2 | 6 | 6 | DP联合肝转移灶切除 | 46 | 18 | |||||||
T3 | 12 | 12 | DP联合肝转移及联合脏器切除 | 3 | 8 | |||||||
T4 | 1 | 1 | 卡钳匹配法 | <0.001 | 1.000 | |||||||
| N分期 | PD联合肝转移灶切除 | 6 | 2 | |||||||||
匹配前 | 0.051 | 0.819 | DP联合肝转移灶切除 | 11 | 15 | |||||||
N0 | 30 | 18 | DP联合肝转移及联合脏器切除 | 3 | 3 | |||||||
N1 | 33 | 18 | ||||||||||
注:PD为胰十二指肠切除;DP为胰体尾切除
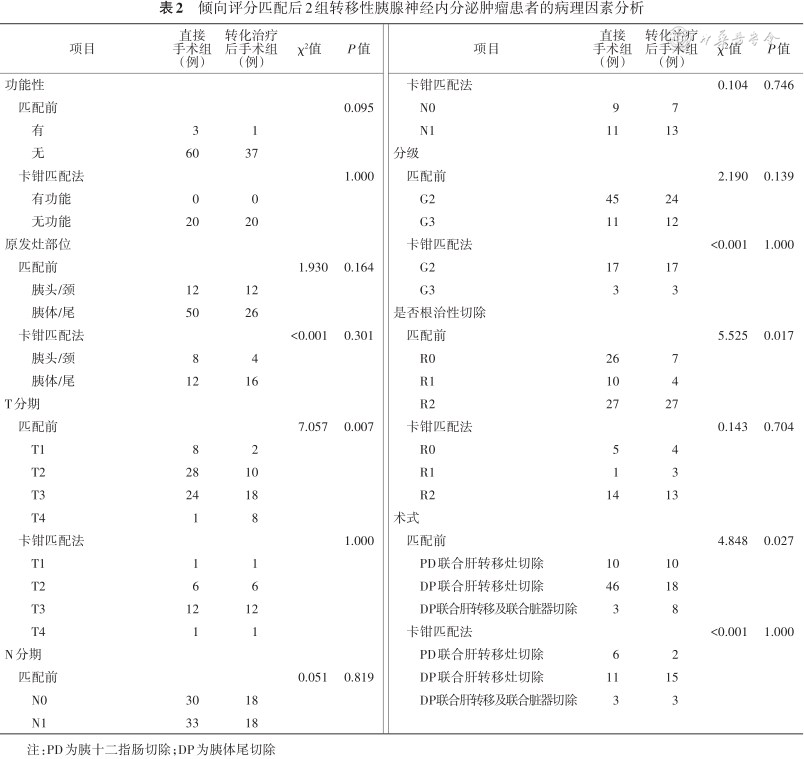
单因素分析影响预后的因素,是否根治性切除分为R0切除(33例,32.7%)、R1切除(14例,13.9%)和R2切除(54例,53.4%),mPFS分别为36、33和12个月,R0和R1切除的mPFS明显长于R2切除(HR=0.330,95%CI:0.188~0.588,P=0.001,图2A)。G1和G2的mPFS明显长于G3,差异有统计学意义(72个月、22个月比11个月,HR=0.458,95%CI:0.245~0.857,P=0.017,图2B)。原发灶位于胰头颈的mPFS未达到,原发灶位于胰体尾的mPFS为15个月,差异有统计学意义(P=0.037)(图2C,表3)。多因素分析显示R2切除(HR=1.943,95%CI:1.262~2.990,P=0.003)及G3(HR=1.876,95%CI:1.001~3.516,P=0.05)是转移性PanNET术后进展的独立危险因素。
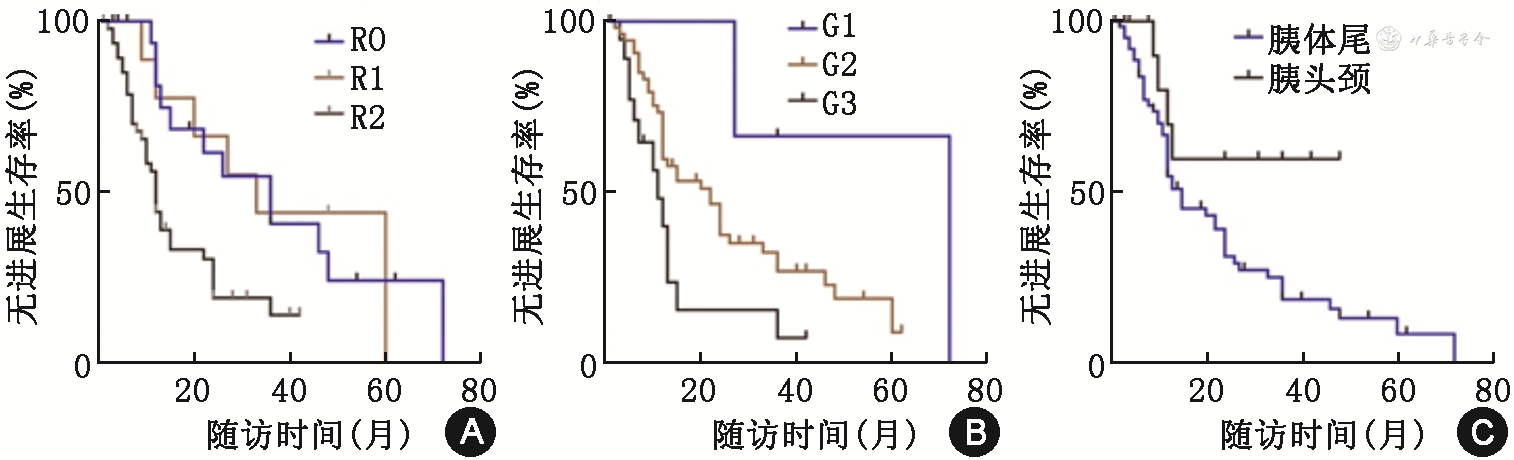

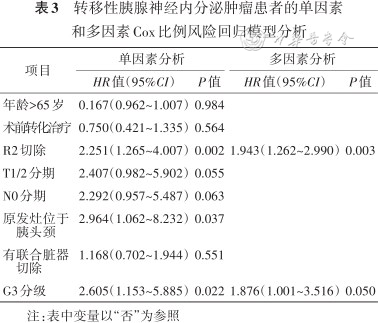
转移性胰腺神经内分泌肿瘤患者的单因素和多因素Cox比例风险回归模型分析
转移性胰腺神经内分泌肿瘤患者的单因素和多因素Cox比例风险回归模型分析
| 项目 | 单因素分析 | 多因素分析 | ||
|---|---|---|---|---|
| HR值(95%CI) | P值 | HR值(95%CI) | P值 | |
| 年龄>65岁 | 0.167(0.962~1.007) | 0.984 | ||
| 术前转化治疗 | 0.750(0.421~1.335) | 0.564 | ||
| R2切除 | 2.251(1.265~4.007) | 0.002 | 1.943(1.262~2.990) | 0.003 |
| T1/2分期 | 2.407(0.982~5.902) | 0.055 | ||
| N0分期 | 2.292(0.957~5.487) | 0.063 | ||
| 原发灶位于胰头颈 | 2.964(1.062~8.232) | 0.037 | ||
| 有联合脏器切除 | 1.168(0.702~1.944) | 0.551 | ||
| G3分级 | 2.605(1.153~5.885) | 0.022 | 1.876(1.001~3.516) | 0.050 |
注:表中变量以“否”为参照
手术是PanNET的主要治疗手段,对于能完整切除的肿瘤建议首选手术切除,包括局部进展期和远处转移性PanNET。但局部进展期和远处转移PanNET常因肿瘤侵犯邻近器官或肿瘤负荷大,造成手术困难或手术范围扩大,或者无法达到根治性切除。在这种情况下,手术是否能给PanNET带来获益是临床研究的热点。本研究对转移性PanNET患者行手术治疗的疗效做回顾性总结,发现R2切除和G3是影响转移性PanNET预后的独立危险因素;且对部分患者转化治疗比直接手术有获益。
欧洲神经内分泌肿瘤学会(European Neuroendocrine Tumour Society,ENETS)指南认为,扩大范围联合器官的根治性切除或血管重建对PanNET可能获益[2]。同时对肝转移患者可行减瘤手术,但不推荐有肝外转移的患者行手术,亦不推荐原发灶位于胰头的转移性PanNET行原发灶切除。2021版美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南指出,对于肿瘤负荷较小或SD的患者可短期观察,对肝脏为主的转移患者可行肝脏局部治疗或细胞减灭术[4]。本研究中,10%的患者行扩大范围联合器官切除或血管切除重建,同时有21例胰头原发灶行PD联合转移灶切除,未发现PD联合转移灶切除或扩大联合切除对患者预后的不良影响。
术前转化治疗是否增加转移性PanNET的手术疗效也是临床讨论的热点。回顾性研究显示新辅助卡培他滨联合替莫唑胺的方案在局部进展期或转移性PanNET患者,13例(43%)达PR,16例(54%)达SD。26例(87%)患者接受了手术切除,中位PFS为28.2个月,5年OS率为63% [7]。此外术前行链脲霉素为基础的化疗对比单纯手术可明显地提高OS和RFS[8]。但另一项研究将治疗后手术与直接手术的NET匹配评分后,两者之间的的生存预后无区别[9]。本研究中有36.6%的患者接收术前治疗,其中47.4%达PR。但转化治疗组患者具有更多的不良危险因素,包括更多比例的T3/T4期患者,扩大手术切除范围和R2切除;此外G3级比例在转化治疗组中也偏高。这些不良危险因素可能解释在整体人群比较时转化治疗组与直接手术组的mPFS无差异。运用倾向评分匹配的统计学方法平衡两组患者的临床病理因素,匹配后的数据显示转化治疗组的mPFS显著长于直接手术组,同时发现转化治疗达PR的患者预后优于SD的患者。对于部分PanNET患者,手术前转化治疗对患者的预后有利。但因为配对数较少,还需要更多数据阐明适合转化治疗的转移性PanNET类型。
PanNET的惰性生物学行为使手术在转移性PanNET中有很重要的作用,因此手术最大获益患者群的选择也存在很多争议。有研究认为只行原发灶切除仍能带来PanNET患者的预后获益[10]。甚至原发灶切除术对转移性PanNEC的OS延长也有显著获益[11]。但另一项SEER数据库的回顾性研究认为并非所有转移性PanNET老年患者都能从原发灶切除中获益。其中65~74岁的患者可能从原发灶切除中获益[12]。本研究中对原发灶切除做了尝试,但仅为个例。术后复发预测模型可以评估适合手术的转移性PanNET个体。肝转移灶根治性切除术后的预测复发模型的相关研究显示,肿瘤分级、淋巴结转移和根治性切除是无复发生存的独立因素[13]。另一研究显示PanNET肝脏转移性切除后与无复发生存期相关的独立危险因素是Ki67指数和切除肿瘤数量。当Ki67指数>5%且切除肿瘤个数≥6时RFS更差[14]。本研究的多因素分析显示R2切除及G3为转移性患者术后进展的独立危险因素。
综上,本研究针对单中心的转移性PanNET手术的预后显示,转化治疗较直接手术对部分转移性PanNET更有获益。是否根治切除和分级是影响转移性PanNET预后的独立危险因素。需全面评估患者的生物学行为和根治切除可行性,个体化判断手术对患者的获益。
所有作者均声明不存在利益冲突



























