
中枢神经系统孤立性纤维性肿瘤(SFT)是中枢神经系统少见肿瘤,近些年随着免疫组织化学及分子遗传学等技术的发展,对其认识逐渐加深,因而2021年WHO中枢神经系统肿瘤分类中SFT的命名及分级标准改变较大。本文根据近年来国内外文献报道,对中枢神经系统SFT的研究进展进行概述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,2022年从第1期至第10期共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
孤立性纤维性肿瘤(solitary fibrous tumor,SFT)是1870年Wagner首次于胸膜中发现并描述其组织学特征的一种间叶性肿瘤,1931年Klemperer和Rabin认为其起源于间皮细胞,是由间皮细胞向纤维母细胞分化的肿瘤,并正式列为一种独立的肿瘤实体[1]。后来逐步认识到SFT起源于纤维母细胞,相对不常见,其在全身各部位均可见,各年龄段均可发生,但好发于成人胸膜。中枢神经系统SFT少见,占所有中枢神经系统肿瘤不到1%,好发年龄40~60岁,男性稍多见,影像学上几乎均与脑膜相关,临床上常诊断为脑膜瘤,幕上最常见。临床表现与肿物发生部位相关,如头痛、肢体麻木或抽搐、视力下降等。中枢神经系统SFT复发率高,组织学上分为1~3级,患者具有不同预后。本文就近年来中枢神经系统SFT的研究进展做一综述。
一直以来SFT和血管外皮细胞瘤(hemangiopericytoma,HPC)二者被认为是不同的肿瘤实体。Zimmerman于1923年描述了一种位于血管周围的平滑肌样细胞,命名为血管周细胞(pericvte)。1942年Stout和Murray[2]报道一组由短梭形细胞组成的肿瘤,提示来源于血管周细胞,并命名为HPC。随后发现SFT与HPC在组织表型及生物学行为上具有一定的重叠,二者间的界限越来越模糊,HPC这个诊断名称受到质疑,有学者认为HPC从某种意义上讲更多地代表一种肿瘤细胞的生长模式[3],可见于多种肿瘤中,其中SFT最为常见。先前大多数诊断为HPC的病变并没有血管周细胞分化的证据,相反,本质上是纤维母细胞来源[4],HPC可能不再是一种独立的病变类型,因此2002年WHO第3版骨和软组织肿瘤分类将两者并列,命名为SFT/HPC,并认为两者可能起源于纤维母细胞,且HPC即便和SFT不是同一病变,也有密切关系。随后越来越多的文献报道这类病变,并显示出SFT具有宽泛的组织学谱系,2013年第4版骨和软组织肿瘤分类将SFT定义为一种常见的纤维母细胞性肿瘤,具有明显的HPC样分支状血管,同时取消了与SFT并列的HPC的命名,认为HPC只是SFT形态学谱系中的一个极端,而非单一肿瘤实体,应全部归为SFT[5]。
在中枢神经系统中,Begg和Garret[6]1954年首次报道脑膜HPC,Carneiro等[7]1996年首次报道了发生于脑膜的SFT。二者显微镜下表现均与软组织相应肿瘤一致。2011年Bouvier等[8]回顾性研究发现中枢神经系统SFT和HPC在临床、影像、病理特征方面均具有一定的重叠并建议将二者合并为同一肿瘤实体。近几年分子遗传学研究发现,SFT和HPC都具有相同的分子特征,即12q13的倒置、使NAB2和STAT6基因融合。这项结果也支持二者为同一肿瘤谱系[9]。因此2016年WHO中枢神经系统肿瘤分类第4版修订版将这两类疾病合并为SFT/HPC,定义为纤维母细胞源性的间叶性肿瘤,并分为3级[10]。2021年WHO中枢神经系统肿瘤分类去除了“HPC”这个术语,与软组织肿瘤病理诊断术语一样,将二者合并为SFT,依旧分为3个级别[11]。
SFT最初发现于胸膜,被称为“局灶性间皮瘤”,认为起源于间皮,是由间皮细胞向纤维母细胞分化的肿瘤[1]。随后发现SFT可以发生在与胸膜腔完全无关的其他部位[12]。随着免疫组织化学技术的应用,发现SFT表达CD34、波形蛋白等,且不表达间皮的标志物,推翻了先前间皮来源的认识[13]。此外超微结构研究发现肿瘤细胞具有丰富的粗面内质网、中间丝等纤维母细胞和血管周细胞的特点,以及介于二者之间的超微结构特点[14]。因此,推测SFT起源于树突状间叶细胞,该类细胞弥漫分布于人体结缔组织中,表达CD34,具有向纤维母细胞、肌纤维母细胞、血管外皮细胞及血管内皮细胞分化的特性。关于中枢神经系统SFT的起源,早年Cummings等[15]研究认为其起源于硬膜上边缘细胞层表达CD34的纤维母细胞,这层细胞附着在硬膜下方的蛛网膜上。因脉络丛间质包含蛛网膜基质成分和软脑膜,因此推测这可能是脑室内SFT发生的原因。然而Kim等[16]认为中枢神经系统SFT可能起源于脑血管间充质成分,因此关于中枢神经系统SFT起源还需进一步探明。
1.软组织SFT分级:2020年第5版WHO骨与软组织肿瘤分类将SFT分为:良性SFT、非特指型SFT和恶性SFT,ICDO编码分别为0、1和3。由于单纯的组织学分级对SFT的预后预测不够好,因此大量研究希望通过广泛整合临床及组织学指标来解决这个问题[17]。2020年第5版WHO骨与软组织肿瘤分类没有描述SFT的具体组织学分级标准,提倡的是SFT风险分层模型,因其更能准确地预测患者预后。2020年第5版WHO骨与软组织肿瘤分类采用的是由Demicco等[18]2012年提出并于2017年[17]进行修订的SFT风险分层模型。2012年Demicco等[18]基于对110例非中枢神经系统SFT转移率和生存率的研究,根据发病年龄、肿瘤大小及核分裂象计数(4/10 HPF为界)这3个变量的评分提出了SFT的预后危险度分级模型。2017年Demicco等[17]又对79例非中枢神经系统SFT进行预后分析,增加了坏死作为第4个变量,研究显示修订后的风险分层模型预后预测能力增强,根据4个变量评分结果分为高、中、低风险。
2.中枢神经系统SFT分级:2021年WHO中枢神经系统肿瘤分类将SFT定义为是一种纤维母细胞性肿瘤,在12q13位点存在基因组倒置,导致NAB2和STAT6基因融合以及STAT6核表达。软组织SFT风险分层模型并不适用于中枢神经系统SFT,多项研究显示中枢神经系统SFT患者年龄和肿瘤大小与预后无关,只有组织学中核分裂象和坏死是重要预后指标[19, 20]。2018年Fritchie等[19]对133例中枢神经系统SFT进行研究分析,他们依据2016年WHO中枢神经系统肿瘤分类和2013年WHO骨与软组织肿瘤分类中SFT的分级标准对这组SFT患者预后进行分析,提出中枢神经系统改良分级标准,1级:核分裂象<5/10 HPF;2级:核分裂象≥5/10 HPF不伴有坏死;3级核分裂象≥5/10 HPF同时伴有坏死。分析发现具有坏死指标的中枢神经系统改良分级显示出与无复发具有更高的相关性,因此作者根据他们的数据,提出核分裂象和坏死似乎可以更准确地对中枢神经系统SFT进行分层,并且可以纳入未来的分级方案。除了WHO分级,较多文献提到的中枢神经系统SFT分级系统还有Marseill分级体系。2012年Bouvier等[8]提出Marseill分级体系的3层/4层分级(Ⅰ级、Ⅱa级、Ⅱb级和Ⅲ级),将SFT/HPC与WHO分级一样,分为3级。主要评估的组织学标准有3点:(1)是否存在富于细胞区;(2)是否存在坏死;(3)核分裂象数。2018年Macagno等[20]更新了Marseill分级体系,去除了是否存在富于细胞的指标,与Fritchie等[19]提出的中枢神经系统SFT分级标准一致,只依据核分裂象及是否存在坏死。因此2021年WHO中枢神经系统肿瘤分类在SFT组织学分级中简化为以核分裂象(5/10 HPF为界)及坏死这两个指标来划分,具体如下:1级SFT核分裂象<5/10 HPF;2级SFT核分裂象≥5/10 HPF不伴有坏死;3级SFT核分裂象≥5/10 HPF同时伴有坏死。
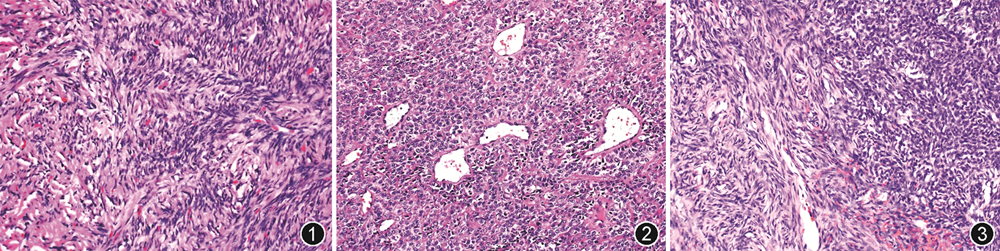
1.病理诊断:中枢神经系统SFT大体上常附着于硬膜上,呈类圆形或卵圆形,界限清楚,切面灰白色、灰褐色,质韧或质软,有时可伴有黏液变,恶性病例则常见出血、坏死和囊性变等。中枢神经系统SFT组织学形态与软组织SFT一样,低倍镜下,肿瘤可呈经典SFT形态(图1)、HPC形态(图2)或二者混合存在(图3)。经典SFT形态镜下表现常为疏密交替,呈“无结构”生长模式,肿瘤细胞梭形,形态温和,间质可见粗细不等的胶原纤维束及薄壁血管;经典HPC形态表现为细胞丰富、致密,大小相对一致,胞质少,核圆形、卵圆形,染色质细腻,间质富于鹿角状分支血管。除了典型的SFT或HPC组织学表现,个别病例可呈现罕见组织学形态,如乳头样、伴黑色素细胞分化[21]和脂肪化生等,少见情况间质可出现不同程度的黏液变、出血和囊性变。恶性病例常出现不典型表现,表现为细胞密度增加、异型性明显、核分裂象增多或坏死等。

2.免疫组织化学:同中枢神经系统外SFT,中枢神经系统SFT也表达CD34、CD99、波形蛋白和bcl-2。随着SFT特异性融合基因NAB2-STAT6的发现,多项研究显示STAT6免疫组织化学染色具有非常高的特异度及灵敏度,有助于SFT诊断,表达率高达96%以上[22]。ALDH1和GRIA2是近些年除STAT6之外提出的SFT特异性抗体。2013年Bouvier等[23]用全基因组寡核苷酸微阵列发现脑膜SFT/HPC中ALDH1A1基因过表达,84%的SFT和85.4%的HPC胞质表达ALDH1,而只有少量滑膜肉瘤和个别脑膜瘤表达。在Wu等[24]的研究中脑膜SFT ALDH1表达率为91%(61/67),同样在中枢神经系统外的SFT也特异性表达ALDH1。有研究称,STAT6细胞核阳性、ALDH1胞质阳性,是SFT鉴别诊断中最为灵敏和特异的组合标志物[25]。SFT基因表达谱分析显示GRIA2是SFT另一个高表达的基因,GRIA2编码一个AMPA选择性离子型谷氨酸受体亚基(即GLUR2),Vivero等[26]应用免疫组织化学染色方法对105例软组织SFT进行研究,显示84例(80%)表达GRIA2,因此GRIA2可作为SFT一种新的标志物。因此,联合采用这些抗体有助于SFT与其他肿瘤鉴别。2021年Wu等[24]无意中发现中枢神经系统乳头型SFT表达甲状腺转录因子1(TTF1),进而对中枢神经系统SFT、中枢神经系统外SFT和脑膜瘤进行TTF1表达情况研究,结果显示约34.3%的中枢神经系统SFT表达TTF1,中枢神经系统外SFT基本上不表达,除了3例腹膜后SFT弱表达,脑膜瘤全部不表达。因此提出TTF1有可能作为中枢神经系统SFT与中枢神经系统外SFT的鉴别突破点,但因病例数有限,不除外中枢神经系统外其他某些部位SFT也表达TTF1,还需更多实验数据进一步证实。
3.鉴别诊断:中枢神经系统SFT发生于硬膜,与发生于硬膜上的其他梭形细胞肿瘤在临床、影像学上具有很多共同点或相似点,因此需要与这些肿瘤鉴别,主要的鉴别诊断包括:(1)脑膜瘤,尤其是纤维型脑膜瘤:二者临床、影像学及组织学上有时极为相似,而沙砾体及旋涡状结构主要见于纤维型脑膜瘤,疏密交替及鹿角状血管主要见于SFT。除此之外在出现间质显著黏液变时,应与脊索样脑膜瘤鉴别,罕见情况下出现乳头状或假乳头状结构时应与乳头型脑膜瘤鉴别[27]。免疫组织化学有助于二者鉴别。(2)神经鞘瘤:中枢神经系统神经鞘瘤较常位于桥小脑角区和椎管内,经典神经鞘瘤组织学通常可见稀疏区和密集区,常伴出血、囊性变和组织细胞浸润,细胞核呈栅栏状排列,以束状为主时应和SFT相鉴别,免疫组织化学在二者形态学上难以鉴别时具有重要作用,神经鞘瘤通常弥漫表达S-100蛋白和SOX10,不表达STAT6、CD34等。
1.NAB2-STAT6基因融合:2013年,Robinson等[9]应用全基因组和二代测序分析发现,NAB2-STAT6基因融合为SFT的驱动突变基因,NAB2基因与STAT6基因均位于12q13,STAT6基因羧基端的反向激活区取代NAB2基因的阻遏区从而导致NAB2-STAT6基因的染色体臂内融合。脑膜SFT具有相似遗传学改变[28]。近几年研究发现NAB2和STAT6存在几种不同的融合位点,不同融合类型的SFT具有不同的临床病理特征。2015年Tai等[29]对73例SFT NAB2-STAT6融合状态分析发现,最常见的融合类型是NAB2基因的第4号外显子和STAT6基因的第2号外显子融合(NAB2ex4-STAT6ex2),约占46.6%(34/73),其次为NAB2ex6-STAT6ex16和NAB2ex6-STAT6ex17。相比较于后2种融合类型,NAB2ex4-STAT6ex2融合亚型明显与SFT的下列几项临床病理特征有关,包括胸腔内发生、发病年龄较大、广泛的纤维硬化性间质以及较少的核分裂象数,但与疾病的总体生存率的关系尚不明确[29]。在这项研究中的19例脑膜SFT仅2例为NAB2ex4-STAT6ex2融合,因此脑膜NAB2-STAT6融合类型与其他部位有所区别。2016年,Nakada等[30]回顾性分析了546例SFT并进行了NAB2-STAT6基因融合状态分析,其中452例阳性,检测到40多种融合类型。其中最常见的是NAB2ex6-STAT6ex16/17/18和NAB2ex4-STAT6ex2/3,前者最常见于脑膜、软组织和头颈部的SFT;后者在胸膜和肺的SFT中占主导地位。2018年Fritchie等[19]成功检测了99例脑膜SFT NAB2-STAT6融合类型,与Nakada等[30]研究一样,最常见的是NAB2ex5/6/7-STAT6ex16/17(n=60),其次是NAB2ex4- STAT6ex2/3(n=29),其余的融合类型分别为NAB2ex2- STAT6ex1/2(n=4),NAB2ex2/3-STAT6ex18(n=4),NAB2ex2- STAT6ex5(n=1)和NAB2ex7-STAT6ex1(n=1)。在这项研究中发现NAB2-STAT6融合类型与预后无关,但与表型有关,如NAB2ex4-STAT6ex2/3融合大部分显示SFT表型,而NAB2ex5/6/7-STAT6ex16/17融合大部分为中间表型或HPC表型。那么关于原发性和转移性SFT是否具有相同的融合类型,Singh等[31]使用逆转录聚合酶链反应(RT-PCR)和Archer融合面板在不同时间点对中枢神经系统原发性和转移性SFT进行检测,发现原发灶和转移灶具有相同的融合断点。分子遗传学检测NAB2-STAT6融合基因对于诊断SFT具有很高的灵敏度和特异度,但由于NAB2基因与STAT6基因均位于12q13,二者距离较近,荧光原位杂交(FISH)技术检测融合基因存在一定的困难,容易导致假阴性,推荐使用PCR检测和Sanger测序[32]。
2.其他分子改变:除了NAB2-STAT6基因融合之外,SFT高表达ALDH1[23]和GRIA2[27]基因。此外CDKN2A/p16基因纯合子缺失[33]和TERT启动子热点突变与SFT预后差密切相关[18],TP53缺失突变与SFT较短的无进展生存期相关[34],Apra等[35]发现了一个新的TP53突变位点,c.743G>T,与中枢神经系统SFT恶性转化有关。
所有作者声明无利益冲突
1.2021年WHO中枢神经系统SFT分级标准指标是()
A.核分裂象(4/10 HPF为界)和坏死
B.核分裂象(5/10 HPF为界)和异型性
C.核分裂象(5/10 HPF为界)和坏死
2.软组织SFT的预后危险度分级模型的4个变量是()
A.年龄、肿瘤大小、核分裂象和坏死
B.性别、年龄、肿瘤大小、核分裂象
C.部位、肿瘤大小、核分裂象和坏死
3.NAB2-STAT6基因融合为SFT的驱动突变基因,由于NAB2基因与STAT6基因均位于12q13,二者距离较近,推荐使用什么检测方法()
A.FISH技术和PCR检测
B.PCR检测和Sanger测序
C.FISH技术和Sanger测序
4.近几年研究发现NAB2和STAT6存在几种不同的融合位点,不同融合类型的SFT具有不同的临床病理特征,脑膜SFT最常见的融合类型是()
A.NAB2ex5/6/7-STAT6ex16/17
B.NAB2ex2-STAT6ex5
C.NAB2ex7-STAT6ex1
5.哪个抗体和STAT6是SFT鉴别诊断中最为灵敏和特异的组合标志物()
A.ALDH1
B.GRIA2
C.TTF1



























