
视神经脊髓炎谱系疾病(NMOSD)是免疫介导的中枢神经系统炎性脱髓鞘疾病,以视神经炎和脊髓炎为主要临床征象,病因主要与水通道蛋白4(AQP4)抗体相关,AQP4是免疫攻击的靶抗原。NMOSD以视神经炎、纵向延伸的长节段横贯性脊髓炎、延髓最后区综合征、脑干综合征、间脑综合征和大脑综合征等为临床特征。近年来在NMOSD的病因机制、临床诊断和新型作用靶点的单克隆抗体药物治疗等研究领域均获得长足进步,推动了临床神经病学的发展。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,2022年从第3期开始共刊发10篇继教文章,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。本年度继教答题得学分活动于10月31日结束。
视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)以前被称为视神经脊髓炎(neuromyelitis optica,NMO),是一种免疫介导的中枢神经系统(central nervous system,CNS)炎性脱髓鞘疾病,病变主要累及视神经和脊髓,水通道蛋白4(aquaporin-4,AQP4)抗体在免疫发病机制中起重要作用。
1894年,法国医生德维克(Devic)报道了他诊治的1例45岁女性患者,呈亚急性起病,出现视力障碍、双下肢瘫和尿潴留,死后尸检证实视神经和脊髓严重脱髓鞘和坏死病变。Devic复习了其他学者报道的16例类似病例后提出了NMO的概念,后来人们也称之为Devic病[1]。然而,Devic及许多学者都认为,英国医生、剑桥大学医学教授托马斯·奥尔巴特是描述NMO的第一人。1870年他在Lancet上发表了《脊髓病在检眼镜下的体征》一文,报道了1例患有急性脊髓炎的年轻男性患者,患者在约2个月后肌力逐渐好转时出现双眼周边视野明显缩小,中心视力保存,可见视盘变白、眼底血管变细,半年后随访视力障碍持续存在。
NMO在长达一个多世纪的时间里被认为是多发性硬化(multiple sclerosis,MS)的一个临床亚型,但一直存有争议。在脑脊液检查中就存在2个疑点,一是MS和NMO患者都可见脑脊液淋巴细胞增多(pleocytosis),但却有明显差异,MS的脑脊液单个核细胞(MNC)轻度增多,通常<15×106/L,以淋巴细胞为主;NMO的脑脊液-MNC增多明显,通常>50×106/L,中性粒细胞比例增高;二是采用等电聚焦法检测脑脊液寡克隆区带(OB),MS患者的阳性率约90%,而NMO患者的阳性率仅为15%~30%。20世纪80年代后MRI检查发现,NMO的脊髓病变是3个以上的长节段,MS通常为1个节段,不超过2个节段。在MRI证据的基础上,对比NMO与MS患者的临床特征,NMO多表现为严重截瘫或四肢瘫、感觉平面和尿便障碍,高颈髓病变可引起呼吸窘迫,频繁出现Lhermitte征、严重的痛性痉挛发作,预后相对较差。
1999年,梅奥医学中心(Mayo Clinic)的温格查克(Wingerchuk)医生回顾性分析了71例NMO患者的临床资料后,根据临床表现、MRI显示脊髓长节段病变和脑脊液-MNC数明显增高,指出了NMO与MS不同[2]。2004年,Mayo医学中心的神经免疫医学中心主任列侬(Lennon)等采用间接免疫荧光法在NMO患者血清中发现了高度特异性抗体NMO-IgG,并证实靶抗原是AQP4,AQP4在经典MS患者的血液中却不存在。最终确定NMO是与MS不同的独立疾病,这一发现是神经免疫研究领域的里程碑事件。2007年Wingerchuk等[3]提出了NMOSD的概念,2015年国际NMO诊断专家组(IPND)归纳了NMOSD的6组核心临床特征并制订了诊断标准[4]。
我国自1934年就有NMO的研究报道,1964年张沅昌与谭梅尊[5]在《中华神经精神科杂志》报道了32例NMO患者,至1982年我国共报道NMO病例150余例,经病理解剖者6例[1]。
目前NMOSD的流行病学研究并不多,与其发病率相对较低有关。小样本流行病学资料显示,NMOSD的患病率在世界各地区接近,约为(1~5)/10万,但在非白种人群如亚洲、拉丁美洲、非洲和北美洲(指美国原住民)等患病率较高。NMOSD和MS虽然都是特发性炎性脱髓鞘疾病,但在白种人中的构成比约为1∶100,在非白种人中约为40∶60[6]。NMOSD的发病率和患病率有明显的种族差异,在不同人群中的患病率不同。在以高加索人群构成为主的欧美国家[芬兰和美国(奥姆斯特德县)除外]相对少见,患病率比MS低50~100倍[7]。
NMOSD多在中年起病,儿童和老年人也可发生,中位发病年龄为39岁,约比MS晚10年。患者以女性多见,女性与男性患病比高达(9~11)∶1,晚发型患者也以女性居多。病程多为复发病程(80%~90%),单相病程约占10%。家族性病例罕见,少数患者有家族聚集现象(MS家族聚集现象相对较多),约占NMOSD患者的3%。NMOSD可伴发其他自身免疫病,如系统性红斑狼疮、干燥综合征、桥本甲状腺炎、重症肌无力等。
我国NMOSD的年均发病率为0.278/10万,其中成人为0.374/10万,儿童为0.075/10万[8]。我国的患病率目前尚未正式公布,女性患病率显著高于男性,在AQP4抗体阳性组中比例为9∶1,AQP4抗体阴性组的比例较为接近。
NMOSD是以体液免疫为主的CNS自身免疫病。Lennon的杰出贡献是从发现NMO患者血清NMO-IgG开始,进而证明靶抗原是AQP4。AQP4是视神经、脊髓、丘脑、海马和延髓最后区等部位中最主要的水通道蛋白,主要存在于构成血脑屏障的星形胶质细胞足突,紧邻脊髓中央管周围的室周区域毛细血管、软脑膜和Virchow-Robin间隙,介导水分子在细胞内、外跨膜转运,参与脑组织与血液和脑脊液之间的水转运和渗透压调节。AQP4-IgG抗体共定位是确认NMOSD的6组核心症状的理论和实验基础。抗AQP4抗体免疫攻击可引起这些部位的临床症状,如顽固呃逆、呕吐是延髓最后区症状,头晕、复视和共济失调等是脑干症状,严重嗜睡、中枢性高热和离子紊乱等是间脑症状。抗AQP4抗体(主要是IgG1亚型)与AQP4抗原特异性结合后,诱导表达AQP4的星形胶质细胞产生白细胞介素6(IL-6),IL-6可以降低血脑屏障功能;抗AQP4抗体依赖和补体依赖的细胞毒性作用,引起星形胶质细胞形态及功能发生相应变化,影响其对少突胶质细胞和神经元的支持及保护作用,之后发生包括T淋巴细胞、B淋巴细胞、巨噬细胞、中性粒细胞和嗜酸性粒细胞等炎性细胞浸润,最终导致少突胶质细胞损伤和髓鞘脱失。因此,NMOSD中出现的脱髓鞘是继发于星形胶质细胞损伤的结果。病变具有坏死和空洞的性质,影响白质和灰质,伴明显的血管增厚而较少炎性浸润。
视神经病变累及视神经和视交叉。脊髓病变多见于胸髓、颈髓,脑病变见于脑室周围、丘脑和延髓等AQP4分布密集区。脊髓白质显示脱髓鞘、硬化斑、局部坏死和空洞形成,可伴急性轴突损伤;可见血管周围炎性细胞如中性粒细胞及嗜酸性粒细胞浸润,IgG、IgM沉积和补体激活,AQP4及胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)丧失等。
NMOSD通常为急性或亚急性起病,可迅速进展,80%~90%为复发病程,临床事件间隔时间短则数日,长则数十年。少数为单相病程,例如孤立的视神经炎可存在数月至数年。同时或相继受累视神经炎和脊髓炎通常预示单相病程,即经典的NMO(但笔者也见过1例3次发作都是经典NMO,在1个月内先后出现视神经炎和脊髓炎,没有其他任何核心症状,每次发作间隔数年)。
NMOSD的核心症状包括6组[9],具体如下。
1.视神经炎:可为复发或单相病程,每次发作可为单眼、双眼相继或同时视力减退。通常起病较急,进展迅速,起病时视力模糊,在数小时或数日内视力丧失。发病前1~2 d多有眼痛,眼球活动或按压时明显。可出现视野缺损,常见中心暗点、视野向心性缩小、偏盲或象限盲等;也可见葡萄膜炎和视网膜静脉袖套形成,后者提示T细胞浸润。视力通常在1周内恢复,偶有数周、数月恢复者。部分病例疗效不佳,可能与光学相干断层扫描(OCT)检出视网膜神经纤维层(retinal nerve fiber layer,RNFL)平均厚度变薄有关。
2.急性脊髓炎:多数患者出现纵向延伸的长节段横贯性脊髓炎(longitudinally extensive transverse myelitis,LETM),病灶在3个椎体节段或以上,多为横贯性损害。多起病急,症状重,出现病变水平以下的截瘫、感觉障碍、尿便及性功能障碍,双侧Babinski征;部分早期病例脊髓受累长度可以短于3个椎体节段或不完全横贯受累。复发型脊髓炎常伴Lhermitte征、阵发性强直性痉挛和脊髓损害平面胸腹束带感或神经根痛,单相病程患者少见。颈髓病变可见Horner征,高颈髓病变可出现急性呼吸衰竭、低血压,这在MS患者中罕见。恢复期易发生阵发性痛性或非痛性痉挛、长期搔痒和顽固性疼痛。截瘫难以完全恢复,顽固性呃逆可能预示着病情急性恶化。
3.最后区综合征(area postrema syndrome):部分患者首次发作时或疾病某一阶段突出表现为顽固性呃逆、恶心、呕吐,MRI可见延髓最后区病灶。延髓最后区出现病变或与上颈髓病变连续或伴有脑室室管膜周围受累,并有顽固性呃逆等症状,对NMO高度特异。
4.急性脑干综合征:常见脑干和第四脑室周围病变,患者表现为头晕、复视和共济失调等。
5.急性间脑综合征:病变多位于下丘脑,出现困倦嗜睡、发作性睡病样表现、顽固性低钠血症、体温调节障碍等。
6.大脑综合征:主要是半球白质或胼胝体损害,表现为淡漠,反应迟缓,头痛,认知、语言等高级皮质功能减退,可出现可逆性后部白质脑病综合征或炎性假瘤样病变。
部分患者伴有其他自身免疫性疾病,如系统性红斑狼疮、干燥综合征、混合性结缔组织病、重症肌无力、甲状腺功能亢进、桥本甲状腺炎、结节性多动脉炎等,血清可检出抗核抗体、抗SSA/SSB抗体、抗心磷脂抗体等。
大多数NMOSD患儿的临床特征、MRI表现和实验室检查结果与成人相似,但女性患儿高发优势比成人低(3∶1)。由于约15%的MS患儿在复发期可能有LETM,LETM可伴发于单相急性播散性脑脊髓炎(ADEM),而在单相的NMOSD患儿中很少检出AQP4-IgG,儿童应用成人NMOSD标准须谨慎。总体来说,儿童NMOSD患者的预后要优于成人患者,但仍无法避免严重后遗症[10]。
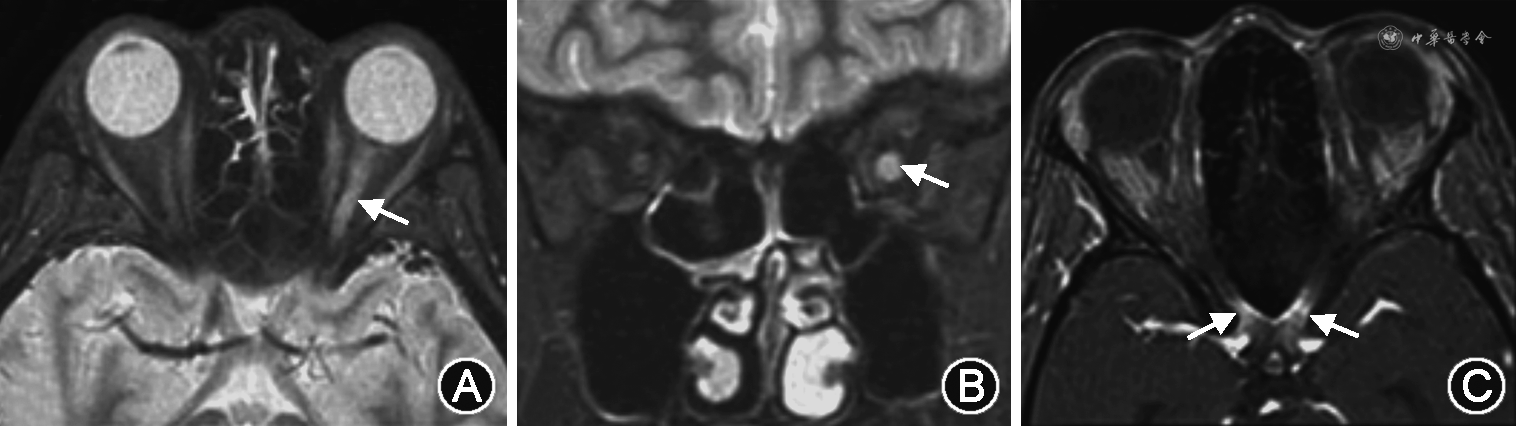
1.视神经炎:最易累及视神经后段和视交叉,病变节段可大于1/2的视神经长度。急性期可见视神经增粗、强化,部分伴视神经鞘强化。慢性期表现为视神经萎缩,形成双轨征(图1A~C)。

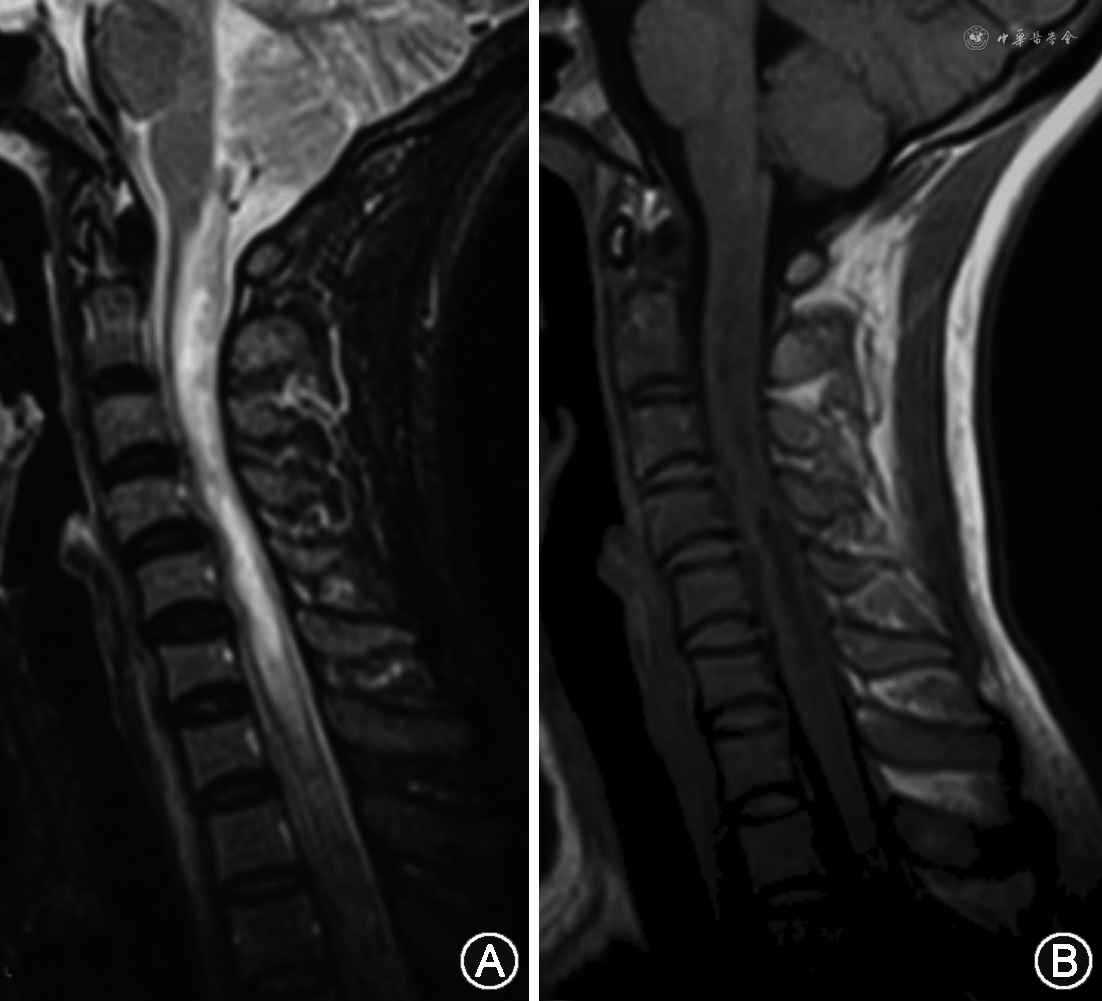
2.急性脊髓炎:MRI显示特征性脊髓纵向延伸的长节段横贯性损害,矢状位可见连续病变,超过3个或以上的椎体节段,少数病例几乎纵贯全脊髓,颈髓病变可向上与延髓最后区病变相连。轴位病变多累及中央灰质和部分白质,呈圆形或H型,后索易受累。急性期病变可见明显肿胀,呈长T1、长T2表现,增强后部分呈亮斑样或斑片样、线样强化,相应脊膜也可强化。慢性恢复期可见脊髓萎缩或空洞(仍需符合超过3个或以上的椎体节段;图2,3A~C)。长节段病变可转变为间断的不连续长T2信号。少数脊髓病变首次发作可<2个椎体节段。



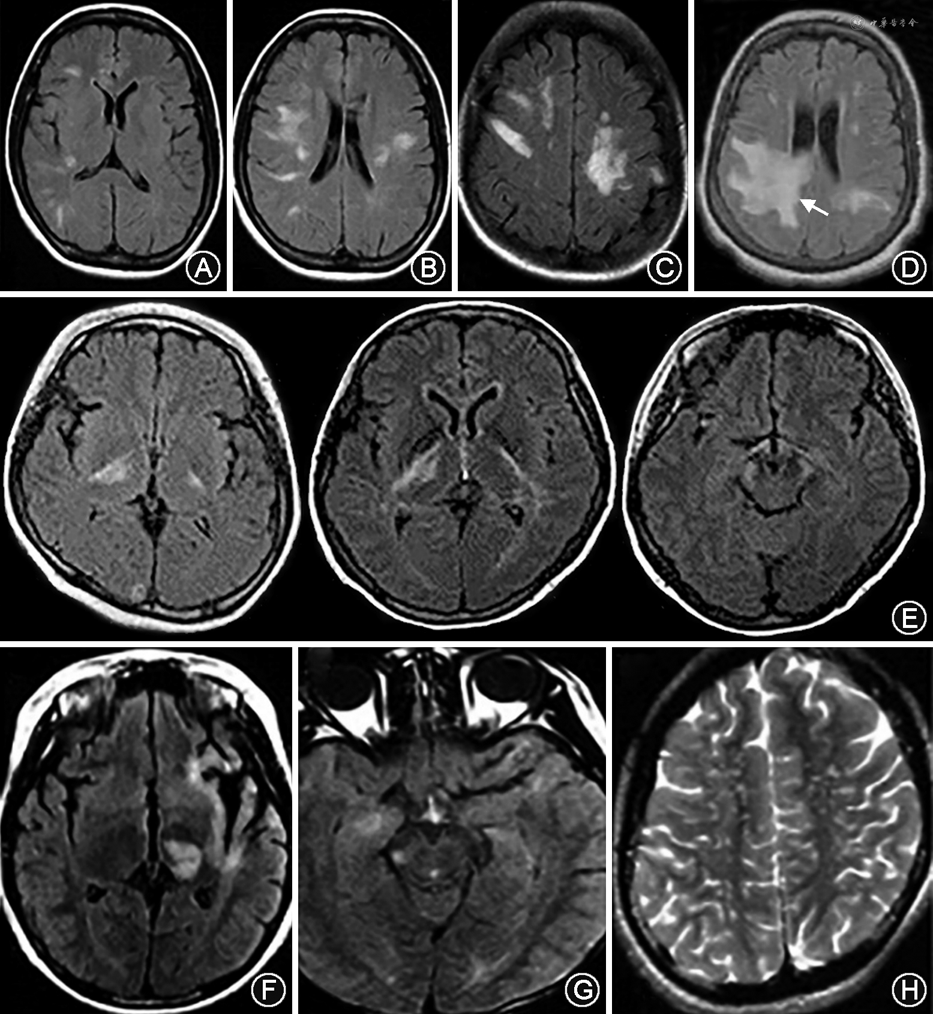
3.最后区综合征:以延髓背侧为主,主要累及最后区域,呈片状或线状长T2信号,可与颈髓病变相连(图3D~F)。
4.急性脑干综合征:可见脑干背盖、四脑室周围弥漫性病变(图4A~C)。


5.急性间脑综合征:位于丘脑、下丘脑、三脑室周围弥漫性病变(图4D、E)。
6.大脑综合征:不符合典型MS的影像学特征,幕上部分病变体积较大,呈弥漫云雾状,无边界,通常不强化,可有散在点状、泼墨状病变。胼胝体病变较弥漫,纵向可大于1/2胼胝体长度。部分病变可沿基底节、内囊后支、大脑脚锥体束走行,T2、FLAIR呈高信号。少数病变可表现类ADEM、肿瘤样脱髓鞘或可逆性后部白质脑病样特征(图5)。

1.AQP4-IgG检测:推荐使用基于细胞转染的间接免疫荧光法(cell-based assay,CBA)或流式细胞技术检测,使用CBA,我国NMOSD患者的诊断敏感度为84.4%,特异度为97.3% [11]。需要注意的是,AQP4-IgG阴性并不能完全除外NMOSD,少数患者在疾病缓解期或使用免疫抑制剂治疗后可能出现假阴性。
2.脑脊液检查:脑脊液细胞数常见>50×106/L,可见淋巴细胞和嗜中性粒细胞增多,少数病例可见嗜酸性粒细胞。OB阳性率约20%,一般仍认为是与急性发作有关的短暂阳性,且更有利于MS的诊断。脑脊液GFAP在急性发作期增高,但仅持续数天至数周。利用单分子免疫分析(single molecular array)技术可检测到血中很微量的GFAP(sGFAP),NMOSD患者sGFAP水平明显高于健康人群。NMOSD复发期sGFAP/神经丝轻链蛋白比值增高,有利于与MS的鉴别(敏感度73%,特异度75.8%)[12]。而另一类髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)抗体相关疾病(MOGAD,详见鉴别诊断)急性期脑脊液-髓鞘碱性蛋白(myelin basic protein)水平显著增高,反映CNS的病理损害部位不同。
3.其他自身免疫抗体:近50%的NMOSD患者合并其他自身免疫抗体,超过50%的NMOSD患者抗核抗体阳性,约25%的患者伴有其他自身免疫抗体。
4.OCT:可作为以视神经炎为首发症状的NMOSD与MS早期鉴别的辅助手段。NMOSD患者RNFL厚度比MS明显变薄,黄斑体积明显变小。单侧视神经炎患眼RNFL厚度较健侧减少>15 μm时则倾向于NMOSD的诊断。
5.电生理检查:视觉诱发电位多有明显异常,P100潜伏期延长。听觉诱发电位中枢段异常提示脑干受累。
IPND于2015年将NMO与NMOSD统称为NMOSD,归纳了核心临床特征并制订了诊断标准[4]。
NMOSD的诊断是基于AQP4-IgG分层,以病史、核心临床特征、MRI特点和生物学标志物为依据,排除其他疾病。
1.核心临床特征:(1)视神经炎;(2)急性脊髓炎;(3)最后区综合征:不能解释的呃逆或恶心、呕吐发作;(4)急性脑干综合征;(5)急性间脑临床综合征或症状性睡眠发作伴NMOSD典型间脑MRI病灶;(6)症状性大脑综合征伴NMOSD典型脑病变。
2.NMOSD诊断标准(2015)详见表1。

成人患者视神经脊髓炎谱系疾病诊断标准[9]
Neuromyelitis optica spectrum disorders diagnostic criteria for adult patients[9]
成人患者视神经脊髓炎谱系疾病诊断标准[9]
Neuromyelitis optica spectrum disorders diagnostic criteria for adult patients[9]
AQP4-IgG阳性患者的诊断标准: 1. 至少有1个核心临床特征 2. 使用最佳的检测方法AQP4-IgG阳性(强烈推荐细胞水平检测) 3. 排除其他可能的诊断(如结节病、肿瘤或副肿瘤性、HIV、梅毒等慢性感染) |
|---|
AQP4-IgG阴性患者或未能检测AQP4-IgG的患者NMOSD诊断标准: 1. 至少有2个核心临床特征,出现于1或多次临床发作时,并符合以下所有的必要条件: a.至少1个核心临床特征必须是视神经炎、LETM或APS b.空间多发性(2个或以上不同的核心临床特征) c.满足附加的MRI诊断的必要条件 2. 应用最佳的方法检测AQP4-IgG阴性或未能检测 3. 排除其他可能的诊断 |
AQP4-IgG阴性患者或未能检测AQP4-IgG的患者附加的MRI必要条件: 1. 急性视神经炎:要求脑MRI显示(a)正常或仅有非特异性白质改变,或者(b)视神经MRI显示T2高信号病灶或T1加权钆增强病灶延伸超过1/2视神经长度或病变涉及视交叉 2. 急性脊髓炎:要求相关的髓内MRI病灶延伸≥3个连续的节段(LETM),或既往有急性脊髓炎病史患者局灶性脊髓萎缩≥3个连续的节段 3. APS:要求伴延髓背侧和最后区病变 4. 急性脑干综合征:要求伴发室管膜周围的脑干病变 |
注:AQP4:水通道蛋白-4;HIV:人类免疫缺陷病毒;NMOSD:视神经脊髓炎谱系疾病;LETM:纵向延伸的长节段横贯性脊髓炎;APS:最后区综合征;MRI:磁共振成像
NMOSD应与以下疾病相鉴别:
1.CNS炎性脱髓鞘疾病:包括MS、ADEM、瘤样炎性脱髓鞘等疾病(表2)。在所有的鉴别指标中,最具临床意义的是6组核心临床特征以及脊髓和脑的MRI病灶特征;最具有特异性的是血清AQP4-IgG阳性。

视神经脊髓炎谱系疾病的鉴别诊断
Differential diagnosis of neuromyelitis optica spectrum disorders
视神经脊髓炎谱系疾病的鉴别诊断
Differential diagnosis of neuromyelitis optica spectrum disorders
| 鉴别要点 | 视神经脊髓炎谱系疾病 | 多发性硬化 | 单相急性播散性脑脊髓炎 | 瘤样炎性脱髓鞘疾病 |
|---|---|---|---|---|
| 发病年龄 | 任何年龄,中位发病年龄39岁 | 20~40岁,中位发病年龄29岁 | 儿童,16岁以下 | 平均约30岁 |
| 性别 | 女性优势可高达9∶1 | 女性优势2∶1 | 无差异 | 无差异 |
| 感染诱因 | 多无 | 可有 | 感染或接种史 | 多无 |
| 自然病程 | 多为单相病程,也可复发 | 亚急性起病,85%复发-缓解,10%原发进展 | 急性起病,单相自限病程 | 亚急性或慢性起病,通常单相病程 |
| 病情严重程度 | 中-重度 | 轻-中度 | 重度 | 重度 |
| 体征 | 视神经炎、横贯性脊髓炎 | 核间性眼肌麻痹、眼球震颤并存,复视 | 脑膜刺激征 | 颅内压增高,头痛,定向、记忆障碍,轻偏瘫 |
| 发作性症状 | 视神经炎、横贯性脊髓炎 | Lhermitte征、球后视神经炎、不完全横贯性脊髓炎 | 发热、头痛、癫痫发作、意识模糊或谵妄 | 脊髓型进展迅速 |
| 头颅MRI病灶 | 视神经、延髓最后区、下丘脑、丘脑、脑干或脑室室管膜周围,皮质下或深部白质,胼胝体病灶 | 常见脑病灶,侧脑室旁、近皮质和皮质、小脑、脑干和视神经,可见强化新病灶 | 常见脑室周围白质、胼胝体和丘脑多发病灶 | 单发或多发圆形或类圆形病灶,明显强化,开环征 |
| 脊髓MRI病灶 | 常见,≥3个椎体节段,多位于脊髓中央 | 可有,1~2个椎体节段,多位于白质 | 有脊髓症状的患者,约80%可见脊髓病灶,局灶性或长节段 | 脊髓型MRI可见病灶 |
| 脑脊液-MNC | >50×106/L,约占1/3 | 正常或<15×106/L | 多>50×106/L | 正常或数十个 |
| 脑脊液-OB | 约20%(+) | 85%~95%(+) | 少见 | 少见 |
| 血清AQP4-IgG | (+) | (‒) | (‒) | (‒) |
| 遗留残疾 | 中-重度,致盲或严重视力障碍 | 轻度残疾,不致盲 | 预后较好 | 预后较好,可演变为MS或同心圆硬化 |
注:MRI:磁共振成像;MNC:单个核细胞;OB:寡克隆区带;AQP4:水通道蛋白4;MS:多发性硬化
2.MOGAD:在AQP4-IgG阴性的NMOSD患者中,约20%~25%的患者血清中存在MOG抗体。因其临床表现与NMOSD存在异质性,儿童更易罹患,目前多数学者认为MOGAD是独立于MS和NMOSD的一类脱髓鞘疾病。病理上表现为脱髓鞘病变不伴胶质细胞丢失。以二者临床表现最易混淆的视神经炎和脊髓炎为例,MOGAD的视神经炎通常累及双侧视神经,节段长且累及神经前部,一般不累及视交叉,伴有视神经鞘周围增宽。MOGAD的长节段脊髓炎更易于延伸至腰髓,轴位通常呈“H”型损害。
3.其他风湿免疫疾病:如系统性红斑狼疮、干燥综合征、神经白塞病、脊髓胶质瘤、室管膜瘤、副肿瘤综合征、原发性中枢神经系统血管炎、缺血性视神经病、遗传性脑脊髓视神经病、脊髓硬脊膜动静脉瘘、脊髓血管畸形、脊髓梗死、艾滋病、热带痉挛性截瘫、中毒性视神经病、亚急性联合变性、肝性脊髓病、Leber视神经病、遗传性痉挛性截瘫、脊髓压迫症等。NMOSD与风湿免疫疾病或副肿瘤综合征共存的情况,如AQP4-IgG阳性则不予区分[13]。
4.不支持NMOSD诊断的警示/红旗征:(1)进展性临床病程:神经系统征象的恶化与发作无关,提示MS可能;(2)不典型发作时间:发作时间小于1 h提示脊髓血管病;(3)发病后持续恶化超过4周,提示神经结节病或肿瘤可能;(4)不完全性横贯性脊髓炎,病变较短,提示MS可能;(5)脑脊液特异性OB阳性(Ⅱ型),提示MS可能;(6)影像特征符合MS的特有表现或病变持续强化超过3~6个月。
NMOSD的治疗包括急性期治疗、缓解期治疗、对症治疗和康复治疗等。
主要针对有临床和影像学发作证据的急性发作期患者,目标是减轻急性期症状,缩短病程,改善残疾程度和防治并发症等。采用糖皮质激素、血浆置换和静脉滴注免疫球蛋白(IVIG)等疗法。
1.大剂量甲泼尼龙冲击治疗:是急性期的经典治疗,根据患者全身情况,从500~1 000 mg/d开始,静脉滴注3~4 h,连用3~5 d,继之以大剂量泼尼松口服,从1 mg·kg-1·d-1开始,逐渐减量至7.5~15.0 mg/d,长期维持。我国两项前瞻性研究结果显示,在联合免疫抑制剂治疗的前提下,小剂量激素长期维持可减少患者疾病的复发[14, 15]。合并其他自身免疫病患者宜选择激素联合免疫抑制剂如环磷酰胺治疗。少数患者在激素减量过程中病情再次加重,可减慢减量过程,小剂量激素维持时间应比MS长。
2.血浆置换:部分重症患者,特别是视神经炎或老年患者,对激素治疗反应不佳时就进行血浆置换。对AQP4-IgG阳性和阴性患者均有一定疗效,特别是早期应用。建议置换5~7次,每次用血浆1~2 L[16]。
3.IVIG:激素冲击治疗无效或不能耐受激素冲击者,可试用IVIG治疗。推荐剂量0.4 g·kg-1·d-1,静脉滴注,连续5 d为1个疗程[16]。但目前认为,IVIG治疗NMOSD通常无明显帮助[17]。
1.主要通过抑制免疫以降低年复发率,延缓残疾进展,需长期序贯治疗。对于AQP4-IgG阳性患者和抗体阴性复发型患者应尽早开始。为了尽快激素减量和停用,应在激素递减治疗的同时尽早开始序贯治疗[18]。长期使用口服免疫抑制治疗药物,包括吗替麦考酚酯(mycophenolate mofetil;B级推荐),每日1.0~2.0 g,分2次口服。还可使用硫唑嘌呤(B级推荐),2~3 mg·kg-1·d-1口服,每日常用剂量150 mg。通常用滴定方法,直到外周白细胞总数降至大约3×10-9/L,而中性粒细胞绝对计数保持在1×10-9/L以上。他克莫司(C级推荐)每日2~3 mg,分2次空腹口服。氨甲蝶呤(B级推荐)每周15 mg。环磷酰胺(C级推荐)600 mg静脉滴注,每月1次,共12个月。年总负荷剂量不超过10~15 g。这些治疗通常是无限期继续,因为疾病活动的复发通常是在治疗停止后。
2.最近3年已有5个随机安慰剂对照试验证实新型作用靶点的单克隆抗体药物[19, 20, 21, 22, 23]包括依库珠单抗[24](eculizumab,A级推荐)、萨特丽珠单抗(satralizumab,A级推荐)、伊纳利珠单抗[25](inebilizumab,A级推荐)和利妥昔单抗(rituximab,RTX,A级推荐)可用于预防AQP4-IgG+NMOSD的复发。实际上,近年来利妥昔单抗在国内已被广泛应用,每次静脉输注500~600 mg,每周1次,连用4周,通常每6个月重复应用。我国多中心2期前瞻性双盲对照研究采用托珠单抗(B级推荐),每次静脉输注8 mg/kg,每4周重复1次[26]。比较特殊的是伊纳利珠单抗,作为CD19单克隆抗体,最近一项随机双盲安慰剂对照研究(N-MOmentum)证实该药类似RTX,可有效降低患者复发。前3种药物由于价格昂贵和尚未进入我国,尚无相关临床经验,但2021年我国食品药品监督管理局已批准萨特丽珠单抗用于12周岁以上的AQP4-IgG阳性NMOSD患者。
需注意,某些治疗MS的疾病修饰治疗(disease modifying therapy)药物可能使NMOSD病情加重,如β干扰素(interferon-beta)、那他珠单抗(natalizumab)、芬戈莫德(fingolimod)、阿仑单抗(alemtuzumab)和富马酸二甲酯(dimethyl fumarate),应避免使用。
3.对症治疗:疼痛或痛性痉挛可见于80%以上的NMOSD患者,可使用卡马西平、加巴喷汀、普瑞巴林、巴氯芬治疗;慢性疼痛和感觉异常可使用阿米替林、普瑞巴林等。顽固性呃逆可使用巴氯芬;抑郁、焦虑可应用选择性5羟色胺再摄取抑制剂、选择性去甲肾上腺素再摄取抑制剂以及去甲肾上腺素和特异性5羟色胺能抗抑郁药物和心理治疗。疲劳、步行功能障碍可使用莫达非尼、金刚烷胺、氨吡啶等。尿潴留需留置尿管;长期卧床患者需预防血栓栓塞事件和呼吸、泌尿系统感染。
4.康复和心理治疗:患者病情平稳后应尽早在专业医生的指导下进行针对性的功能康复训练,制订合理的个体化治疗方案,改善患者的日常生活自理能力。严重瘫痪者需注意保持功能位。对严重焦虑、抑郁甚至自杀倾向患者应给予心理治疗。建议戒烟、戒酒、合理膳食、适当晒太阳并口服维生素D等。
NMOSD 是高复发、高致残性疾病,单向病程仅占10%,多因复发而加剧,总体预后较差。复发病程可能与女性、发病年龄较晚、临床索引事件间隔期较长、并发系统性自身免疫病等有关。若未经治疗,约50%的患者在5~10年内失去行走能力,丧失视力,约30%的患者最终死于神经系统并发症。
综上所述,NMOSD与其他炎性脱髓鞘疾病存在较大差异,具体表现在种族、发病年龄、病理表现、治疗反应等方面,具有治疗效果差、扩展残疾状态量表(Expanded Disability Status Scale)评分高及高复发率等特点。AQP4抗体阴性的NMOSD患者表现有较大异质性,有时确定诊断需要长时间的随访复查,发病机制不明,这也给治疗带来很大困扰。国际上的NMOSD临床试验数量与MS相比明显不足,可能与患者数相对较少有关。由于我国人口基数大使得NMOSD成为近年来的研究热点,希望在不久的将来可以攻克治疗难关。
一个世纪以来NMO的研究踟蹰不前,但近20年成绩斐然。临床和影像学研究已证明NMOSD概念的合理性,包括NMO及相关疾病具有6组核心临床特征。2015年NMOSD国际诊断标准规定:只要AQP4-IgG阳性(强烈推荐细胞学方法),患者只要有6组核心特征之一即可诊断。这意味着AQP4-IgG阳性患者可以无视神经炎、无脊髓炎,只要有1个其他核心特征,诊断即可成立。这种诊断的预测性主要取决于AQP4-IgG抗体的高度特异性,目前正在接受临床实践的检验。
所有作者声明不存在利益冲突
None declared
1.视神经脊髓炎谱系疾病(NMOSD)的发病年龄和多发性硬化(MS)相比,下列哪一项表述正确?
A.晚10年左右
B.晚5年左右
C.早10年左右
D.早5年左右
2.水通道蛋白4(AQP4)抗体诱导表达AQP-4的星形胶质细胞产生的细胞因子是?
A.白细胞介素(IL)-10
B.肿瘤坏死因子-α
C.IL-2
D.IL-17
E.IL-6
3.以下随机安慰剂对照试验证实对治疗NMOSD有效的是?
A.萨特丽珠单抗
B.阿仑单抗
C.奥法妥木单抗
D.那他珠单抗
E.干扰素β
4.以下ΝΜΟSD禁用的药物是?
A.萨特丽珠单抗
B.托珠单抗
C.芬戈莫德
D.利妥昔单抗
E.伊纳利珠单抗
5.以下对NMOSD描述错误的是?
A.2015年国际视神经脊髓炎诊断小组更新了NMOSD的诊断标准
B.AQP4阳性的患者临床上需要至少符合1个核心临床特征
C.NMOSD诊断的6组核心症状不包括急性胼胝体受累的表现
D.儿童更易患髓鞘少突胶质细胞糖蛋白抗体相关疾病
E.神经系统症候恶化与发作无关,提示MS可能































