
回顾性分析解放军总医院2010年1月至2020年12月收治的61例唾液腺导管癌患者临床资料,其中男55例(90.2%),女6例(9.8%);50岁以上者占83.6%(51例);大多数原发肿瘤来自腮腺(73.8%,45例);57.4%(35例)的患者发生了颈部淋巴结转移,41.0%(25例)的患者出现远处转移;所有患者均接受了手术治疗,术后有50例患者(82.0%)接受了辅助放疗;患者3、5年生存率分别为58.0%和43.3%,术后辅助放疗及放化疗患者的生存率高于仅手术的患者。可见,对于唾液腺导管癌,根治性手术治疗是必要的,术后放化疗可以一定程度上降低复发率,提高生存率。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
唾液腺导管癌(salivary duct carcinoma,SDC)是来源于唾液腺导管上皮细胞的高度恶性肿瘤,约占唾液腺恶性肿瘤的1%~3%[1, 2]。由Kleinsasser等在1968年首次描述,1991年被收录在第二版世界卫生组织唾液腺肿瘤分类表中[3]。其病理形态与乳腺导管癌相似,故命名为“唾液腺导管癌”[2]。最常见于60~70岁老年男性,80%~90%发生在腮腺[4]。患者就诊时多为肿瘤晚期伴颈部转移,多数患者2~3年内发生局部复发或转移,最终死于全身转移[1,5]。目前为止只有少数SDC研究超过50例患者[2,6, 7],手术切除是主要治疗手段,但远期效果不理想。本研究通过分析解放军总医院第一医学中心61例SDC患者的临床表现及治疗效果并行初步总结,以期对其临床诊治提供一定参考。
1.一般资料:收集解放军总医院2010年1月至2020年12月收治的SDC患者,从电子病历系统和随访记录中收集有关年龄、性别、症状以及肿瘤的组织病理学特征、诊断、治疗、预后等数据,进行回顾性分析。
2.纳入标准:2010年1月至2020年12月收入院并接受治疗,最终有明确组织病理诊断为SDC的患者。
3.随访:采用门诊复查、二次住院、电话等方式进行随访,在术后前2年每3个月进行一次,第3~5年每6个月随访一次,在5年之后每年随访一次。随访截止日期为2020年12月,随访时间最长者达113个月,最短者为1个月,平均随访时间为27.4个月。失访患者2例,占总人数3.3%。
4.统计学处理:患者生存期以第一原发癌确诊日期作为起点,以患者死亡、失访或末次随访日期作为终点。数据采用SPSS 22.0统计软件进行分析,性别、发病部位、转移部位、手术方式等定性资料以频数和百分比表示,年龄、生存时间等定量资料以表示。采用GraphPad Prism 6.01软件绘制Kaplan-Meier曲线并行统计分析计算生存率,采用对数秩检验进行不同组间生存曲线的比较,双侧检验,检验水准α=0.05。
1. 一般情况及治疗情况:61例患者中男55例(90.2%),女6例(9.8%);平均诊断年龄为59.3岁(24~83岁),50岁以上者占83.6%(51例);<50岁者10例,占比16.4%。有吸烟史者34例,占比55.7%,无吸烟史者27例,占比44.3%;大多数原发肿瘤来自腮腺(73.8%,45例),其次是下颌下腺(24.6%,15例),另外1例为腭部小唾液腺(1.6%,1例);21.3%的患者术前有面神经麻痹现象(13例),1例下颌下腺来源者出现术前舌体麻木症状;57.4%(35例)的患者发生了颈部淋巴结转移,41.0%的患者(25例)出现远处转移,其中肺部转移24例,脑转移10例,骨转移10例,肝转移2例,上下眼睑转移1例,有8例患者为全身多处转移;所有患者(61例)接受了原发灶扩大切除术加同侧根治性颈部淋巴结清扫术,术后有50例患者(82.0%)接受了辅助放疗;25例患者(41.0%)选择了补充化疗;其中22例患者采取了术后放疗+化疗。
2. 病理学分析:21.3%患者(13例)镜下可见粉刺样坏死结构;6.6%患者(4例)见钙化现象;34.4%患者(21例)表现神经周围浸润及13.1%患者(8例)可见肿瘤侵犯周围软组织;29.5%患者(18例)的病理显示有导管内癌栓。
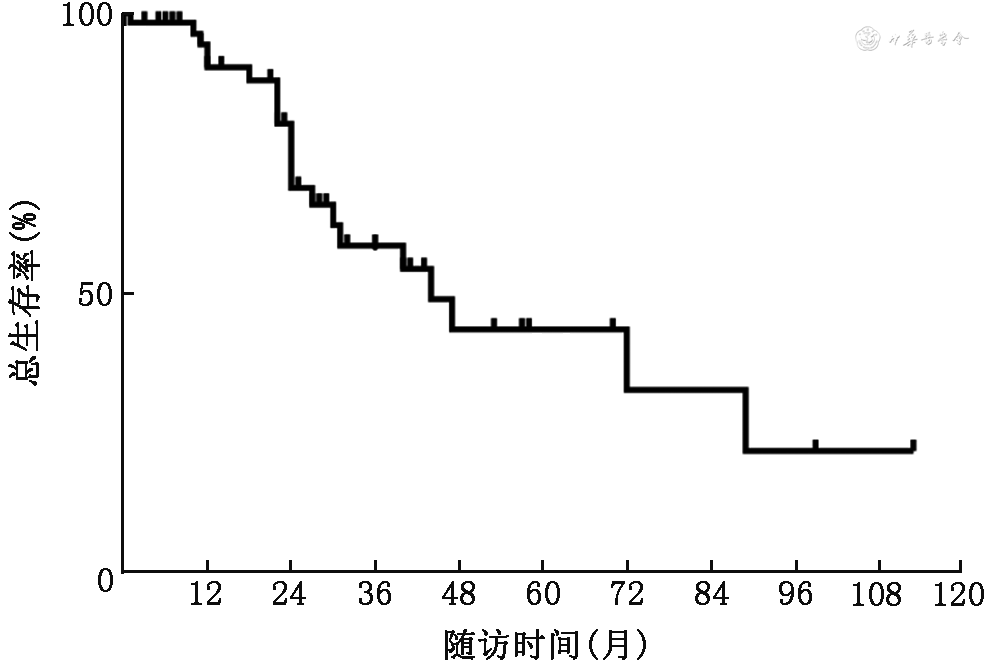
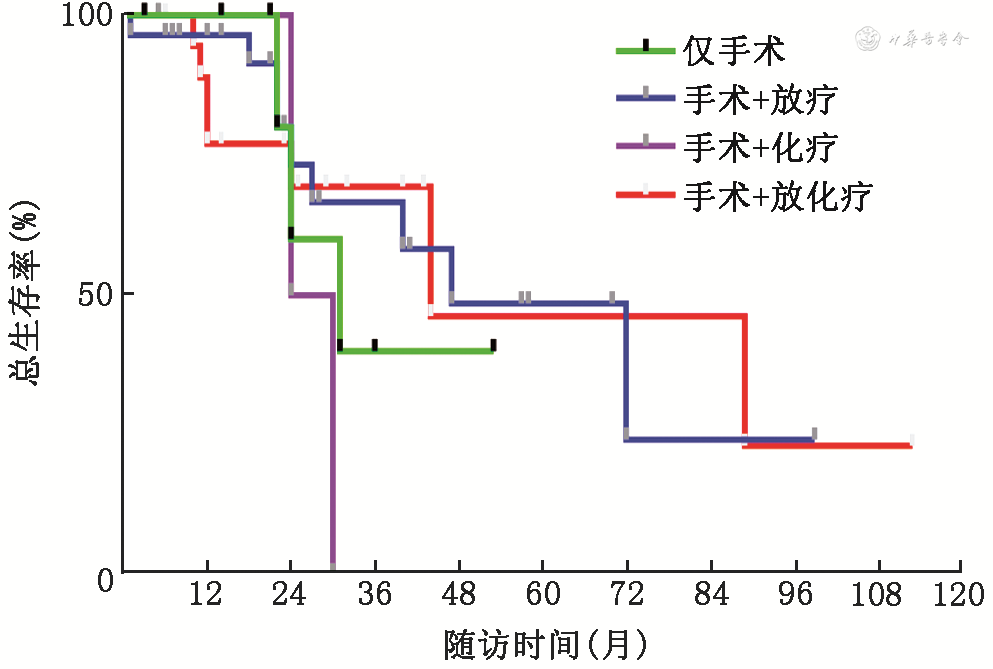
3. 生存分析:Kaplan-Meier法分析显示,患者3、5年生存率分别为58.0%、43.3%(图1),高于以往报道。图2可见术后辅助放疗及放化疗组的生存曲线位置明显高于仅手术组,提示术后辅助放疗及放化疗可提高生存率,但对数秩检验比较不同组间的差异无统计学意义(P>0.05)。有4例患者(6.6%)病理提示SDC 来自多形性腺瘤恶变,34.4%的患者(21例)病理显示神经周围浸润;因癌已去世者21例,占比34.4%,其中有9例(14.8%)在术后2年内死亡,尚存患者38例,占比63.3%,失访2例。


SDC的发病率为0.04/100 000人/年[8],最常发生于60~70岁老年男性,男女比例为4~5∶1,平均年龄67.4岁[9],发病平均年龄在性别之间没有显著差异。本研究患者中男女比例为8∶1,较以往相关报道高,男性更多见。SDC有80%~90%的肿瘤发生在腮腺,其次是下颌下腺(10%~12%)和小唾液腺(1%~2%)[2,4]。本研究患者发病部位与前报道一致,但未见有发生于舌下腺的患者。SDC可以是新生的,也可以是先前存在的多形性腺瘤恶变继发的,约占20%[10],本研究4例患者(6.6%)病理提示SDC 来自多形性腺瘤恶变。17例有患侧慢性阻塞性唾液腺炎病史(腮腺11例,下颌下腺6例),有个别文献报道长期慢性阻塞性唾液腺炎基础上可发生SDC[11],本研究在一定程度上支持此观点。
SDC常表现为疼痛、质地较硬、实性或囊性、界限不清的肿块,面神经麻痹发生率在30%~60%之间[4]。研究表明,83%有神经周浸润、73%有淋巴浸润[12, 13, 14]。Breinholt等[8]发现有52%的患者发生了远处转移,最常发生在肺,其次是骨骼、肝脏、大脑,有些患者可同时转移至全身多个部位。本研究患者临床特点与报道相似,但其中有1例腮腺导管癌患者转移到同侧的上下眼睑呈多发状圆形肿物,这一转移特点国内外文献未见报道。有7例晚期患者出现癌化区现象,尤其以原发灶周围皮肤多见,呈多结节颗粒状,逐渐扩散,让外科医生无能为力。
组织学上,肿瘤上皮向导管内增生呈筛状、乳头状或实性巢状,巢中央可见有粉刺样坏死;还可存在多种其他变异,包括富含黏液蛋白、肉瘤样、基底样和嗜酸细胞样,但很少见[15, 16]。典型的肿瘤细胞形态表现胞质丰富并嗜酸性,核仁突出、核多形性明显、有丝分裂象增加[17, 18]。本研究中患者的病理学特点也提示其易侵袭转移的生物学特性。
临床可通过体格检查、颈部超声及头颈部影像学检查、同位素骨扫描等诊断。Motoori等人在CT中发现有33%的SDC患者肿瘤钙化,MRI可检测对周围神经、临近结构的侵犯及淋巴结转移情况,SDC在T2加权图像上呈低至中等信号强度,部分可见边界不清或中央粉刺样坏死;PET/CT显示SDC是一种高度代谢性肿瘤,对于检测局部和远处转移非常有用[19, 20]。但最终还需依赖病理检查结果,必要时可行超声引导细针穿刺组织学活检术或术中行冰冻切片快速病检。
对于SDC等高级别唾液腺恶性肿瘤,现在提倡一种多模式的治疗方法,即手术切除原发部位(通常需行面神经切除术、腺体全切术来实现原发部位的肿瘤切除),并行同侧根治性颈部淋巴结清扫及配合辅助放化疗治疗;即使临床淋巴结未受累者,因其颈部淋巴结转移率高,多数文献中也建议采用颈部淋巴清扫术治疗。
晚期患者3年无病生存率仅为27.7%,多数患者生存时间不超过5年[1,7,21, 22, 23, 24],Roh等[25]报道,与单纯手术相比,术后放疗是总生存期最重要的预后因素之一;另有研究发现,辅助放疗对总体生存期和无复发生存期有积极作用,但对疾病特异性生存期没有影响[21, 22,26]。Lewis等[4]观察到,接受联合放疗的患者局部复发率为21%,而单纯手术的患者局部复发率为50%,即通过根治性切除和辅助放疗能实现更好的局部区域控制[21,27]。术后化疗主要用于转移灶,常见的几种辅助化疗方案包括GP方案(吉西他滨+顺铂)和TP方案(紫杉醇+顺铂),但SDC对化疗反应较差,联合化疗并没有改善远处转移或总生存率[6,28, 29]。
除了常规的术后放化疗,分子靶向治疗如曲妥珠单抗靶向人表皮生长因子受体-2和靶向雄激素受体拮抗剂对SDC的治疗也有一定效果[30, 31, 32],但其产生的耐药、不良反应等问题仍有待克服。本研究有3例患者采用类似乳腺导管癌的靶向药物控制复发灶和肺部转移灶,转移灶有明显变小,治疗效果显著,但例数较少,尚需扩大样本量及进一步观察。
综上所述,SDC具有较高的局部复发和远处转移风险,预后较差;根治性手术治疗是必要的,术后放化疗可以一定程度上降低复发率,提高生存率。
所有作者均声明不存在利益冲突



























