
炎症性肠病(IBD)与微生态平衡失调密切相关,益生菌在IBD中的应用也愈发广泛。本文阐述了IBD应用益生菌的临床疗效,一方面,益生菌可通过抗氧化应激反应、肠道屏障修复、免疫调节、微生物调节和改善营养等发挥作用;另一方面,也有临床试验提示无效。文章对应提出了提高益生菌临床疗效的有效建议,包括采用多菌种复合益生菌、联合使用益生元、益生菌质控与实际疗效的关系等。同时,总结IBD患者应用益生菌的潜在风险,包括菌血症、抗生素耐药性的转移及不良反应,并提出建议,以帮助临床医生全面了解益生菌在IBD患者中的疗效与风险,指导其合理应用益生菌,进一步提高治疗效果。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
炎症性肠病(inflammatory bowel disease,IBD)是一种反复发作的慢性疾病,主要包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD),其发病机制与基因易感性、环境、微生物群失调、肠道屏障受损以及免疫功能的过度激活有关[1,2,3]。益生菌具有抗炎、维持肠道稳态的作用,可作为IBD的辅助治疗。然而,也有部分临床试验揭示益生菌疗效并不显著,同时还暴露出一些潜在的风险。因此,本文对近年来IBD患者中应用益生菌的临床疗效和潜在风险进行文献综述并提出相关建议。
益生菌是一类活性微生物,能够在胃肠道中存活并定植于肠道黏膜,大多数隶属于乳酸杆菌和双歧杆菌属[4]。目前益生菌已被用于IBD的辅助治疗,从抗氧化应激、促进肠黏膜修复、调节免疫、恢复肠道菌群平衡、改善营养代谢等多方面发挥作用。见表1。
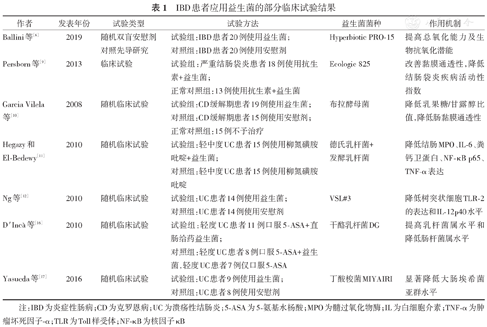
IBD患者应用益生菌的部分临床试验结果
IBD患者应用益生菌的部分临床试验结果
| 作者 | 发表年份 | 试验类型 | 试验方法 | 益生菌菌种 | 作用机制 |
|---|---|---|---|---|---|
| Ballini等[6] | 2019 | 随机双盲安慰剂对照先导研究 | 试验组:IBD患者20例使用益生菌; | Hyperbiotic PRO-15 | 提高总氧化能力及生物抗氧化潜能 |
| 对照组:IBD患者20例使用安慰剂 | |||||
| Persborn等[9] | 2013 | 临床试验 | 试验组:严重结肠袋炎患者18例使用抗生素+益生菌; | Ecologic 825 | 改善黏膜通透性,降低结肠袋炎疾病活动性指数 |
| 正常对照组:13例使用抗生素+益生菌 | |||||
| Garcia Vilela等[10] | 2008 | 随机临床试验 | 试验组:CD缓解期患者19例使用益生菌; | 布拉酵母菌 | 降低乳果糖/甘露醇比值,降低肠黏膜通透性 |
| 对照组:CD缓解期患者15例使用安慰剂; | |||||
| 正常对照组:15例不予治疗 | |||||
| Hegazy和El-Bedewy[11] | 2010 | 随机临床试验 | 试验组:轻中度UC患者15例使用柳氮磺胺吡啶+益生菌; | 德氏乳杆菌+发酵乳杆菌 | 降低结肠MPO、IL-6、粪钙卫蛋白、NF-κB p65、TNF-α表达 |
| 对照组:轻中度UC患者15例使用柳氮磺胺吡啶 | |||||
| Ng等[12] | 2010 | 随机临床试验 | 试验组:UC患者14例使用益生菌; | VSL#3 | 降低树突状细胞TLR-2的表达和IL-12p40水平 |
| 对照组:UC患者14例使用安慰剂 | |||||
| D ′ Incà等[16] | 2010 | 随机临床试验 | 试验组:轻度UC患者11例口服5-ASA+直肠给药益生菌; | 干酪乳杆菌DG | 提高乳杆菌属水平和降低肠杆菌属水平 |
| 对照组:轻度UC患者8例口服5-ASA+益生菌,轻度UC患者7例仅口服5-ASA | |||||
| Yasueda等[17] | 2016 | 随机临床试验 | 试验组:UC患者9例使用益生菌; | 丁酸梭菌MIYAIRI | 显著降低大肠埃希菌亚群水平 |
| 对照组:UC患者8例使用安慰剂 |
注:IBD为炎症性肠病;CD为克罗恩病;UC为溃疡性结肠炎;5-ASA为5-氨基水杨酸;MPO为髓过氧化物酶;IL为白细胞介素;TNF-α为肿瘤坏死因子-α;TLR为Toll样受体;NF-κB为核因子κB
氧化应激在IBD的发生发展过程中扮演重要角色,抗氧化应激治疗的潜力逐渐被挖掘出来[5]。随机双盲安慰剂对照先导研究表明,与安慰剂相比,益生菌Hyperbiotic PRO-15可提高总氧化能力及生物抗氧化潜能[6]。消化乳杆菌NKU556可提高葡聚糖硫酸钠(dextran sulfate sodium,DSS)肠炎小鼠结肠超氧化物歧化酶(superoxide dismutase,SOD)及谷胱甘肽过氧化物酶的水平,降低丙二醛的水平,从而降低氧化应激造成的损伤[7]。动物实验表明植物乳杆菌ZDY2013和双歧杆菌WBIN03可在转录层面上调DSS肠炎小鼠结肠中SOD1、SOD2、谷胱甘肽过氧化物酶2等抗氧化因子的表达水平,从而调节氧化应激。
修复受损的肠黏膜屏障是IBD治疗的首要目标[8]。严重结肠袋炎的患者在抗生素治疗后应用益生菌(Ecologic 825)补充治疗8周,可有效改善黏膜通透性,降低疾病活动性[9]。CD缓解期的患者在常规药物的基础上加用布拉酵母菌治疗3个月,结果显示,乳果糖/甘露醇比值降低,提示肠黏膜通透性降低,益生菌可有效恢复肠黏膜完整性[10]。
益生菌可通过调节肠道免疫细胞及免疫活性物质来影响肠道炎症[11,12]。梭状芽孢杆菌ATCC25755(Ct)通过激活树突状细胞来刺激十二指肠调节性T细胞(regulatory T cells,Tregs),同时激活回肠Th17细胞,Tregs分泌叉头蛋白3(forkhead box protein3,Foxp3)、白细胞介素(interleukin,IL)-3等抑炎因子,Th17细胞可表达维甲酸相关孤儿核受体-γt(retinoid-related orphan receptor-gamma t,ROR-γt)、IL-17、IL-22等促炎因子,可通过多种炎性因子,总体发挥减轻回肠炎症、免疫调节的作用[13]。
多项临床试验证明UC患者未能从益生菌中获益。一项随机对照研究显示,VSL#3治疗组与安慰剂组在改善UC患者疾病活动指数及内镜评分方面的差异均没有统计学意义(均P>0.05)[22]。也有学者证明,与安慰剂组相比,益生菌组合Probio-Tec AB-25并没有为UC患者带来显著的临床获益,考虑可能与研究纳入的患者仅有32例有关[23]。Petersen等[24]的单中心双盲随机对照试验表明,尼氏大肠埃希菌(EcN)作为活动期UC的附加治疗方法,其缓解率低于安慰剂组,可能因为EcN和肠出血性大肠埃希菌等IBD相关的致病大肠埃希菌(IBD-associated E.Coli)之间存在共生关系。
CD患者应用益生菌无效的报道则更多。有临床研究表明,与安慰剂组相比,乳杆菌GG不能明显缓解CD患者的临床症状,也不能阻止其术后的早期复发;考虑可能原因:一是该组吸烟者的比例更高,二是益生菌等任何形式的细菌都可能作为抗原来刺激炎症复发[25]。CD患者中,应用布拉酵母菌的治疗组与安慰剂组在复发时间、克罗恩病疾病活动指数方面差异均没有明显统计学意义(均P>0.05)[26]。两项随机对照试验均进一步证明,口服约氏乳酸杆菌(LA1)不能阻止CD患者术后的早期复发[27,28]。Bousvaros等[29]的随机对照试验结果显示,与安慰剂相比,乳杆菌GG未能延长CD患儿的中位复发时间,这可能与乳杆菌GG和安慰剂中均含有少量益生元菊粉有关。
部分益生菌在不同临床试验中表现出不同的疗效,其原因涉及多方面,例如研究纳入的患者数量不足、研究的时间跨度较短、益生菌应用的剂量及疗程不同、合用的其他药物的影响、病变位置以及发病机制的不同,甚至患者所处的疾病阶段不同也可能对疗效产生影响[25]。
单菌种益生菌疗效不佳时,可采用多菌种益生菌的复合产品。已有临床研究表明,复合益生菌VSL#3或者联合应用嗜酸乳杆菌和乳双歧杆菌对于IBD患者肠道菌群的恢复及其临床缓解的维持作用优于单菌种益生菌[22,23,30]。
益生元是选择性发酵的成分或纤维,可使胃肠道微生物的组成和(或)活性发生特定变化,从而有助于益生菌通过上消化道并促进其在肠道内存活及生长。单用益生菌疗效不佳时,还可采用益生元和益生菌的组合,即合生元。长双歧杆菌和益生元车前子的联合应用给UC患者带来包括全身功能、情绪功能、社会功能在内的生活质量的提高,优于单纯应用益生菌或者益生元[31]。另外,益生元(如丁酸盐、左旋肉碱、抗绿香蕉淀粉、全植物甘蔗纤维等)与益生菌的联合应用对于动物实验性肠炎的改善优于单独应用益生菌。
益生菌应用无效时,应考虑产品的自身质控。益生菌产品中实际检测出的成分和含量,与标签上可能并不一致[32]。即便拥有相同的商业注册名称,不同批次或不同产地的产品的代谢和功能也可能不同[25,26,33,34]。另外,不同产品名的益生菌产品,即便标注的基因组物种相同,也不能代表其临床特性完全一致[35]。因此,如使用益生菌之后症状未缓解,不能因此认为该菌种对患者无效,建议换用其他含有该菌种的益生菌产品。
在制定关于益生菌的种类、剂量及疗程的临床决策时,建议参考针对相同IBD亚型或相同疾病阶段的研究,同时需要考虑与益生菌共同使用的其他药物的影响。
由于益生菌的生物活性及菌种自身特性,IBD患者应用益生菌治疗时存在潜在风险,例如菌血症、抗生素耐药性的转移以及不良反应等,临床医生应对此加以关注。
益生菌的合理应用会使患者受益,但如果用于肠黏膜屏障严重受损或严重急性的IBD患者,益生菌则可能从肠道转移到血液,导致益生菌菌血症和真菌病。
在肠黏膜屏障严重受损的情况下,肠道共生菌可导致菌血症的发生,目前多见于个案报道。1例44岁女性活动期UC患者因杯状细胞减少、隐窝不规则、固有层炎症及出血等情况导致肠道生理结构破坏、肠黏膜屏障受损,继发菌血症,其血液分离出属于肠道共生菌的鼠李糖杆菌[36]。1例37岁活动期CD患者合并末端回肠炎及直肠瘘,在回盲瓣切除术后出现吻合口瘘,后因肠鸣音消失而行剖腹探查,探查前抽取的血液标本经培养后发现鼠李糖杆菌LMG 19717[37]。
益生菌应用于严重急性UC患者也易导致危险感染[38]。在高剂量2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid,TNBS)诱导的小鼠极重度肠炎模型中,益生菌鼠李糖杆菌可以穿过肠黏膜屏障,转位到肝、肾等肠外器官[39]。而在UC患者体内也有类似情况发生。1例急性严重UC患者,持续发热伴黏液血便2个月且口服醋酸泼尼松(25 mg/d)无效,接受鼠李糖乳酸杆菌GG治疗后发生菌血症,血中分离出的乳酸杆菌对万古霉素不敏感,与益生菌菌株的特性一致,提示益生菌从肠道转位到血液[40]。1例17岁的严重UC患者自行口服鼠李糖乳杆菌GG胶囊,5 d后出现高热、潮红、寒战等脓毒症症状,16S rRNA序列分析证实患者血液微生物与益生菌胶囊的匹配度为99.78%,支持严重活动性UC患者发生菌血症的可能性[41]。
因此,对于肠黏膜屏障严重受损或严重急性IBD患者,在应用益生菌时需警惕菌血症。应注意监测生命体征及感染指标,如有异常,及时停用益生菌并做血培养以明确病原菌,同时予抗感染与对症支持治疗。
IBD患者常需要使用抗生素,而抗生素在杀灭病原微生物的同时,也抑制了包括益生菌在内的肠道共生菌。因此,在抗生素治疗后,可采用具有耐药性的益生菌作为肠道共生菌恢复过程中的替代微生物。益生菌的抗生素耐药性基因来源于质粒、突变乃至环境[42]。Wong等[43]发现,在5种受检的益生菌产品中,所有批次均对万古霉素耐药,而且产品Cn(一款美国益生菌产品的代号)还对氨基糖苷类抗生素及环丙沙星耐药。
但是,益生菌的抗生素耐药性可能转移给致病菌,产生不利影响。益生菌的抗生素耐药基因如果属于核质体突变,则较为稳定[44];相反,如果耐药基因位于可移动的基因元件,则可能发生水平基因转移[45],成为胃肠道或食物中病原体的抗生素耐药性库[46,47]。双歧杆菌中的四环素抗性基因tet(W)被编码转座酶的基因或转座酶靶向的序列所包围,具有更显著的转移性,可转移至青春丁酸弧菌等[48]。而来自唾液酸乳杆菌NWL33和发酵乳杆菌NWL24的红霉素耐药基因erm(B)及来自短乳杆菌NWL59和植物乳杆菌NWL22的四环素耐药基因tet(M)可以通过筛选交配的方式转移到粪肠球菌181[49],使得粪肠球菌产生抗生素耐药性,可能导致机体发生耐药粪肠球菌感染。
总之,益生菌的抗生素耐药性基因转移到病原微生物基因组,会导致病原微生物获得新的抗生素耐药性,对患者的健康造成威胁。因此,建议选用耐药性明确或抗生素耐药表型基因位于染色体的益生菌产品。
益生菌可导致眩晕、流感样症状等轻微的不良反应[22]。多篇文献报道,应用VSL#3的活动期UC患者中有29%出现腹胀[50];在使用长双歧杆菌536的28例UC患者中,有1例出现干咳[51];77例应用VSL#3的UC患者中,14例出现腹胀及腹部不适,7例感到口腔异味[52]。
感染的发生值得重点关注。一项随机对照研究观察了益生菌VSL#3对CD患者回结肠切除重建术后内镜复发的影响,VSL#3处理组有1例发生术后伤口感染[53]。有文献报道尼氏大肠埃希菌1917(EcN)对维持162例UC患者缓解的疗效,其中有8例(4.9%)发生病毒感染[54]。
严重的不良反应可导致IBD患者无法耐受益生菌。如Mimura等[55]的临床试验中,1例55岁的男性结肠炎患者使用VSL#3益生菌10 d后,出现腹部绞痛、呕吐、腹泻等症状,停药并使用抗生素后缓解,再次使用VSL#3后出现相同症状,停药后再次缓解,最终该患者因无法耐受益生菌退出试验。Bousvaros等[29]的随机对照试验中有2例CD患儿因呕吐和不能耐受乳杆菌GG而退出研究。
因此,在临床应用中,临床医生应充分考虑并密切监测各种可能出现的不良反应。
鉴于IBD治疗中益生菌应用的临床疗效、潜在风险与不良反应,临床医生需要谨慎考虑患者的基本情况以及益生菌的特性,以便合理应用益生菌,使更多患者从中受益。
随着益生菌产业、基因组学和微生物组学的蓬勃发展,未来在益生菌应用于患者之前,可能需要进行相关的组学检测,为患者定制个性化的益生菌治疗方案;在规避益生菌应用的风险方面,还需进一步探讨围手术期或危重IBD患者的益生菌治疗指南。为了获得更科学、准确的益生菌安全性结果,未来需要开展更广泛患者群体、更长随访时间的随机双盲临床试验;除了益生菌本身,其代谢产物还需要进行深入的实验研究,以更好地了解益生菌的特性,提高临床疗效。
所有作者均声明不存在利益冲突



























