
同步脑电图-功能磁共振成像(EEG-fMRI)技术结合脑电图(EEG)的高时间分辨率和功能磁共振成像(fMRI)的优点,在脑功能尤其是癫痫研究中发挥重要价值:不但可以检出癫痫活动,用于辅助癫痫灶定位及评价癫痫药物疗效,还能够对癫痫活动的传播及癫痫网络进行分析。本文对EEG-fMRI的原理、技术以及目前在癫痫中的应用进行综述。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,文后附5道单选题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分
癫痫是常见的神经系统疾病之一。血氧水平依赖的功能磁共振成像(blood oxygen level dependent functional magnetic resonance imaging,BOLD-fMRI)技术作为一种高空间分辨率、重复易行的无创技术,已在癫痫临床和研究方面有广泛应用:较多的是对癫痫认知功能状态的评价,如癫痫术前功能优势半球的判断等;此外,功能磁共振(functional magnetic resonance imaging,fMRI)也可以对癫痫发放活动引起的血氧水平依赖(blood oxygen level dependent,BOLD)活动进行观察。同步脑电图-功能磁共振成像(simultaneous electroencephalogram and functional MRI,EEG-fMRI)利用同步采集的脑电图(electroencephalogram,EEG)数据辨认癫痫电发放活动,在fMRI上获得癫痫发放活动空间定位信息。其结合了EEG的高时间分辨率和fMRI的真实空间、高空间分辨率的优点[1],以多模态联合的方式对癫痫患者脑功能改变情况进行全面观察。
MRI的高磁场环境,导致EEG和MRI间存在相互影响,是EEG-fMRI同步采集的最大挑战。首先,需要采用特殊的兼容性硬件设备:EEG电极采用无磁的银/氯化银、碳或铜材料,放大器经磁屏蔽处理、信号传导则采用光纤等材料。其次,因为MRI环境对EEG产生严重的伪迹污染影响,包括MRI射频伪迹与磁场放大效应的心/肌电伪迹。为避免伪迹干扰,早期研究采用间隔扫描方式,在MRI停扫、无伪迹的EEG上监测到异常癫痫波出现,即行fMRI采集,利用BOLD的延迟效应对癫痫活动进行检测。目前均是基于EEG伪迹处理技术软件进行处理技术,通过同步锁相、高采样率等采集技术,以及基于减法、回归、独立成分分析及深度学习等算法[2]软件进行处理(图1)。并且,目前新发展的在线去伪迹方法,对于实时癫痫活动监测特别有益。
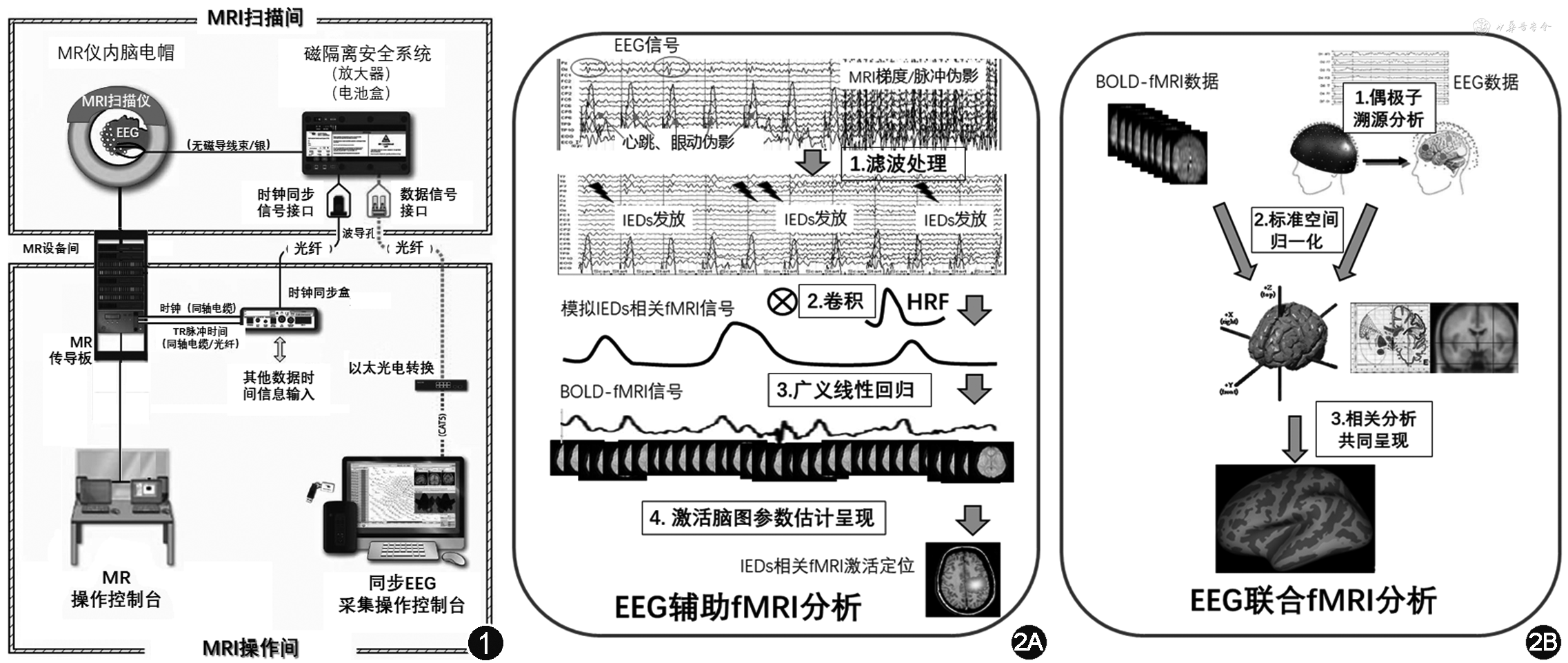

EEG的空间定位信息是溯源算法重建模拟所得,不能反映真实的空间信息;而MRI则有真实的空间的信息。所以EEG与fMRI融合的核心问题是如何使得EEG共享到fMRI的空间信息。主要有两种策略:
1. EEG辅助的fMRI分析(图2A):EEG提供神经事件的时间信息,依“时间定空间”的fMRI分析策略,实现激活信号空间特征观察的目的,其基础是基于标准空间分析,例如基于体素分析模式。最常用的是一般线性模型(general linear model,GLM),首先把神经事件与血流动力学函数(hemodynamic response function,HRF)进行卷积,作为回归子置于线性多元回归方程中,得到BOLD相关激活信号的空间位置。神经事件的输入方式可以为单纯的时间信息——如人工识别的间期痫样放电(interictal epileptiform discharges,IEDs)时间点,也可以采用软件提取神经事件定量化指标——如脑电上特异频段的功率谱密度等。其次,独立成分分析可以不需要先验知识对fMRI信号组分进行分解,在EEG-fMRI中应用时,可避免癫痫特异HRF形态对激活结果的影响。也可以采用原始的基于减法fMRI分析策略[3]来进行观察,以癫痫发作时间点BOLD信号为参考,计算时间序列上信号的改变。
2. EEG联合fMRI分析(图2B):EEG和MRI平行提供空间信息,通过共享空间信息达到联合。技术要点在于EEG溯源计算获得的空间信息进行标准空间化,然后再与同空间的fMRI信号进行配准。获得标准空间信息后的EEG信号可以采用与fMRI一样的分析,如计算功能连接。该技术充分利用了EEG包含的生理信息,使其包含的频段信息更精细丰富[4]。
癫痫灶/活动定位是癫痫诊断最主要的目的,EEG-fMRI可辅助癫痫定位、尤其是对病灶隐匿、结构MRI阴性癫痫活动检测。
1. 局灶性癫痫活动定位诊断:EEG-fMRI首先可以对有局灶性病理改变的癫痫灶进行定位,包括伴海马硬化的颞叶癫痫[5]、局灶性皮质发育不良[6]及低级别肿瘤等,有助于精确判断与病理灶位置不重合的癫痫活动区,能够检测到结构MRI为阴性患者的癫痫活动[7]。
Zijlmans等[8, 9]采用EEG-fMRI对难以定位的复杂难治性癫痫(如隐匿病灶、大体结构影像正常及广泛异常)进行术前决策,提高了致痫灶定位准确性,整体提高了手术的疗效。此外,在较为隐匿的局灶性皮质发育不良[6]、常规MRI阴性的癫痫患者中,EEG-fMRI也显示了相比高密度脑电图、脑磁图和正电子发射断层成像(positron emission tomography,PET)等技术较好的特异性[10];并且还可以用于结构MRI阴性的儿童癫痫,如Rolandic癫痫活动灶的定侧、定位[11],以及提高儿童癫痫的手术疗效[12]。
2. 原发全面性癫痫活动检测:原发全面发作性癫痫(基因相关的全面发作性癫痫)在常规结构影像上无局灶异常,但在PET及电生理上表现为丘脑的代谢和功能异常[13],被认为是主要的癫痫源灶。EEG-fMRI发现,全面性癫痫特征性的广泛棘-慢波发放(generalized spike-and-wave discharge,GSWD)可引起对称性的丘脑-皮质fMRI信号改变[14],并且导致丘脑内侧核激活、额顶叶和楔前叶皮质区去激活,表明丘脑-皮质-纹状体网络参与了癫痫活动形成的复杂过程[15]。儿童失神性癫痫EEG-fMRI也稳定地显示与癫痫发作相关的双侧丘脑激活[16, 17]。
3.抗癫痫药物对癫痫活动作用的研究:癫痫发放作为异常的神经活动,其血流响应模式与正常脑认知活动不同;这也是造成EEG-fMRI分析过程中寻找特异HRF的原因[18, 19]。抗癫痫药物在抑制癫痫电活动的同时,会造成IEDs相关BOLD活动特征的改变,这样就可以采用EEG-fMRI来观察抗癫痫药物的作用效果。如左乙拉西坦可以特异性地抑制Rolandic癫痫中中央颞区棘波相关的BOLD活动幅度及时间特征[20, 21]。
1. 癫痫除了局部的异常电活动,还可沿特定的网络传播到远处。癫痫活动传播不但引起症状多样化,还导致广泛的脑功能损伤。一项基于Granger因果网络分析的EEG-fMRI研究,发现丘脑癫痫活动皮质的传播,以及在脑干、小脑、黑质和纹状体间的双向激活,揭示了特异的癫痫活动传播网络[22]。结合静息态fMRI网络分析技术,EEG-fMRI可以提供无创癫痫传播通路描绘技术,为癫痫术前电极置入、指导手术切除和治疗干预提供帮助[23]。
2. 除了癫痫发作及相关的疾病长期因素可对脑产生损伤,IEDs作为潜在的病理性电活动事件,对脑功能也造成瞬时的影响损害。在特发性全面性癫痫患者中,GSWD期间丘脑-皮质的异常同步破坏了构成了默认网络中正常的丘脑-皮质和皮质-皮质的连接,降低了这些区域的皮质活动水平,造成大脑默认功能暂停,可能是导致患者意识丧失的病理生理基础[24]。进一步研究发现,在失神性癫痫发作过程中,丘脑与默认网络功能活动同步性(脑功能连接)的渐近线改变[17];并且,不同的脑皮质功能区受GSWD影响的程度不同:高级的认知功能网络,如注意、执行和默认网络受抑制,而低级别认知区如运动、视觉和听觉等受影响小[25]。这为理解失神性癫痫发作时意识丧失的认知等级改变理论提供了直接的证据[3]。
EEG-fMRI主要存在以下两个方面的挑战:(1)原理方面,由于BOLD是通过反映局部脑血流动力学变化来间接地反映局部神经元的变化,与真正的IEDs电活动在空间和时间上都有一定的差异。通过EEG-MRI-PET等多模态影像融合,在增进对癫痫BOLD机制研究的同时,也会提高致痫灶定位的准确性[26]。通过多种脑连接技术进行网络分析,也可以为EEG-fMRI癫痫脑网络理论方面增进理解[27]。(2)在技术方面,EEG-fMRI需要专用设备、操作复杂,且有硬件间相互干扰等问题,影响癫痫fMRI激活检出。对于EEG-fMRI系统噪声问题,可采用独立成分分析、模式识别及深度学习分析技术[27]去除噪声、增进预测信号与实际信号的贴合度。针对IEDs检出较低的问题,近来有设计出颅内EEG同步MRI技术,可有效提高IEDs的检出[28]。基于深度学习技术训练 IEDs检测器,辅助IEDs的自动检出,减轻了手动标记的负担[29]。针对特异HRF问题,可采用患者特异性HRF[18]、连续多HRF以及独立成分分析等解决[21]。
综上,借助高时间和空间分辨率互补的特性,同步EEG-fMRI从电活动到血氧代谢活动为癫痫研究提供全面测量,并且作为一项无创检查技术,在疑难癫痫病例的术前活动定位、癫痫重要脑功能的评价以及癫痫临床疗效评价方面,都有着独特的临床价值。可以预见,随着各项技术进步完善,同步EEG-fMRI技术将在癫痫的诊疗和研究中得到更加广泛的应用。
所有作者均声明不存在利益冲突
1.同步脑电图-功能磁共振(EEG-fMRI)设备需要解决的技术难点不包括()
A.强磁场环境下EEG设备的无磁性要求;
B.EEG信号对MRI图像的巨大影响;
C.MRI的射频脉冲对EEG产生巨大的干扰噪声;
D.强磁场会对生理性的心电和肌电产生放大作用,影响EEG的背景
2.下列哪个不是EEG-fMRI融合分析所必需()
A.标准空间分析技术;
B.EEG和MRI同步采集技术;
C.空间配准技术;
D.EEG溯源分析技术
3.哪项不是基于GLM分析的EEG-fMRI在癫痫活动检出时存在的问题()
A.癫痫IEDs需要考虑特异HRF;
B.数据驱动模型结果解释困难;
C.同步MRI会影响EEG对IEDs的检出性能;
D.需要准确知道IEDs发放的时间点
4.以下哪种说法不正确()
A.从理论上看,EEG-fMRI测量的是反映癫痫间期发放活 动的刺激区活动;
B.EEG-fMRI可以观察癫痫的脑认知功能损伤;
C.EEG-fMRI可以进行原发全面失神性癫痫的发作期观察;
D.EEG-fMRI可以进行原发全面强直阵挛性癫痫的发作期 观察
5.EEG-fMRI的优势不包括()
A.可以用来直接测量脑代谢活动;
B.可以在真实空间测量脑活动;
C.结合了EEG高时间分辨率和MRI的高空间分辨率特点;
D.多模态联合可以观察丰富的脑活动指标



























