
探讨D-CAG方案治疗初次诱导缓解失败的急性髓系白血病(AML)的转录组学机制及其临床疗效。
以"decitabine"为检索词在基因表达综合(GEO)数据库中检索2021年8月28日前使用地西他滨前后AML细胞转录组数据,使用R语言包对数据进行差异表达分析及京都基因和基因组百科全书(KEGG)和基因本体(GO)富集分析。采用STRING在线分析网站进行蛋白质互作网络(PPI)分析。利用基于逻辑组学理论设计的表观精准治疗预测平台(EpiMed)进行药物-疾病-靶点关联分析。检索并分析2015年10月8日至2018年7月9日在解放军第三○五医院使用标准蒽环类药物和阿糖胞苷方案("3+7"方案)诱导缓解失败后使用D-CAG方案治疗的18例AML患者临床资料,评价患者疗效,并分析各药物使用剂量和使用时间对疗效的影响。
最终选择GPL5188平台GSE40442数据集中地西他滨使用前后AML细胞转录组数据,更新时间为2014年7月10日。共筛选出差异基因366个,其中表达上调的基因201个,表达下调的基因165个。差异基因主要与细胞周期调节,骨髓白细胞迁移、分化,转录调控和骨髓造血等信号通路相关。PPI分析筛选得到ANXA5、IL-10、THBS1、TLR4、JUN和CXCL12等10个核心基因。药物-疾病-靶点分析发现地西他滨对弥漫大B细胞淋巴瘤、血小板减少症、急性T淋巴细胞白血病、再生障碍性贫血、AML等多种血液疾病具有潜在治疗作用。18例患者初次诱导缓解后获得部分缓解(PR)7例(38.8%),未缓解(NR)11例(61.2%);再次诱导缓解方案1个疗程后完全缓解(CR)9例,PR 5例,NR 4例,总有效率(ORR)77.8%(14/18)。初次诱导获得PR者较NR者在二次诱导时CR率高,分别为85.7%(6/7)和27.3%(3/11),差异具有统计学意义(P=0.049)。CR患者阿糖胞苷中位使用时间低于NR患者[10 d(7~14 d)比5 d(2~8 d),Z=3.89,P=0.002];CR患者骨髓原始细胞数与阿糖胞苷使用时间的比值中位数少于NR患者[2.29(0.89~9.10)比8.10(3.00~38.50),Z=-2.19,P=0.006];CR患者阿糖胞苷的中位剂量低于NR患者,分别为50 mg·m-2·d-1(30~150 mg·m-2·d-1)和100 mg·m-2·d-1(50~500 mg·m-2·d-1),差异无统计学意义(Z=-1.80,P=0.074)。
初次诱导达PR的初次诱导缓解失败的AML患者使用D-CAG方案治疗可能更易达CR,这种改变可能与地西他滨的表观调控作用相关。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
急性髓系白血病(AML)发病率随年龄的增加而增长[1]。"3+7"诱导方案是AML患者的标准诱导方案[2]。虽然近年来AML患者诱导缓解率逐步提高,但仍有部分患者不能达到完全缓解(CR)[3]。基因甲基化改变在AML发生中发挥重要作用。地西他滨为一种去甲基化药物,通过抑制DNA甲基转移酶,改善抑癌基因过度甲基化,抑制肿瘤细胞增殖,提高骨髓增生异常综合征(MDS)及AML患者治疗效果[4]。因此由地西他滨、阿糖胞苷、阿柔比星、粒细胞集落刺激因子(G-CSF)组成的D-CAG方案是初次诱导失败患者的常用挽救方案。为了解D-CAG方案不同药物剂量及使用时间对疗效的影响及药物间的相互作用,本文探讨地西他滨治疗AML的转录组学机制,分析D-CAG方案治疗初次诱导失败的AML患者临床资料及其疗效,为临床使用D-CAG方案治疗AML患者提供参考。
以"decitabine"为检索词,在基因表达综合(GEO)公共数据库进行检索,查看所有"series",数据截至2021年8月28日。筛选至少包括3个生物重复的人或小鼠细胞株转录组数据。使用Bioconductor中的R语言程序包进行归一化处理及差异分析。使用P<0.05初步筛选后应用Bonferroni算法校正假发现率(FDR)的原始P值并计算倍数变化(FC)。本研究中差异基因的筛选标准是FDR<0.05,|log2FC|>1。使用R语言中的clusterProfiler软件,对差异基因进行基因本体(GO)及京都基因和基因组百科全书(KEGG)富集分析。采用STRING V9.1开源数据库构建蛋白质互作网络(PPI),应用Cytoscape软件提供的cytohubba插件筛选前10位核心基因。
利用基于逻辑组学理论设计的表观精准治疗预测平台(EpiMed)进行药物-疾病-靶点关联分析[5,6]。以P<0.05作为筛选条件在已知疾病和临床常用药物中寻找地西他滨的适应证,为后续优化含地西他滨的AML联合治疗方案提供理论依据。
以"急性髓系白血病"和(或)"AML"为检索词在解放军第三〇五医院病历管理系统中检索2015年10月8日至2018年7月9日使用1个疗程标准"3+7"方案初次诱导未达CR的AML患者资料。所有患者均使用D-CAG为挽救方案;所有患者在治疗前均需完成血常规、骨髓形态学、免疫学、遗传学检查,诊断及分型标准参照国际诊断及疗效标准[3]。共检索并回顾性分析18例患者资料,其中男性9例,女性9例;中位年龄38岁(18~68岁);伴有重现性遗传学异常AML 5例,其他类型13例;中位骨髓白血病细胞比例0.345(0.098~0.910)。18例患者中初次诱导后获得部分缓解(PR)7例,未缓解(NR)11例,两组患者年龄、共患病数目、发病时白细胞总数、发病时白血病细胞比例、预后不良染色体核型、IDH突变和TET2突变等基因突变状态、免疫细胞表型及融合基因的比例差异均有统计学意义(均P<0.05)。本研究符合2013年修订的《赫尔辛基宣言》要求。
D-CAG方案使用过程中根据患者中性粒细胞水平及有无发热进行调整,当中性粒细胞<0.1×109/L或出现体温>38.1 ℃时,停止使用化疗药物,因此不同患者使用的剂量及时间有所不同。具体实施方案为地西他滨中位使用时间5 d(4~14 d),中位使用剂量20 mg/d(5~33 mg/d);阿柔比星中位使用时间5 d(4~10 d),中位使用剂量15 mg/d(10~20 mg/d);阿糖胞苷中位使用时间8 d(4~14 d),中位使用剂量100 mg/d(30~500 mg/d);G-CSF使用时间与阿糖胞苷相同,剂量分别为150、200、300 μg/d。地西他滨、阿糖胞苷和阿柔比星分别根据体表面积计算出单位剂量,见表1。
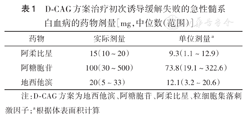
D-CAG方案治疗初次诱导缓解失败的急性髓系白血病的药物剂量[mg,中位数(范围)]
D-CAG方案治疗初次诱导缓解失败的急性髓系白血病的药物剂量[mg,中位数(范围)]
| 药物 | 实际剂量 | 单位剂量a |
|---|---|---|
| 阿柔比星 | 15(10~20) | 9.3(1.1~12.9) |
| 阿糖胞苷 | 100(30~500) | 73.8(19.1~322.6) |
| 地西他滨 | 20(5~33) | 12.1(3.2~20.6) |
注:D-CAG方案为地西他滨、阿糖胞苷、阿柔比星、粒细胞集落刺激因子;a根据体表面积计算
在化疗第28天,当血常规呈恢复趋势时复查骨髓象,具有分子遗传学异常标志的患者同时评估分子学指标。CR为骨髓原始细胞<0.05,外周血中性粒细胞绝对值(ANC)≥1.0×109/L,血小板计数(Plt)≥100×109/L,无髓外浸润;PR为骨髓原始细胞0.25~0.50(下降至少>50%);NR为治疗未达CR或PR的标准;总有效率(ORR)以CR+PR计算。
采用SPSS 16.0软件进行数据统计和分析。计量资料若符合正态分布,以 ±s表示,两组间比较采用独立样本t检验;若不符合正态分布,以中位数(范围)表示,两组间比较采用Mann-Whitney U检验;计数资料以频数(%)表示,组间比较采用Fisher确切概率法。以P<0.05为差异具有统计学意义。
±s表示,两组间比较采用独立样本t检验;若不符合正态分布,以中位数(范围)表示,两组间比较采用Mann-Whitney U检验;计数资料以频数(%)表示,组间比较采用Fisher确切概率法。以P<0.05为差异具有统计学意义。
本研究最终选用GPL5188平台GSE40442数据集中的地西他滨使用前后AML细胞转录组数据,最后更新时间为2014年7月10日。共筛选出差异基因366个,其中表达上调的基因201个,表达下调的基因165个(图1)。
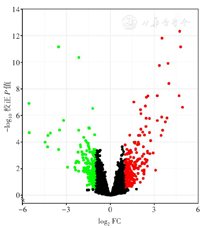

注:GEO为基因表达综合;D-CAG方案为地西他滨、阿糖胞苷、阿柔比星、粒细胞集落刺激因子;AML为急性髓系白血病;FDR为假发现率;FC为倍数变化;设置阈值FDR< 0.05,|log2FC| >1;红色为表达上调的基因;绿色为表达下调的基因
对全部差异基因进行富集分析。GO分析结果显示,在生物学进程方面,这些基因与白细胞迁移、分化,巨噬细胞活化,免疫反应,血管生成,止凝血等信号通路有关;在细胞成分方面,与血液微粒、免疫球蛋白分泌和转录调控等有关;在分子功能方面,大多与抗原抗体结合、转录调控、细胞黏附和细胞周期等有关(图2)。KEGG分析结果显示这些差异基因主要富集在补体及凝血级联反应、细胞趋化、物质代谢、转录调控、骨髓造血等相关信号通路(图3)。应用STRING在线数据库进行PPI网络构建,从中筛选出ANXA5、IL-10、THBS1、TLR4、JUN和CXCL12等前10位核心基因(图4)。
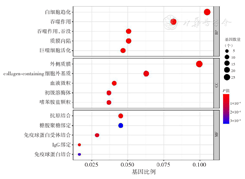

注:GEO为基因表达综合;AML为急性髓系白血病;GO为基因本体;D-CAG方案为地西他滨、阿糖胞苷、阿柔比星、粒细胞集落刺激因子;BP为生物学进程;CC为细胞成分;MF为分子功能
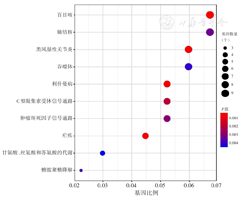

注:GEO为基因表达综合;AML为急性髓系白血病;KEGG为京都基因和基因组百科全书;D-CAG方案为地西他滨、阿糖胞苷、阿柔比星、粒细胞集落刺激因子
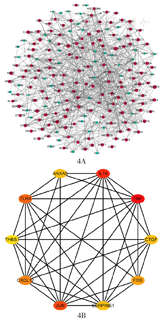

注:GEO为基因表达综合;AML为急性髓系白血病;D-CAG方案为地西他滨、阿糖胞苷、阿柔比星、粒细胞集落刺激因子
利用EpiMed进行关联分析结果显示,地西他滨对弥漫大B细胞淋巴瘤、血小板减少症、急性T淋巴细胞白血病、再生障碍性贫血、AML等多种血液疾病具有潜在治疗作用(表2)。
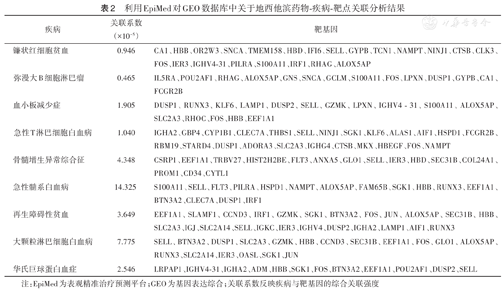
利用EpiMed对GEO数据库中关于地西他滨药物-疾病-靶点关联分析结果
利用EpiMed对GEO数据库中关于地西他滨药物-疾病-靶点关联分析结果
| 疾病 | 关联系数(×10-5) | 靶基因 |
|---|---|---|
| 镰状红细胞贫血 | 0.946 | CA1、HBB、OR2W3、SNCA、TMEM158、HBD、IFI6、SELL、GYPB、TCN1、NAMPT、NINJ1、CTSB、CLK3、FOS、IER3、IGHV4-31、PILRA、S100A11、IRF1、RHAG、ALOX5AP |
| 弥漫大B细胞淋巴瘤 | 0.465 | IL5RA、POU2AF1、RHAG、ALOX5AP、GNS、SNCA、GCLM、S100A11、FOS、LPXN、DUSP1、GYPB、CA1、FCGR2B |
| 血小板减少症 | 1.905 | DUSP1、RUNX3、KLF6、LAMP1、DUSP2、SELL、GZMK、LPXN、IGHV4-31、S100A11、ALOX5AP、SLC2A3、RHOC、FOS、HBB、EEF1A1 |
| 急性T淋巴细胞白血病 | 1.040 | IGHA2、GBP4、CYP1B1、CLEC7A、THBS1、SELL、NINJ1、SGK1、KLF6、ALAS1、AIF1、HSPD1、FCGR2B、RBM19、STARD4、DUSP1、ADORA3、SLC2A3、IGHG4、CTSB、MKX、HBEGF、FOS、NAMPT |
| 骨髓增生异常综合征 | 4.348 | CSRP1、EEF1A1、TRBV27、HIST2H2BE、FLT3、ANXA5、GLO1、SELL、IER3、HBD、SEC31B、COL24A1、PROM1、CD34、CYTL1 |
| 急性髓系白血病 | 14.325 | S100A11、SELL、FLT3、PILRA、HSPD1、NAMPT、ALOX5AP、FAM65B、SGK1、HBB、RUNX3、EEF1A1、BTN3A2、CLEC7A、DUSP1、IRF1 |
| 再生障碍性贫血 | 3.649 | EEF1A1、SLAMF1、CCND3、IRF1、GZMK、SGK1、BTN3A2、FOS、JUN、ALOX5AP、SEC31B、HBB、SLC2A3、IGJ、SLC2A14、SELL、IGKC、IER3、IGHV4、DUSP2、IGHA2、LAMP1、AIF1、RUNX3 |
| 大颗粒淋巴细胞白血病 | 7.775 | SELL、BTN3A2、DUSP1、SLC2A3、GZMK、HBB、CCND3、SEC31B、EEF1A1、FOS、GLO1、ALOX5AP、RUNX3、SLC2A14、IER3、OASL、SGK1、JUN |
| 华氏巨球蛋白血症 | 2.546 | LRPAP1、IGHV4-31、IGHA2、ADM、HBB、SGK1、FOS、BTN3A2、EEF1A1、POU2AF1、DUSP2、SELL |
注:EpiMed为表观精准治疗预测平台;GEO为基因表达综合;关联系数反映疾病与靶基因的综合关联强度
18例患者均在再次诱导缓解方案1个疗程后复查骨髓象,CR 9例,PR 5例,NR 4例,ORR 77.8%(14/18)。初次诱导获得PR者较NR者在二次诱导时CR率高,分别为85.7%(6/7)和27.3%(3/11),差异具有统计学意义(P=0.049)。
CR患者阿糖胞苷中位使用时间长于NR患者,差异具有统计学意义[10 d(7~14 d)比5 d(2~8 d),Z=3.89,P=0.002];CR患者骨髓原始细胞数与阿糖胞苷使用时间的比值中位数低于NR患者,差异有统计学意义[2.29(0.89~9.10)比8.10(3.00~38.50),Z=-2.19,P=0.006],提示可能需要根据原始细胞数目确定阿糖胞苷使用的时间;CR患者阿糖胞苷的中位剂量低于NR患者[50 mg·m-2·d-1(30~150 mg·m-2·d-1)比100 mg·m-2·d-1(50~500 mg·m-2·d-1)],差异无统计学意义(Z=-1.80,P=0.074)。
AML在老年人群中发病率较高[7]。阿糖胞苷和蒽环类药物联合治疗是AML患者的基本化疗方案,可以使60%新发患者和40%继发患者达到缓解[8]。但仍有许多患者由于出现疾病复发、进展或相关并发症而治疗失败导致死亡,因此强化化疗、小剂量阿糖胞苷和姑息治疗的方案对大多数AML患者并不是最好的选择[9]。研究发现去甲基化药物地西他滨可抑制DNA甲基转移酶1,重新激活沉默的基因,并诱导白血病细胞分化,在MDS和AML治疗中已表现出较好的单药临床活性,并具有患者生存率高、诱导化疗风险低的优势[10,11,12,13,14]。
研究表明,地西他滨可通过抑制DNA甲基转移酶1参与调节细胞分裂S期,而且这种效果在外周血细胞中更加明显[15]。Steffen等[16]研究发现地西他滨可与维生素D3协同诱导AML细胞株中单核细胞分化。本研究结果发现,地西他滨治疗AML不仅参与细胞周期调节和骨髓白细胞迁移、分化,同时参与物质代谢和骨髓造血等相关信号通路。
ANXA5、IL-10和THBS1的高度表达与AML患者良好的预后相关[17,18,19]。TLR4可通过与S100A9结合促进AML细胞分化[20]。JUN可通过未折叠蛋白反应的发生促进AML细胞在体内的增殖和存活[21]。CXCL12-CXCR4轴不仅可促进AML细胞在骨髓微环境中运输和归巢,同时可以使AML细胞与基质细胞、细胞外基质紧密接触,共同组成促生长和抗凋亡信号轴[22]。本研究证实,使用地西他滨后,ANXA5、IL-10、THBS1和TLR4等基因上调,而JUN和CXCL12等基因表达下调。提示地西他滨可通过对多个基因的调节而达到治疗AML的效果。
通过EpiMed分析发现,地西他滨对弥漫大B细胞淋巴瘤、血小板减少症、急性T淋巴细胞白血病、再生障碍性贫血、AML等多种血液疾病具有潜在治疗作用。前期研究也证实,低剂量地西他滨可以促进健康人和特发性血小板减少性紫癜(ITP)患者巨核细胞的成熟和血小板生成[23]。此外,地西他滨对弥漫大B细胞淋巴瘤和急性T淋巴细胞白血病具有一定的治疗作用[24,25]。
本研究病例分析发现,使用D-CAG方案化疗后,初次诱导达PR患者的CR率高于初次诱导达NR患者(85.7%比27.3%),提示两类患者具有不同的生物学特性。本研究中初次诱导达PR和NR患者,在患者年龄、共患病数目、发病时白细胞总数、发病时白血病细胞比例、预后不良染色体核型及基因突变状态等方面均差异有统计学意义(结果未显示)。但对解放军第三○五医院23例初次诱导后PR患者和20例初次诱导后NR患者的比较发现,NR患者多具有单核细胞表型,伴TET2突变和EVI1突变比例明显升高(文章待发表),提示两类患者具有不同的生物学特性。PR患者可能对D-CAG方案更敏感,所以才能达到CR。Fleming等[26]发现初次诱导达PR和NR的患者生存期差异有统计学意义。
研究发现不同患者D-CAG方案中各药物的剂量及使用时间存在明显的差异[27,28,29],本研究亦是如此。在临床实践中,对于不能耐受包含大剂量阿糖胞苷挽救方案的患者,D-CAG方案往往是首选方案,该方案有标准14 d方案和改良的7 d方案,在使用过程中根据患者的临床症状和外周血细胞分析延长或终止治疗,导致不同的患者D-CAG方案中各药物的剂量及使用时间存在明显的差异。因此本研究中分析了各种药物使用剂量和使用时间对治疗的影响。发现CR患者中阿糖胞苷使用时间明显延长,而且通过计算骨髓原始细胞数与阿糖胞苷使用时间的比值发现,CR患者低于NR患者,提示阿糖胞苷的长时间使用增加了对白血病细胞的杀伤作用,提示白血病细胞的数量是决定用药时间长短的潜在因素。郝杰等[30]发现使用D-CAG方案获得CR患者的治疗前骨髓原始细胞比值较低(<0.300),而CAG方案和标准"3+7"方案的疗效与治疗前骨髓原始细胞数值无关,提示骨髓原始细胞数值低者适合使用D-CAG方案。此外,阿糖胞苷使用时间对于患者的影响可能与白血病细胞的组成有关,白血病细胞由不同成熟程度的群体所组成。Muus等[31]发现来源于较前体的白血病细胞增殖周期长,多处于G0期,需要更长的时间进入G1期,因此延长阿糖胞苷的使用时间可以更加有效地杀伤此类白血病细胞,达到CR。
总之,本研究通过生物信息学方法分析地西他滨治疗AML的组学机制,而且用EpiMed预测其潜在适应证。本研究发现初次诱导后PR和NR患者具有不同的生物学特点,初次诱导后PR患者对D-CAG方案具有较好的反应性,易于达到CR。延长阿糖胞苷使用时间及降低骨髓原始细胞数与阿糖胞苷使用时间比值可能会提高D-CAG方案的CR率。
所有作者均声明不存在利益冲突



























