
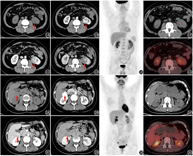
患者男,63岁,体格检查发现左肾占位5 d,无肉眼血尿、腹痛等不适。患者入院后完善腹部增强CT,可见左肾下极稍低密度肿块,大小为4.3 cm×3.5 cm×4.2 cm,增强扫描皮质期显著不均匀强化,实质期、排泄期强化逐渐减低(图1A,图1B,图1C,图1D)。为明确左肾肿物性质及全身情况行18F-FDG PET/CT显像,可见左肾下极稍低密度肿物,显像剂摄取相当于周围肾实质,SUVmax 3.8(图1E,图1F,图1G)。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者男,63岁,体格检查发现左肾占位5 d,无肉眼血尿、腹痛等不适。患者入院后完善腹部增强CT,可见左肾下极稍低密度肿块,大小为4.3 cm×3.5 cm×4.2 cm,增强扫描皮质期显著不均匀强化,实质期、排泄期强化逐渐减低(图1A,图1B,图1C,图1D)。为明确左肾肿物性质及全身情况行18F-FDG PET/CT显像,可见左肾下极稍低密度肿物,显像剂摄取相当于周围肾实质,SUVmax 3.8(图1E,图1F,图1G)。

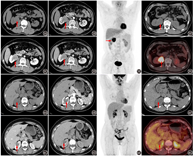
患者女,42岁,体格检查发现右肾肿物2周,腹部增强CT可见右肾前唇外突性肿块,大小为3.4 cm×3.3 cm×3.0 cm,增强扫描皮质期明显强化,实质期及排泄期强化低于肾实质(图2A,图2B,图2C,图2D)。患者进一步行18F-FDG PET/CT显像,见右肾中部前唇占位,显像剂摄取同周围肾实质相当,SUVmax 2.6(图2E,图2F,图2G)。
上述2例患者均为体格检查发现的肾实性占位,增强CT及PET/CT表现较为相似。这种情况下鉴别诊断要如何考虑,不同的肾实性占位又该如何鉴别?大多数发生于肾实质的实性占位并不引起明显的临床症状,患者可能于体格检查时发现。一般来说,肾实质单发的实性占位多考虑肿瘤性病变,常见的肾良性肿瘤以肾血管平滑肌脂肪瘤(angiomyolipoma, AML)、肾嗜酸细胞瘤(renal oncocytomas, RO)为主,恶性病变则多为肾细胞癌,包括肾透明细胞癌(clear cell renal cell carcinoma, ccRCC)、肾乳头状细胞癌(papillary renal cell carcinoma, PRCC)、肾嫌色细胞癌(chromophobe renal cell carcinoma, CRCC)等。
在18F-FDG PET/CT显像中,不同的肾实性占位的FDG摄取程度有所不同,但不同于其他部位的肿瘤,18F-FDG PET/CT对肾癌的诊断灵敏度不佳,其诊断肾细胞癌的灵敏度为32%~90%[1]。18F-FDG PET/CT诊断肾细胞癌灵敏度不高的主要原因有:约一半的18F-FDG直接经肾脏排泄,受放射性尿液影响可能难以区分病灶,并且影响SUV测量;肾癌细胞的去磷酸化常数较高,且细胞膜表面葡萄糖转运蛋白1表达较低,导致肿瘤细胞对FDG摄取程度不高[2]。
肾癌最常见的病理亚型是ccRCC,约占肾细胞癌的65%~75%,其FDG摄取程度与病理分级相关,一般来说高级别ccRCC(3和4级)的SUV高于低级别ccRCC(1和2级),且差异有统计学意义[1,3]。有文献报道,采用SUV 3~4为阈值来区分ccRCC病理分级的灵敏度可达80%以上[1,3]。PRCC是第二常见的肾癌亚型,约占肾细胞癌的15%~20%,PRCC可进一步分为Ⅰ型和Ⅱ型,其中Ⅱ型的侵袭性更高,预后更差[4]。PRCC的FDG代谢活性差异较大(如图3),有文献报道其SUV为3~10,高级别PRCC的SUV显著高于低级别PRCC[1,5]。CRCC约占肾细胞癌的5%,在生物学行为上为低度恶性肿瘤,与其他亚型肾癌相比,CRCC的生存率更高、预后更好[1]。CRCC的FDG摄取程度较低(如图4),有文献报道其SUV为1~3,中位SUV为1.9[1]。

肾良性肿瘤以肾AML最常见,其由畸形血管、平滑肌及成熟脂肪组织组成,大多数肾AML的FDG摄取程度较低,有文献报道其SUV为1~3[1,6],在个别文献中也有FDG高摄取的报道,SUVmax可达5.6[7]。RO是另一种较常见的肾良性肿瘤,其FDG代谢活性变异较大,SUV可低至1~2,也可高达10以上[8,9]。
由此可见,18F-FDG PET/CT对肾癌诊断效能不佳的原因,一是由于肾癌本身的FDG代谢活性差异大,二是由于良性肾肿瘤可能FDG代谢较高。与其他部位的肿瘤相比,肾肿瘤的术前诊断要更准确,因为肾功能的特殊性,肾占位是否要手术切除、切除多大范围、可以保留多少肾功能是非常重要的问题;另外由于肾占位穿刺活组织检查(简称活检)的诊断特异性较低,并且有导致腹膜种植转移的风险,所以孤立性肾占位一般不行穿刺活检,这就对影像诊断提出了更高的要求。
CT和MR对于肾肿瘤的鉴别诊断非常重要。ccRCC为富血供肿瘤,CT或MR增强扫描呈明显强化,强化程度可与肾皮质相当,表现出"快进快出"的强化模式。另外,由于ccRCC的肿瘤细胞发生脂肪变性的概率较高,所以在MR上ccRCC可见到同相位和反相位信号减低。PRCC和CRCC为相对乏血供的肿瘤,增强扫描的强化程度较低;此外CRCC一般密度较均匀,部分肿瘤还可见不强化的中央瘢痕。肾AML的CT和MR表现根据瘤内血管、脂肪、平滑肌成分的多少可有不同表现,脂肪成分在CT平扫上为脂肪密度影,CT值为-20~-110 HU,MR压脂相也可识别出脂肪成分;血管成分丰富者增强扫描可见明显强化,强化表现可接近ccRCC。RO一般为高~中等程度的强化,约1/3 RO可见中央瘢痕,中央瘢痕区可见延迟强化。
除以上常规的影像方法外,近年来的一些研究也证明了99Tcm-甲氧基异丁基异腈(methoxyisobutylisonitrile, MIBI)在肾肿瘤鉴别中的独特意义[10,11]。99Tcm-MIBI是一种亲脂性阳离子,在富含线粒体的细胞中聚集,而RO的病理特征恰恰是由大量富含线粒体的嗜酸细胞组成,因此可以大量浓聚99Tcm-MIBI。而大多数肾细胞癌的线粒体含量较低,另外肾细胞癌有高表达多药耐药泵的特征,会主动将99Tcm-MIBI转运至细胞外,所以肾细胞癌一般不摄取或很少摄取99Tcm-MIBI[10]。因此在99Tcm-MIBI显像中,RO表现为高摄取(摄取程度高于或相当于正常肾实质),而肾癌则表现为低摄取,这一方法鉴别RO与肾癌的灵敏度可达87.5%,特异性达95.2%[11]。11C-乙酸盐也是在肾肿瘤中被研究较多的一种显像剂,其在肿瘤组织中的浓聚主要与细胞的脂肪合成及磷脂膜形成相关。肾AML的11C-乙酸盐摄取程度显著高于肾癌[12],因此若肾占位的18F-FDG代谢不高,需进一步鉴别肾癌与肾AML时,可考虑行11C-乙酸盐显像。
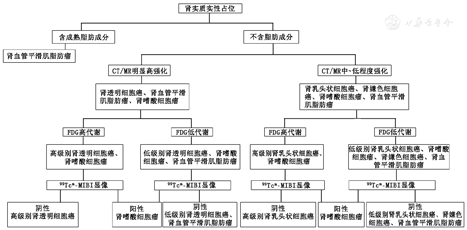
结合上述几种常见的肾实质肿瘤各自的影像学特征,可梳理出肾实质实性占位的大致诊断思路(图5)。首先,若CT、MR上可见明确的脂肪成分,则考虑为肾AML。其次,看CT和MR的强化程度及方式,若为明显的高强化,提示可能为ccRCC、肾AML或RO;若为中~低程度的强化,则可能为PRCC、CRCC、RO或肾AML。除强化程度外,还应关注强化方式,ccRCC多为"快进快出"的强化,而"快进慢出"的强化模式则多为肾AML。然后再看18F-FDG的代谢,FDG高代谢提示为高级别的ccRCC或PRCC,有时也可能为RO;若为FDG低代谢,则可能为低级别的ccRCC或PRCC、CRCC、RO或肾AML。若要进一步排除或诊断RO,可行99Tcm-MIBI显像。此外,还应结合其他一些影像学征象,如ccRCC及PRCC常见钙化、坏死,而CRCC则密度均匀;肾AML由于含脂肪成分,多数质地较软,对周围肾实质压迫较轻,可见"劈裂征"等。

回顾之前的病例1、2,二者增强CT都表现为明显强化、"快进快出",FDG代谢程度不高,与正常肾实质相当,鉴别诊断应考虑低级别ccRCC、肾AML或RO。之后2例患者均接受了手术,病例1为ccRCC(WHO 2级),病例2为肾AML。
18F-FDG PET/CT对肾占位的鉴别诊断有很大局限性,这就要求医师对肾占位的CT、MR等影像特征要更为熟悉,对病理特点和分子特征的理解要更深入,才能根据每种病变的不同影像征象做出综合判断。
所有作者声明无利益冲突


























