
肾性贫血是慢性肾脏病(CKD)患者常见且重要的并发症。目前,肾性贫血的治疗药物主要为促红细胞生成素刺激剂(ESA)和铁剂,但仍不能完全满足临床需求。低氧诱导因子(HIF)是调节氧稳态失衡的核因子,通过使用HIF脯氨酰羟化酶抑制剂(HIF-PHI)调控HIF通路成为治疗肾性贫血新策略。我国率先在国际上完成全球首个HIF-PHI类药物罗沙司他治疗肾性贫血Ⅲ期临床试验,并于2018年首先批准上市应用,取得了较为丰富的临床应用经验。为了及时总结临床经验,更好地指导罗沙司他临床用药,改善CKD患者贫血治疗效果,中国研究型医院学会肾脏病学专业委员会组织我国肾脏领域的专家共同制定《罗沙司他治疗肾性贫血中国专家共识》。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
贫血是慢性肾脏病(chronic kidney disease,CKD)患者最常见的临床表现之一,其发生有着复杂的病理生理学基础,包括肾组织氧感知系统失调导致的促红细胞生成素(erythropoiesis,EPO)合成减少、EPO抵抗、铁代谢紊乱、各种毒素导致红细胞寿命缩短、炎症反应以及失血等。贫血不仅影响肾脏疾病患者的生活质量[1, 2],还促进肾脏病进展,增加心血管事件及死亡的风险[1,3, 4]。及时改善肾性贫血对提高患者生活质量和临床预后,减轻患者和社会负担具有重要的临床意义。目前,临床上主要使用促红细胞生成刺激剂(erythropoiesis stimulating agents,ESA)和铁剂治疗肾性贫血。然而,肾性贫血治疗达标率低以及大剂量ESA使用所导致的血压升高、卒中和肿瘤进展风险增加等是肾性贫血临床治疗中面临的主要挑战[5, 6],此外,部分患者对ESA低反应,甚至ESA引起单纯红细胞再生障碍性贫血,因此肾性贫血治疗仍然存在诸多未被满足的临床需要。
低氧诱导因子(hypoxia inducible factor,HIF)是由α亚基(HIF-α)和β亚基(HIF-β)组成的二聚复合体转录因子,是机体适应氧稳态失衡的核心调节因子。调节HIF的氧感应信号主要是脯氨酰羟化酶(prolyl hydroxylase domain,PHD),针对PHD研发的低氧诱导因子脯氨酸羟化酶抑制剂(hypoxia inducible factor prolyl-hydroxylase inhibitors,HIF-PHI)通过抑制PHD活性稳定HIF的表达,后者直接与肾脏和肝脏的EPO基因HIF结合位点特异性结合,促进EPO表达[7, 8]。此外,HIF-PHI还可促进EPO受体(EPO receptor,EPOR)表达,上调十二指肠细胞色素B(Duodenal Cytochrome B,DCytB)和二价金属离子转运体(Divalent Metal Transporter,DMT)增加肠道对铁的吸收,下调铁调素水平,促进肝细胞和巨噬细胞释放铁,增加机体可利用铁,改善铁代谢紊乱,促进机体红细胞的生成[9]。
罗沙司他(Roxadustat,FG‐4592)是全球第一个HIF-PHI类药物,作为机制全新的新一代肾性贫血治疗药物,我国于2018年在全球率先完成了Ⅲ期临床试验并正式获批上市[10],迄今已在临床应用3年,积累了较为丰富的临床经验。为了更好地指导临床用药,提高药物治疗效果,进一步优化肾性贫血治疗策略,改善患者预后,中国研究型医院学会肾脏病学专业委员会组织我国肾脏领域的专家共同制定《罗沙司他治疗肾性贫血中国专家共识》。
本共识检索PubMed、Embase、中国知网、万方数据库及中国生物医学文献数据库发表的英文和中文文献,并评价论文的证据等级。共识编写专家组参照推荐强度和证据等级相结合的方法,将推荐强度分为:(1)推荐;(2)建议。采用世界卫生组织等制定的“推荐分级的评价、制定与评估(Grades of Recommendations Assessment,Development and Evaluation,GRADE)”进行证据质量分级[11],具体如下:A:证据基于多项RCT临床试验或meta分析;B:证据基于单项RCT临床试验或多项非随机对照研究;C:证据基于非随机对照研究或专家共识意见;D:证据基于病例观察、个案报道;未分级:不能明确推荐。推荐意见采用专家一致性原则,存在不同专家意见时,采用投票超过2/3的专家意见。同时,借鉴和参考了目前国内外相关临床指南。
罗沙司他是一种小分子化合物,可逆性抑制PHD活性,模拟机体低氧环境,短暂并呈剂量依赖性诱导HIF稳定表达,从而促进HIF下游靶基因EPO的表达,诱导红细胞生成,改善肾性贫血。另外,罗沙司他尚可通过促进机体EPOR的表达,降低铁调素水平,增加机体对铁的吸收、转运和利用,多靶点综合促进红细胞的生成[12]。
罗沙司他半衰期为12.8 h,每周口服给药2~3次,主要通过细胞色素P450(cytochrome P450,CYP)2C8代谢并通过和葡糖醛酸转移酶结合排泄[13],罗沙司他间歇性给药方式可以长期维持治疗效果,不会导致治疗敏感性降低。此外,药代动力学研究发现,饮食对罗沙司他无显著影响,罗沙司他可空腹服用或与食物同服[14]。由于透析不对罗沙司他的清除率产生显著影响,因此,罗沙司他可在透析前或透析后用药[15]。
1. 透析依赖(包括血液透析和腹膜透析)CKD患者合并肾性贫血的治疗(1A):中国透析依赖CKD患者的多中心、前瞻性、随机对照研究结果显示,罗沙司他和阿法依泊汀均能有效提升血液透析与腹膜透析患者的血红蛋白(hemoglobin,Hb)水平[16];日本透析人群的随机、双盲、阳性对照研究也证实了相似的结果[17]。同时,欧美的多项多中心、随机对照Ⅲ期临床研究也显示罗沙司他在腹膜透析和血液透析肾性贫血患者中治疗有效。此外,透析患者多中心、开放标签研究汇总分析结果显示,无论既往是否接受过ESA治疗,转换至罗沙司他治疗后均可有效纠正肾性贫血,并维持Hb稳定[18, 19, 20, 21, 22]。罗沙司他在透析依赖CKD患者Ⅲ期临床试验的有效性和安全性比较见表1。
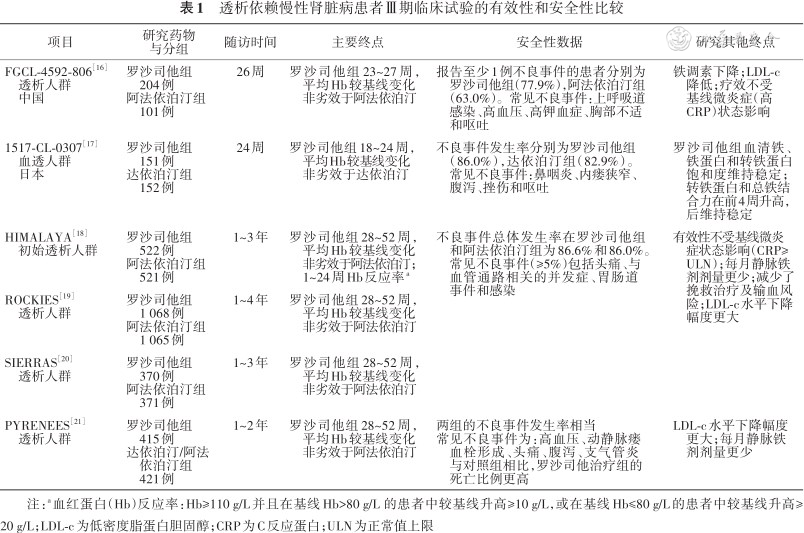
透析依赖慢性肾脏病患者Ⅲ期临床试验的有效性和安全性比较
透析依赖慢性肾脏病患者Ⅲ期临床试验的有效性和安全性比较
| 项目 | 研究药物 与分组 | 随访时间 | 主要终点 | 安全性数据 | 研究其他终点 |
|---|---|---|---|---|---|
FGCL-4592-806[16] 透析人群 中国 | 罗沙司他组 204例 阿法依泊汀组 101例 | 26周 | 罗沙司他组23~27周, 平均Hb较基线变化 非劣效于阿法依泊汀 | 报告至少1例不良事件的患者分别为 罗沙司他组(77.9%),阿法依泊汀组 (63.0%)。常见不良事件:上呼吸道 感染、高血压、高钾血症、胸部不适 和呕吐 | 铁调素下降;LDL-c 降低;疗效不受 基线微炎症(高 CRP)状态影响 |
1517-CL-0307[17] 血透人群 日本 | 罗沙司他组 151例 达依泊汀组 152例 | 24周 | 罗沙司他组18~24周, 平均Hb较基线变化 非劣效于达依泊汀 | 不良事件发生率分别为罗沙司他组 (86.0%),达依泊汀组(82.9%)。 常见不良事件:鼻咽炎、内瘘狭窄、 腹泻、挫伤和呕吐 | 罗沙司他组血清铁、 铁蛋白和转铁蛋白 饱和度维持稳定; 转铁蛋白和总铁结 合力在前4周升高, 后维持稳定 |
HIMALAYA[18] 初始透析人群 | 罗沙司他组 522例 阿法依泊汀组 521例 | 1~3年 | 罗沙司他组28~52周, 平均Hb较基线变化 非劣效于阿法依泊汀; 1~24周Hb反应率a | 不良事件总体发生率在罗沙司他组 和阿法依泊汀组为86.6%和86.0%。 常见不良事件(≥5%)包括头痛、与 血管通路相关的并发症、胃肠道 事件和感染 | 有效性不受基线微炎 症状态影响(CRP≥ ULN);每月静脉铁 剂剂量更少;减少了 挽救治疗及输血风 险;LDL-c水平下降 幅度更大 |
ROCKIES[19] 透析人群 | 罗沙司他组 1 068例 阿法依泊汀组 1 065例 | 1~4年 | 罗沙司他组28~52周, 平均Hb较基线变化 非劣效于阿法依泊汀 | ||
SIERRAS[20] 透析人群 | 罗沙司他组 370例 阿法依泊汀组 371例 | 1~3年 | 罗沙司他组28~52周, 平均Hb较基线变化 非劣效于阿法依泊汀 | ||
PYRENEES[21] 透析人群 | 罗沙司他组 415例 达依泊汀/阿法 依泊汀组 421例 | 1~2年 | 罗沙司他组28~52周, 平均Hb较基线变化 非劣效于阿法依泊汀 | 两组的不良事件发生率相当 常见不良事件为:高血压、动静脉瘘 血栓形成、头痛、腹泻、支气管炎 与对照组相比,罗沙司他治疗组的 死亡比例更高 | LDL-c水平下降幅度 更大;每月静脉铁 剂剂量更少 |
注:a血红蛋白(Hb)反应率:Hb≥110 g/L并且在基线Hb>80 g/L 的患者中较基线升高≥10 g/L,或在基线Hb≤80 g/L的患者中较基线升高≥20 g/L;LDL-c为低密度脂蛋白胆固醇;CRP为C反应蛋白;ULN为正常值上限
2. 非透析依赖CKD患者合并肾性贫血的治疗(1A):中国非透析依赖CKD患者的多中心、前瞻性、随机对照研究结果显示,罗沙司他组Hb水平相对于基线平均增加(19±12)g/L,而安慰剂组Hb水平较基线降低(4±8)g/L,证实罗沙司他可有效提升非透析依赖CKD患者Hb水平[23, 24]。此外,欧美的多项多中心、随机对照Ⅲ期临床研究也显示,罗沙司他在非透析肾性贫血患者中治疗有效[25, 26, 27, 28]。非透析依赖CKD患者Ⅲ期临床试验的有效性和安全性的比较见表2。
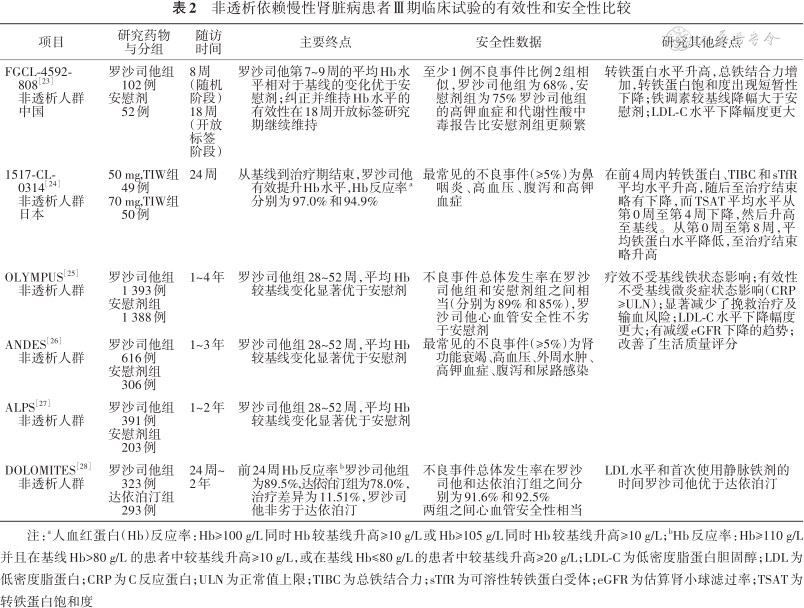
非透析依赖慢性肾脏病患者Ⅲ期临床试验的有效性和安全性比较
非透析依赖慢性肾脏病患者Ⅲ期临床试验的有效性和安全性比较
| 项目 | 研究药物 与分组 | 随访 时间 | 主要终点 | 安全性数据 | 研究其他终点 |
|---|---|---|---|---|---|
FGCL-4592- 808[23] 非透析人群 中国 | 罗沙司他组 102例 安慰剂 52例 | 8周 (随机 阶段) 18周 (开放 标签 阶段) | 罗沙司他第7~9周的平均Hb水 平相对于基线的变化优于安 慰剂;纠正并维持Hb水平的 有效性在18周开放标签研究 期继续维持 | 至少1例不良事件比例2组相 似,罗沙司他组为68%,安 慰剂组为75%罗沙司他组 的高钾血症和代谢性酸中 毒报告比安慰剂组更频繁 | 转铁蛋白水平升高,总铁结合力增 加,转铁蛋白饱和度出现短暂性 下降;铁调素较基线降幅大于安 慰剂;LDL-C水平下降幅度更大 |
1517-CL- 0314[24] 非透析人群 日本 | 50 mg,TIW组 49例 70 mg,TIW组 50例 | 24周 | 从基线到治疗期结束,罗沙司他 有效提升Hb水平,Hb反应率a 分别为97.0%和94.9% | 最常见的不良事件(≥5%)为鼻 咽炎、高血压、腹泻和高钾 血症 | 在前4周内转铁蛋白、TIBC和sTfR 平均水平升高,随后至治疗结束 略有下降,而TSAT平均水平从 第0周至第4周下降,然后升高 至基线。从第0周至第8周,平 均铁蛋白水平降低,至治疗结束 略升高 |
OLYMPUS[25] 非透析人群 | 罗沙司他组 1 393例 安慰剂组 1 388例 | 1~4年 | 罗沙司他组28~52周,平均Hb 较基线变化显著优于安慰剂 | 不良事件总体发生率在罗沙 司他组和安慰剂组之间相 当(分别为89%和85%),罗 沙司他心血管安全性不劣 于安慰剂 最常见的不良事件(≥5%)为肾 功能衰竭、高血压、外周水肿、 高钾血症、腹泻和尿路感染 | 疗效不受基线铁状态影响;有效性 不受基线微炎症状态影响(CRP ≥ULN);显著减少了挽救治疗及 输血风险;LDL-C水平下降幅度 更大;有减缓eGFR下降的趋势; 改善了生活质量评分 |
ANDES[26] 非透析人群 | 罗沙司他组 616例 安慰剂组 306例 | 1~3年 | 罗沙司他组28~52周,平均Hb 较基线变化显著优于安慰剂 | ||
ALPS[27] 非透析人群 | 罗沙司他组 391例 安慰剂组 203例 | 1~2年 | 罗沙司他组28~52周,平均Hb 较基线变化显著优于安慰剂 | ||
DOLOMITES[28] 非透析人群 | 罗沙司他组 323例 达依泊汀组 293例 | 24周~ 2年 | 前24周Hb反应率b罗沙司他组 为89.5%,达依泊汀组为78.0%, 治疗差异为11.51%,罗沙司 他非劣于达依泊汀 | 不良事件总体发生率在罗沙 司他和达依泊汀组之间分 别为91.6%和92.5% 两组之间心血管安全性相当 | LDL水平和首次使用静脉铁剂的 时间罗沙司他优于达依泊汀 |
注:a人血红蛋白(Hb)反应率:Hb≥100 g/L同时Hb较基线升高≥10 g/L或Hb≥105 g/L同时Hb较基线升高≥10 g/L;bHb反应率:Hb≥110 g/L 并且在基线Hb>80 g/L 的患者中较基线升高≥10 g/L,或在基线Hb≤80 g/L的患者中较基线升高≥20 g/L;LDL-C为低密度脂蛋白胆固醇;LDL为低密度脂蛋白;CRP为C反应蛋白;ULN为正常值上限;TIBC为总铁结合力;sTfR为可溶性转铁蛋白受体;eGFR为估算肾小球滤过率;TSAT为转铁蛋白饱和度
总之,罗沙司他可用于CKD患者贫血的治疗,包括血液透析、腹膜透析与非透析的成年CKD患者[29, 30, 31],以更便捷地改善患者贫血症状[32],降低对静脉铁剂和输血的需求[33]。
3. 伴有微炎症状态CKD患者肾性贫血的治疗(2B):中国Ⅲ期临床试验中的微炎症[基线C-反应蛋白(C-reactive protein,CRP)>4.9 mg/L]亚组分析结果显示,与阿法依泊汀组相比,罗沙司他组Hb 水平升高幅度增加[(9±10)g/L与(3±11)g/L],且不增加罗沙司他的药物剂量[16]。日本透析人群的随机、双盲、阳性对照研究也证实了该结果,在伴有微炎症的血液透析患者中,罗沙司他组应用不需要增加剂量,但达依泊汀需要更高剂量来维持目标Hb水平[17]。
因此,罗沙司他改善贫血不受微炎症状态的影响,在伴有微炎症状态的患者中可优先考虑应用罗沙司他治疗,以获得更优的贫血治疗效果。
4. 对于治疗效果受便利性和依从性等因素影响的非透析或腹膜透析的CKD贫血患者的治疗:结合疾病特点、临床疗效和患者意愿等因素,起始治疗时可考虑口服罗沙司他(2,未分级)。
5. 特殊患者的治疗:(1)炎症性贫血患者:炎症是肾性贫血患者最常见的合并症,也是导致贫血治疗抵抗的重要原因之一[34]。炎症可能由感染或非感染性疾病引起,包括明确的病原菌感染性炎症、免疫性疾病以及代谢性疾病等所致的炎症反应和微炎症状态。炎症性贫血治疗原则主要是治疗原发基础疾病。当炎症呈慢性、较难控制或诊断不明时,传统的铁剂和ESA治疗往往效果不佳甚至无效。越来越多的病例报道,罗沙司他能够降低铁调素,纠正铁代谢紊乱,显著改善此类贫血患者的血红蛋白水平,因此,罗沙司他在该类人群中的治疗作用值得探讨[35, 36]。(2)ESA低反应患者:首先需筛查发生ESA低反应性的潜在病因,针对ESA低反应性的特定病因进行治疗。有研究显示,部分ESA低反应者应用罗沙司他可有效升高Hb水平[37]。罗沙司他治疗中国血液透析患者ESA抵抗人群亚组分析中,入组前接受稳定剂量ESA治疗,但基线Hb<100 g/L的患者中,在罗沙司他治疗26周后,94.4%的患者Hb≥100 g/L,83.3%的患者达到Hb≥110 g/L[16]。在日本血液透析患者的ESA抵抗人群亚组分析中也获得了相似的结果[17]。但由于亚组分析的研究对象数量较少,基线不一致,尚待进一步的大样本随机对照研究来证实[38]。(3)功能性铁缺乏患者:对于网织红细胞Hb(reticulocyte hemoglobin content,CHr)<29 pg和(或)血清可溶性转铁蛋白受体(soluble transferrin receptor,sTfR)/铁蛋白(serum ferritin,SF)对数(sTfR/log SF)的比值>2的患者,可尝试罗沙司他治疗,以改善功能性铁缺乏[39]。考虑到较少单位开展sTfR/log SF的检测,我们建议仍然使用既往肾性贫血指南定义的SF和转铁蛋白饱和度(transferrin saturation,TSAT)水平来判断功能性铁缺乏[40]。
建议罗沙司他治疗肾性贫血的起始治疗时机为Hb<100 g/L(2,未分级)。
在我国CKD 患者的罗沙司他Ⅲ期临床研究中,非透析CKD患者的Hb基线水平为70 g/L≤Hb<100 g/L[23];透析患者因已接受ESA治疗,转换成罗沙司他治疗时Hb基线水平为90~120 g/L[16]。日本一项在既往接受过ESA治疗或尚未接受ESA治疗的血液透析贫血患者的研究中,以Hb<100 g/L为纳入标准[17]。目前没有针对罗沙司他起始治疗时机的研究,参考罗沙司他临床试验及结合ESA治疗时机[40, 41, 42, 43],建议罗沙司他起始治疗时机为Hb<100 g/L。
罗沙司他治疗肾性贫血时,Hb靶目标维持≥110 g/L,但不超过130 g/L(2,未分级)。目前尚未开展罗沙司他在CKD贫血治疗时不同靶目标的研究,建议仍以既往ESA治疗靶目标为参考,肾性贫血治疗的Hb靶目标为:Hb≥110 g/L,但不超过130 g/L[40]。
肾性贫血患者,应依据患者年龄、透析方式、基础疾病、生理需求及并发症情况个体化调整Hb靶目标[40],建议在应用罗沙司他治疗时,维持Hb稳定,并最大限度地降低对输血的需求。
1. 起始剂量选择:罗沙司他治疗肾性贫血的起始剂量建议,透析患者为每次100 mg(体重<60 kg)或120 mg(体重≥60 kg),非透析患者为每次70 mg(体重<60 kg)或100 mg(体重≥60 kg),每周3次,口服给药(2,未分级)。但需个体化并以较小的起始剂量开始使用(2C)。
推荐按体重选择罗沙司他的起始剂量:基于2项中国患者的罗沙司他Ⅲ期临床研究结果,建议透析患者为每次100 mg(体重<60 kg)或120 mg(体重≥60 kg),非透析患者为每次70 mg(体重<60 kg)或100 mg(体重≥60 kg),口服给药,每周3次[16,23]。同时,需要结合患者年龄、体重、既往使用ESA剂量、基础Hb值、铁代谢、营养状态以及透析方式等多种因素,个体化并以较小的起始剂量开始使用。
对于从ESA转换到罗沙司他治疗的患者,起始剂量可参考下表(表3)[22]。
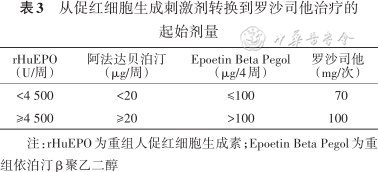
从促红细胞生成刺激剂转换到罗沙司他治疗的起始剂量
从促红细胞生成刺激剂转换到罗沙司他治疗的起始剂量
rHuEPO (U/周) | 阿法达贝泊汀 (μg/周) | Epoetin Beta Pegol (μg/4周) | 罗沙司他 (mg/次) |
|---|---|---|---|
| <4 500 | <20 | ≤100 | 70 |
| ≥4 500 | ≥20 | >100 | 100 |
注:rHuEPO为重组人促红细胞生成素;Epoetin Beta Pegol为重组依泊汀β聚乙二醇
2. 剂量调整优化方案:根据Hb水平及变化幅度及时调整剂量,使Hb水平维持在110~120 g/L(1B)。
在罗沙司他起始治疗阶段,建议根据患者Hb水平和Hb的增减幅度调整剂量,并密切观察个体反应。过高Hb水平以及Hb升高速度过快可能增加深静脉血栓和血管通路血栓形成的风险。建议每1~2周监测1次Hb水平,注意观察Hb升高速度和幅度,直至趋于稳定,随后每4周监测1次Hb。剂量调整方案如表4。

罗沙司他剂量调整优化方案
罗沙司他剂量调整优化方案
| 根据Hb的变化(g/L) | 剂量调整时Hb水平(g/L) | |||
|---|---|---|---|---|
| <110 | 110~<120 | 120~<130 | ≥130 | |
| 下降>10 | 剂量增加 | 剂量增加 | 维持 | 暂停给药,监测Hb;当Hb<120时,降低一个阶梯剂量,恢复给药 |
| 变化-10~10 | 剂量增加 | 维持 | 剂量减少 | |
| 增加>10 | 维持 | 剂量减少 | 剂量减少 | |
注:剂量增加和剂量减少:(1)剂量阶梯包括:20、40、50、70、100、120、150和200 mg,建议最大剂量为2.5 mg/kg;(2)血红蛋白(Hb)升高过快时的剂量调整:如果患者2周内 Hb增加>20 g/L,且>90 g/L,则剂量应降低一个阶梯;(3)Hb升高过快时,建议在4周内仅降低1次剂量;(4)在升高剂量期间,建议仅增加每次给药剂量,不增加每周给药次数;在降低剂量期间,先降低每次剂量,再降低每周给药次数
罗沙司他治疗肾性贫血应监测铁代谢状态,必要时联合铁剂治疗;口服铁剂在多数患者达到与静脉铁剂同样的效果(2B)。对于起始治疗阶段的患者,应定期监测铁指标,检测频率至少每月1次;而对于贫血维持治疗阶段或Hb较为稳定的患者,建议至少每3个月检测1次(1C)。
在初始使用罗沙司他治疗之前,需评估铁代谢状态,并且多项临床研究结果显示,罗沙司他可降低铁调素与铁蛋白水平,升高转铁蛋白与总铁结合力(total iron binding capacity,TIBC)[16,23,44],这些证据提示罗沙司他可增加铁利用而降低铁储备。一般认为,CKD透析前和腹膜透析患者SF<100 μg/L 和(或)TSAT<20%;血液透析患者SF<200 μg/L和(或)TSAT<20%时应联合铁剂治疗。可首选口服铁剂治疗,血液透析和腹膜透析患者中的随机开放标签研究结果显示,口服铁剂与静脉铁剂具有相似的升高Hb疗效[16,23],当口服铁不能耐受时可考虑静脉补铁治疗。
目前罗沙司他治疗和维持Hb治疗期间,铁剂的治疗时机、铁状态指标的监测时机与频率、合适的铁剂治疗靶目标尚未明确。我们建议,对于起始治疗阶段的患者应定期监测铁指标,检测频率至少每月检测1次;而对于维持治疗阶段或Hb较为稳定的,建议至少每3个月检测1次。
1. 老年患者:65岁以上患者无需调整起始剂量。
2. 儿童患者:18岁以下患者中使用罗沙司他的安全性和有效性尚未确立。
3. 肝功能损害患者:轻度肝功能损害(Child-Pugh A级)患者无需调整起始剂量;中度肝功能损害(Child-Pugh B级)对罗沙司他的药代动力学和药效学产生影响[45],但临床意义尚需观察;而对于重度肝功能损害(Child-Pugh C级)患者,罗沙司他的安全性与有效性目前尚无使用经验。
4. 孕妇与哺乳期女性:禁用罗沙司他。
建议在罗沙司他起始治疗时评估肿瘤风险,治疗期间定期评估高血压、高钾血症、心血管事件、视网膜病变、肿瘤、血栓相关事件、惊厥发作和严重感染等风险(2,未分级)。
目前,罗沙司他已经在20余个国家开展了几十项临床研究,但大多数临床研究随访时间较短。由于受HIF调控的下游靶基因众多,罗沙司他安全性尚需要更长时间和更多受试者应用以确定[46, 47, 48]。
1. 高血压:在我国罗沙司他Ⅲ期临床试验中,罗沙司他治疗期间高血压发生率在非透析患者为6%[23],透析患者为12.3%;透析患者低血压发生率为4.9%[16]。但与对照组相比,罗沙司他对透析和非透析患者的血压影响差异无统计学意义。尽管如此,罗沙司他治疗期间仍应对血压进行密切监测。
2. 高钾血症:在我国罗沙司他的Ⅲ期临床试验中,罗沙司他治疗期间高钾血症发生率非透析患者为16%(安慰剂对照组为8%)[23],透析患者为7.4%(阿法依泊汀对照组为1%)[16]。罗沙司他治疗期间高钾血症的发生机制尚不明确。建议罗沙司他治疗期间定期检测血钾水平。
3. 罗沙司他心血管安全性:对于非透析依赖(not dialysis-dependent,NDD)CKD患者,一项纳入4 277例患者(3个随机对照研究)的汇总分析显示,罗沙司他组在主要不良心血管事件[(major adverse cardiac events,MACE),定义为全因死亡率、心肌梗死或卒中]风险方面非劣于安慰剂对照组(罗沙司他组发生率10.6%与安慰剂组发生率10.3%;HR:1.10,95%CI:0.96~1.27,P>0.05)[49]。对于透析依赖(dialysis-dependent,DD)CKD患者,一项纳入4 714例患者(4个随机对照研究)的汇总分析显示,罗沙司他组在主要不良心血管事件(MACE,定义为全因死亡率、心肌梗死或卒中)风险方面非劣于ESA对照组(罗沙司他组发生率15.8%与ESA组发生率16.9%;HR:1.09,95%CI:0.95~1.26,P>0.05)[50]。而另一项纳入1 680例DD患者(5个随机对照研究)的汇总分析显示,罗沙司他组发生严重不良事件(主要指感染、死亡、肾脏、心脏、血管、血液和淋巴疾病)的发生率要高于ESA对照组(OR:1.33,95%CI:1.06~1.68,P<0.05)[31]。因此,罗沙司他治疗的心血管安全性仍需进一步的大样本、长期的临床研究来进行评价。
4. 视网膜病变:虽然HIF通路活化可能通过直接转录靶基因血管内皮生长因子(vascular endothelial growth factor,VEGF)促进视网膜血管生成,加重视网膜病变[51],但临床试验结果表明,罗沙司他应用后视网膜病变不良事件的发生率较低,且未发现罗沙司他相比于对照组在DD及NDD患者中增加眼部疾病风险[52]。由于这些临床试验随访时间偏短,样本量较小,可能不足以观察到视网膜病变的加重。如果患者在罗沙司他治疗后出现视力障碍,应尽早进行眼科评估。
5. 肿瘤:除了调节内源性EPO和铁代谢相关基因外,HIF还可能调控与新生血管化和肿瘤生长相关的基因转录。但目前的临床前研究表明,罗沙司他治疗不会增加肿瘤发生和肿瘤进展风险[53]。同时,汇总了全球6项罗沙司他Ⅲ期临床研究数据表明,与对照组(安慰剂和ESA)相比,罗沙司他组肿瘤相关的不良事件差异无统计学意义[54]。我们建议在使用罗沙司他治疗之前,需要对潜在肿瘤进行筛查,并进行长期监测。
6. 血栓相关事件:CKD贫血纠正的过程中,若Hb纠正过快或者过高,有可能导致血栓栓塞事件的增加[55]。在罗沙司他全球关键性研究中,NDD和DD人群汇总分析结果显示,虽然接受罗沙司他组和对照组之间MACE(心肌梗死、卒中和全因死亡)发生率相当,但罗沙司他治疗的患者中血管通路血栓形成事件和深静脉血栓形成事件的发生率高于对照组(NDD人群中与安慰剂,DD人群中与ESA)[49]。因此,在罗沙司他纠正贫血过程中,需要监测Hb的水平,及时调整药物剂量。此外,最近的研究显示,罗沙司他应用不影响血小板生成和活化[56],尽管如此,其对血栓相关事件的影响仍值得临床关注。
7. 惊厥发作:惊厥发作是已知的ESA不良反应之一。在NDD和DD汇总研究中,罗沙司他组的惊厥发作发生率均高于对照药物组[49]。在使用罗沙司他治疗肾性贫血期间需增加对患者惊厥发作频率或先兆症状变化的监测。
8. 严重感染:在罗沙司他全球关键性研究中,NDD汇总分析显示罗沙司他组严重感染及致死性感染的发生率高于安慰剂组[49];而DD汇总分析显示,罗沙司他组严重感染及致死性感染的发生率与阿法依泊汀组相当。因此,对重度或严重感染的患者治疗应当谨慎,需充分评估患者的风险和获益。建议在使用罗沙司他治疗时密切监测感染的症状和体征。
9. 肾囊肿生长:HIF在囊肿中的病理生理作用已有探讨。Kraus等[57]对常染色体显性遗传多囊肾病(autosomal dominant polycystic kidney disease,ADPKD)小鼠模型联合遗传学和药理学干预结果表明,HIF-1活化能够促进囊肿的进展。尽管临床试验中未发现治疗剂量的罗沙司他能够促进肾囊肿的进展,但其长期服用对肾囊肿潜在的不良反应仍需密切关注。
与其他药物联合使用时,应考虑罗沙司他与其相互作用,必要时可间隔给药,避免同时服药(2,未分级)。
罗沙司他与他汀类药物联用时可导致他汀类药物曲线下面积和峰浓度增加,因此,与他汀类药物合并使用时应考虑减少他汀类药物剂量并监测他汀类药物的不良反应。此外,罗沙司他还会与其他药物相互作用,详见表5。因此,所有可导致罗沙司他药时曲线下面积(area under the curve,AUC)、峰浓度(peak concentration,Cmax)下降的药物,与罗沙司他服用间隔应至少1 h。
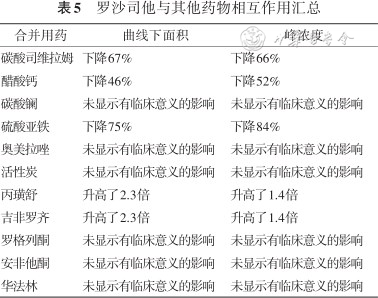
罗沙司他与其他药物相互作用汇总
罗沙司他与其他药物相互作用汇总
| 合并用药 | 曲线下面积 | 峰浓度 |
|---|---|---|
| 碳酸司维拉姆 | 下降67% | 下降66% |
| 醋酸钙 | 下降46% | 下降52% |
| 碳酸镧 | 未显示有临床意义的影响 | 未显示有临床意义的影响 |
| 硫酸亚铁 | 下降75% | 下降84% |
| 奥美拉唑 | 未显示有临床意义的影响 | 未显示有临床意义的影响 |
| 活性炭 | 未显示有临床意义的影响 | 未显示有临床意义的影响 |
| 丙璜舒 | 升高了2.3倍 | 升高了1.4倍 |
| 吉非罗齐 | 升高了2.3倍 | 升高了1.4倍 |
| 罗格列酮 | 未显示有临床意义的影响 | 未显示有临床意义的影响 |
| 安非他酮 | 未显示有临床意义的影响 | 未显示有临床意义的影响 |
| 华法林 | 未显示有临床意义的影响 | 未显示有临床意义的影响 |
中国CKD贫血发病率高,但知晓率、治疗率与达标率均较低。过去30年,ESA 和铁剂的应用极大地改善了CKD患者的预后,但仍有部分患者因各种原因出现ESA低反应,或多种不良反应,亟需新的治疗策略。罗沙司他作为新一代机制全新的口服肾性贫血治疗药物,通过激活HIF通路,促进内源性EPO生成,下调铁调素水平,改善铁的吸收、转运和利用,纠正贫血。罗沙司他在中国最早上市使用,我国是临床应用积累病例数最多的国家,取得了一定的临床经验。但目前临床研究随访时间总体还是偏短,长时间随访的样本量较小,因此对其疗效特点、剂量效应关系、长期应用潜在的不良反应等仍需继续观察和总结。今后,应继续加强上市后药物长期疗效和安全性评价,特别是开展前瞻性大队列研究,观察其对CKD进展和心血管安全性的影响[58]。此外还需要研究其对特殊人群及难治性肾性贫血人群的疗效。基于缺氧和氧感应机制在许多缺血缺氧性疾病中的作用,HIF-PHI对这些疾病的影响也值得在今后的研究中给予关注。
本共识制定专家组成员名单:
组长:刘章锁(郑州大学第一附属医院);刘必成(东南大学附属中大医院)
执笔人:刘必成(东南大学附属中大医院);王沛(郑州大学第一附属医院)
专家组成员(按姓氏拼音排序):陈丽萌(北京协和医院);陈钦开(南昌大学第一附属医院);陈崴(中山大学附属第一医院);陈晓农(上海交通大学医学院附属瑞金医院);程虹(首都医科大学附属北京安贞医院);程震(东部战区总医院);党宗辉(西藏自治区人民医院);甘华(重庆医科大学附属第一医院);韩飞(浙江大学医学院附属第一医院);郝传明(复旦大学附属华山医院);郝丽(安徽医科大学第二附属医院);胡文博(青海省人民医院);胡昭(山东大学齐鲁医院);贾强(首都医科大学宣武医院);蒋红利(西安交通大学第一附属医院);焦军东(哈尔滨医科大学附属第二医院);李贵森(四川省人民医院);梁馨苓(广东省人民医院);刘必成(东南大学附属中大医院);刘宏(东南大学附属中大医院);刘章锁(郑州大学第一附属医院);陆晨(新疆医科大学第一附属医院);孙林(中南大学湘雅二医院);万建新(福建医科大学附属第一医院);王沛(郑州大学第一附属医院);王保兴(河北医科大学第三医院);王彩丽(内蒙古科技大学包头医学院第一附属医院);王俭勤(兰州大学第二医院);王晋文(昆明医科大学附属延安医院);王莉(四川省人民医院);夏天(天津医科大学第二医院);肖湘成(中南大学湘雅医院);邢昌赢(江苏省人民医院);徐钢(华中科技大学同济医学院附属同济医院);许钟镐(吉林大学白求恩第一医院);闫铁昆(天津医科大学总医院);燕宇(北京大学人民医院);杨莉(北京大学第一医院);姚丽(中国医科大学附属第一医院);郁胜强(第二军医大学附属长征医院);袁静(浙江大学医学院附属第一医院);曾彩虹(东部战区总医院);查艳(贵州省人民医院);赵占正(郑州大学第一附属医院);郑智华(中山大学附属第七医院);周丽丽(南方医科大学南方医院);周晓玲(宁夏医科大学总医院);朱晗玉(解放军总医院第一医学中心);邹洪斌(吉林大学第二医院)
东南大学附属中大医院李作林博士在本共识撰写过程中的技术支持
所有作者均声明不存在利益冲突


























