
心力衰竭恶化(WHF)发生率高,患者预后差,社会负担重。近期,VICTORIA研究首次证实,在WHF患者中应用可溶性鸟苷酸环化酶(sGC)刺激剂维立西呱(vericiguat)可以显著改善患者预后。因此,本文将从WHF患者的特征和治疗需求、sGC刺激剂治疗心衰及维立西呱的临床有效性和安全性三个方面对维立西呱治疗WHF进行深入分析。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
心力衰竭(心衰)是一种由于心脏收缩和(或)舒张功能障碍导致射血功能受损和(或)充盈障碍的复杂的临床综合征[1, 2],分为射血分数降低的心力衰竭(heart failure with reduced ejection fraction,HFrEF)、射血分数保留的心力衰竭(heart failure with preserved ejection fraction,HFpEF)和射血分数轻度降低的心力衰竭(heart failure with mildly reduced ejecction fraction,HFmrEF)[3, 4]。慢性稳定心衰患者出现急性症状发作,需门诊、急诊或住院治疗,称为心衰恶化(worsening heart failure,WHF)[5]。据统计,17%初次诊断为心衰患者1.5年后经历WHF,其后2年死亡率为22.5%,预估生存期仅为(19.7±0.2)个月[6]。WHF升高全因住院率、门诊和急诊就诊次数,增加患者及社会经济负担[7]。
近年来越来越多的研究在WHF管理中尝试探索,如PIONEER-HF研究[8]、DAPA-HF研究[9]、VICTORIA研究[10]、LIFE研究[11]、GALACTIC-HF研究[12]。其中,可溶性鸟苷酸环化酶(soluble guanylyl cyclase,sGC)刺激剂维立西呱(vericiguat)是关注WHF治疗的首创新药(first in class),2021年1月在美国获批上市,适用于近期心衰急性失代偿经静脉治疗后病情稳定的射血分数(ejection fraction,EF)降低(<45%)的症状性慢性心衰成人患者,以降低发生心衰住院或需要急诊静脉利尿剂治疗的风险。本文针对维立西呱治疗慢性心衰的机制和疗效进行综述,并深入探讨其为WHF患者带来获益的潜力。
WHF的风险因素复杂多样。如高龄,年龄>65岁;基础心功能较差,纽约心脏协会(New York Heart Association,NYHA)心功能分级Ⅲ级或Ⅳ级[6];存在共病,包括急性冠状动脉综合征和心肌病变,及肥胖、高血压、高血脂、糖尿病、慢性肾脏病、贫血、慢性阻塞性肺疾病、外周动脉性疾病、血栓形成等非心脏疾病[6];未遵医嘱治疗,治疗药物种类不足或剂量不达标均增加WHF事件的发生风险。Mentz等[13]纳入VICTORIA试验中2 524例安慰剂组患者(发生WHF)分析显示,心衰持续时间较长、NYHA分级较差、既往心肌梗死和实验室指标异常,如高N末端B型利钠肽原(N terminal-pro B type natriuretic peptide,NT-proBNP)、胆红素、尿酸;低氯化物和白蛋白,为心血管死亡或首次心衰住院复合事件发生风险升高的独立预测因素。
2021年,美国心脏病学会(American College of Cardiology,ACC)更新发布的《优化心衰治疗决策临床路径专家共识》指出,临床中应识别心衰高危人群,尽早启动指南导向的药物治疗(guideline directed medical therapy,GDMT),并优化药物剂量,以延缓心衰进展、改善预后[14]。《中国心力衰竭诊断和治疗指南(2018版)》也明确了慢性HFrEF的治疗目标是改善临床症状和生活质量,预防或逆转心脏重构,减少再住院,降低死亡率[15]。因此,WHF管理不足,存在大量未满足临床需求,亟需新的治疗策略,降低疾病负担。
1.一氧化氮(nitric oxide,NO)-sGC-环鸟苷酸(cyclic guanosine monophosphate,cGMP)信号通路在心衰中的作用。心衰的发病机制复杂,多条途径可造成持续的心脏损害,其核心机制之一为内皮功能障碍[16, 17]。研究发现,NO-sGC-cGMP信号通路在维持心脏组织稳态和调控心血管系统功能中扮演重要角色。生理条件下,内皮细胞中内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)产生NO并扩散至附近血管平滑肌细胞或心肌细胞,与其受体胞质酶sGC结合,后者催化三磷酸鸟苷(guanosine triphosphate,GTP)转化为cGMP。作为第二信使,cGMP激活蛋白激酶G(protein kinase G,PKG)、磷酸二酯酶(phosphodiesterase,PDE)和环核苷酸门控的ATP敏感性钾离子通道及L型钙离子通道,致使细胞内游离钙离子含量减少,血管平滑肌舒张[16,18]。心衰患者体内的大量活性氧物质(reactive oxide species,ROS)通过升高精氨酸酶活性、下调或解耦联eNOS从而降低NO生物利用度,通过改变sGC氧化还原状态,降低其在胞内的活性水平,通过激活神经激素和炎症信号促使cGMP合成减少、PKG活性下调[19, 20]。低活性PKG磷酸化下游肌联蛋白能力下降,心肌细胞静息张力增大,导致心肌细胞损伤和肥厚;促炎因子的释放和血管细胞粘附分子、E-选择素的分泌还会诱导单核细胞向内皮迁移并释放转化生长因子β,后者刺激成纤维细胞转化为肌成纤维细胞,促进胶原沉积,最终导致冠状动脉微血管功能障碍和间质纤维化[19,21]。临床样本和动物实验也证实了eNOS解偶联与心肌亚硝酸盐/硝酸盐浓度、cGMP含量和PKG活性降低相关[22]。综上所述,NO-sGC-cGMP通路的活性下调为心衰中进行性心肌功能障碍的病理驱动因素(图1)。
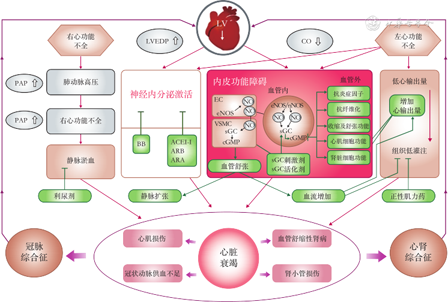

2. sGC刺激剂在修复NO-sGC-cGMP信号通路中的作用。sGC由α和β异二聚体蛋白和亚铁血红素辅基组成,血红素辅基具有不同的氧化还原状态,还能够调节细胞内氧化还原稳态[23]。在氧化应激中,NO-sGC-cGMP信号通路通过降低NO生物利用度或改变sGC自身的氧化还原状态,降低其对内源性和外源性NO的响应[24]。既往致力于NO-sGC-cGMP信号通路中的外源性NO供体与PDE5抑制剂,并未取得良好获益。研究者们逐渐开始关注以sGC为靶点的药物,包括sGC激活剂(activator)和sGC刺激剂(stimulator)。sGC激活剂不依赖于血红素辅基,但在心衰的临床研究中均已失败告终[25]。sGC刺激剂依赖于血红素辅基激活NO-sGC-cGMP信号通路,具有NO低浓度时直接激活以及与NO协同激活sGC的双重作用模式[18,26]。自先导化合物YC-1结构优化和效价改善得到BAY 41-2272和BAY 41-8543,进一步优化获得的第一个口服生物利用度较好的sGC刺激剂利奥西呱——Riociguat(BAY 63-2521),已于2013年经美国和欧盟批准上市用于治疗肺动脉高压[27, 28]。维立西呱——Vericiguat(BAY 1021189)是一种新型口服sGC刺激剂,不依赖于NO直接刺激sGC上调NO-sGC-cGMP信号通路,并通过稳定NO结合位点增加sGC对内源性NO的敏感性[10,26]。
3.维立西呱的药理学特征。体外研究显示,维立西呱(0.01μM到100μM)可浓度依赖地激活重组sGC至1.7-57.6倍;且100μM与NO供体(100 nm)协同激活至341.6倍。在过表达sGC的重组细胞系中亦观察到类似的浓度依赖性激活和协同作用[29]。动物研究发现,维立西呱可抑制去氧肾上腺素引起的离体兔隐静脉、兔主动脉和猪冠状动脉收缩,也能浓度依赖性降低大鼠冠状动脉灌注压[29]。在大鼠高血压合并心肾衰竭模型中,维立西呱剂量依赖性改善大鼠右心室和左心室肥大,降低血浆心房利钠肽水平;肾损伤分子和骨桥蛋白显著下调,蛋白尿亦剂量依赖性下降;还可缓解模型大鼠血压升高,改善生存[29]。因此,维立西呱通过激活NO-sGC-cGMP信号通路,不仅具有抗心肌肥大和心脏纤维化作用,也能发挥心脏、肾脏和血管等多靶器官保护作用。
1.临床疗效。最早的Ⅱ期临床试验SOCRATES-REDUCED研究[30]是一项多中心、双盲、剂量探索性随机临床试验,纳入了456位左心室射血分数(left ventricular ejection fraction,LVEF)<45%且近期恶化患者,口服维立西呱(1.25 mg、2.5 mg、5 mg、10 mg)持续12周。结果显示,从基线至治疗结束,总体而言,维立西呱组与安慰剂组间NT-proBNP对数变化水平无显著差异(P=0.15);但探索性次要终点的结果揭示了量效关系,即高剂量维立西呱可更大程度降低NT-proBNP水平(P<0.02),为后续研究奠定了基础。
针对慢性HFpEF恶化患者的Ⅱb期SOCRATES-PRESERVED研究[31]发现,治疗期间维立西呱高剂量组(10 mg)的NT-proBNP对数变化(双侧P=0.2017)和左心房容积(双侧P=0.3688)变化水平较安慰剂组差异无统计学意义;但达到预设的探索性终点,即改善患者的堪萨斯城心肌病问卷评分(Kansas City Cardiomyopathy Questionnaire,KCCQ)至19.3 分,提示维立西呱对HFpEF患者生活质量改善的潜在获益。在进一步的多中心、双盲Ⅱb期VITALITY-HFpEF研究[32]中,与安慰剂相比,15 mg或10 mg维立西呱治疗未改善慢性HFpEF恶化患者KCCQ评分,故未来还需为HFpEF患者探索更有效的治疗方案。
VICTORIA研究[10]是一项多国、随机、双盲Ⅲ期试验,纳入了5 050名LVEF<45%的慢性心衰患者(NYHA心功能Ⅱ~Ⅳ级)且近期恶化入院或接受利尿剂治疗,随机分为维立西呱组(10 mg)和安慰剂组,均接受指南推荐的联合疗法,主要终点为心血管死亡或首次心衰住院的复合事件,次要终点为全因死亡或心衰住院的复合事件。结果显示,维立西呱较安慰剂显著降低主要终点[分别为35.5%和38.5%,风险比(hazard ratio,HR)0.90,95%可信区间(confidence interval,CI)0.82~0.98,P=0.02]和次要终点(分别为37.9%和40.9%,HR 0.90,95%CI 0.83~0.98,P=0.02)的发生率。研究纳入的患者平均年龄为67岁,心衰加重风险较高,60%接受三联疗法(β-受体阻滞剂、醛固酮拮抗剂和血管紧张素转换酶抑制剂、血管紧张素受体阻滞剂或血管紧张素受体脑啡肽酶抑制剂),维立西呱联用均能改善结局,且仅10.8个月就出现绝对风险降低(absolute risk reduction,ARR)4.2%/年的获益。此外,研究显示,90天再住院失代偿心衰患者在全因死亡和心血管死亡方面的预后比无90天再次住院患者差[33],而维立西呱显著降低心衰再住院率(27.4%比29.6%),能够提高患者获益。
2.获益人群。根据心衰住院风险将VICTORIA研究人群分为三个亚组,结果显示,心衰住院3个月以内主要复合终点的风险最高(40.9个事件/100人/年),其次是心衰住院3到6个月(29.6个事件/100人/年),门诊恶化亚组风险最低(23.4个事件/100人/年);各亚组间 维立西呱对主要或次要结局的影响无统计学差异[34],提示不同时间点使用维立西呱均可实现一致的获益。在肾功能方面,研究显示,维立西呱对主要终点的有益影响在全范围的估算肾小球滤过率(estimated glomerular filtration rate,eGFR)中保持一致,治疗可不考虑肾功能恶化[35]。
另有亚组分析发现,NT-proBNP≤8000 pg/mL的患者接受维立西呱治疗具有显著的主要终点(HR 0.85,95%CI 0.76~0.95)、心衰再住院(HR 0.84,95%CI 0.75~0.95)及心血管死亡(HR 0.84,95%CI 0.71~0.99)获益;而NT-proBNP>8000 pg/mL的患者无获益(主要终点HR 1.16,95%CI 0.94~1.41),这部分患者在研究中占约14%,NYHA心功能Ⅳ级和eGFR<30 mL·min-1·1.73 m-2比例更高,年龄更大[36]。既往研究也证实,慢性心衰患者NT-proBNP越高,预后越差[37];而已进行标准治疗后仍保持高NT-proBNP的患者,推测已进展至终末期,对cGMP反应减弱[38]。心衰加重患者建议在发生恶化的早期阶段积极干预,可更好的改善患者临床结局和远期预后。
2021年欧洲心脏病学会-心力衰竭协会(European Society of Cardiology-Heart Failure Association,ESC-HFA)会议上,Ezekowitz报告了VICTORIA研究中NT-proBNP的变化水平和结局相关性。研究筛选出NT-proBNP≥1000 pg/mL(窦性心律)或≥1600 pg/mL(房颤)的4805例患者,结果显示,接受维立西呱治疗16周的患者NT-proBNP相对基线降低14%,降幅显著大于安慰剂[风险比(odds ratio,OR)1.45,95%CI 1.28~1.65,P<0.001];同时发现,NT-proBNP降幅与主要终点发生率呈负相关;随着时间推移,维立西呱治疗对主要终点改善越佳(HR:4个月后0.96,12个月后0.90)。因此,维立西呱可早期、持续性地降低HFrEF恶化患者NT-proBNP,改善患者心血管死亡或首次心衰住院的结局,且长期获益明显。
3.药物代谢动力学和安全性。Ⅰ期药物代谢动力学结果显示,维立西呱(≤10.0 mg立即释放片)吸收迅速,中位达峰时间≤2.5 h,平均半衰期约为22.0 h,未观察到偏离剂量或药物累积,证实了维立西呱的良好耐受性[39]。进食同时服用维立西呱(5.0 mg立即释放片)可提高19%生物利用度(优势比119%),降低变异系数,延长吸收。在沙库比曲缬沙坦、阿司匹林、华法林基础上联合使用维立西呱无明显药物间相互作用,不改变药物代谢动力学参数以及出血时间、血小板聚集、凝血抑制功能[40]。Ⅰ/Ⅱ期试验均显示维立西呱治疗中最常见不良反应为头痛和直立型眩晕[30, 31,39],但总体鲜有发生[10];且在标准治疗的基础上加用维立西呱,血压降幅增加在1~1.5 mmHg(1 mmHg=0.133 kPa)之间,同时,对电解质和肾功能也无明显影响。
心衰作为全球公共卫生难题,疾病负担持续加重。慢性心衰加重患者再入院率较高,预后较差,患者需求未满足。新型sGC刺激剂维立西呱具有心脏、肾脏、血管三大靶组织获益,在改善血流动力学时,对全身血压和心率影响轻微,弥补了现有心衰治疗干预机制的不足。随着VICTORIA研究结果的公布,维立西呱在标准治疗基础上继续降低心血管死亡和心衰住院的风险,并且住院期间任何时间启动治疗均可获益,且治疗时间越长获益越好。维立西呱的上市为治疗慢性心衰和预防心衰加重提供了新的治疗方法和优化方案的新选择,为人类战胜心衰疾病威胁提供了新的可能性。
所有作者均声明不存在利益冲突



























