
探讨自然杀伤(NK)p44+NK细胞在类风湿关节炎(RA)滑膜增生及炎症中的作用及机制。
采用流式细胞术检测50例RA患者及50名健康对照者外周血、30例RA患者滑液中NKp44+NK细胞比例。流式细胞术分选5例RA患者滑液NKp44+NK细胞(108/L), ELISA检测NKp44+NK细胞培养上清白细胞介素(IL)-22浓度。NKp44+NK细胞培养上清作用于RA成纤维样滑膜细胞(FLS)24、48及72 h,MTT法检测FLS增殖。rhIL-22作用RA FLS 72 h后检测单核细胞趋化蛋白(MCP)-1分泌。
(1)RA患者外周血NKp44+NK细胞比例为1.270%,高于健康对照外周血NKp44+NK细胞比例0(P<0.01);RA患者滑液NKp44+NK细胞比例为15.190%,高于自身外周血NKp44+NK细胞比例2.425%(P<0.01)。(2)RA滑液NKp44+NK细胞体外培养2周,其上清IL-22浓度(1 603±332) ng/L。(3)NKp44+NK细胞上清作用于RA FLS 24、48、72 h均能刺激RA FLS增殖(P<0.01)。IL-22抗体能明显抑制NKp44+NK细胞上清诱导的RA FLS增殖(P<0.01)。(4)1及10 μg/L rhIL-22作用于RA FLS 72 h可促进FLS MCP-1分泌(P<0.01)。
NKp44+NK细胞能分泌IL-22促进RA FLS增殖及MCP-1分泌,可能在RA滑膜增生及炎症中具有重要作用。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
自然杀伤 (NK)细胞在类风湿关节炎(RA)发病中有重要作用[1,2,3]。RA时存在NK细胞的激活,出现多种不同表型的NK细胞,如NKp44+NK细胞等[2,3,4],其功能特征发生改变,可能参与了RA的发生发展。NKp44+NK细胞可能与疾病活动度和病情严重程度相关[5]。本研究目的是了解此类NK细胞亚群的水平及其在RA病理过程作用及机制。
选取2011年9月至2013年3月在暨南大学附属第一医院风湿科门诊及住院的RA患者50例,男10例,女40例,平均年龄47岁。所有RA病例均符合1987年美国风湿病学会(ACR)修订的RA分类标准,并除外其他自身免疫性疾病、感染、肿瘤等关节相关疾病。健康对照组为健康体检者,共50名,其中男8名,女42名,平均年龄46.8岁。所有受试者均签署知情同意书。两组对象年龄、性别差异无统计学意义。
流式细胞仪(BD FACSAria™1),低温高速离心机,水浴锅,WH2861涡旋混合器(麒麟医仪),恒温细胞培养箱,抗CD56-FITC抗体、抗CD3-PE CY5抗体、抗NKp44-APC抗体、鼠IgG1-FITC抗体、鼠IgG1- PE CY5抗体、鼠IgG1-APC抗体(美国BD公司),PMA、ionomycin、MTT溶液、DMSO溶液(美国Sigma公司),IL-22 ELISA试剂盒(Excell Biology),酶标仪(美国BioTck公司),免疫组化试剂盒(博士德)。
采用流式细胞仪,将RA患者及健康对照外周血90 μl与3种荧光抗体——抗CD56-FITC抗体、抗CD3-PE Cy5抗体、抗NKp44-APC抗体各10 μl避光孵育30 min。加入2 ml溶血液,避光孵育10 min,1100 r/min离心5 min,弃上清。PBS清洗细胞,加入300 μl PBS上机检测。关节滑液操作步骤基本同上,只是不需要溶血。每管同时做同型对照。
采用流式细胞术。将RA患者滑液4 ml, 1100 r/min离心5 min,弃上清。PBS清洗细胞后,加入3种荧光抗体——抗CD56-FITC抗体、抗CD3-PE Cy5抗体、抗NKp44-APC抗体各150 μl,避光孵育30 min。PBS清洗细胞后,加入300 μl PBS上机分选,共分选105/ml细胞。10%胎牛血清(FBS)的RPMI 1640培养液悬浮培养细胞,每2~3天换液1次,培养2周后进行实验,流式检测细胞纯度>90%。
采用组织块原代培养方法进行RA FLS培养,采用生长状态良好的第3~5代细胞进行实验。用免疫组化法对RA FLS波形蛋白(vimentin)进行鉴定,按照试剂盒说明书进行SABC-DAB法染色。
NKp44+NK细胞加入终浓度为20 μg/L的佛波酯溶液和0.5 μmol/L的离子霉素(ionomycin)溶液刺激4 h后进行实验。
采用MTT法。将1×105/ml FLS悬液100 μl接种于96孔培养板中。空白对照组加入10%FBS的RPMI 1640培养液100 μl,实验组加入NKp44+NK细胞培养上清液100 μl,3块培养板培养24、48、72 h后,MTT法检测RA FLS增殖。
RA FLS(105/ml)接种于96孔培养板中,空白对照组加入10%FBS的RPMI 1640培养液100 μl,实验组加入:(1) NKp44+NK细胞培养上清液100 μl;(2)含50 mg/L IL-22抗体的NKp44+NK细胞培养上清液100 μl。培养24 h后MTT法检测RA FLS增殖。
将RA FLS接种于6孔培养板中(105/ml),空白对照组加入10%FBS的RPMI 1640培养液500 μl,实验组加入:(1)含1 μg/L rhIL-22的10%FBS的RPMI 1640培养液500 μl;(2)含10 μg/L rhIL-22的10%FBS的RPMI 1640培养液500 μl。培养72 h后ELISA检测MCP-1分泌。
采用SPSS 15.0统计软件,计量资料用 ±s或M±INQ表示,正态分布计量资料总体比较采用两独立样本t检验或单因素方差分析,两两比较采用Bonfferroni检验。非正态分布计量资料采用多重非参数检验,以P<0.05为差异有统计学意义。
±s或M±INQ表示,正态分布计量资料总体比较采用两独立样本t检验或单因素方差分析,两两比较采用Bonfferroni检验。非正态分布计量资料采用多重非参数检验,以P<0.05为差异有统计学意义。
RA患者外周血NKp44+NK细胞比例为1.27%,健康对照组外周血NKp44+NK细胞比例为0,两者比较P<0.01;RA患者滑液NKp44+NK细胞比例为15.190%,自身外周血NKp44+NK细胞比例为2.425%,两者比较P<0.01。
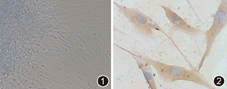
原代培养第7天即可见到组织块周围有细胞游出。滑膜细胞在体外培养条件下通过3次传代后主要以梭形的FLS为主。光镜下FLS呈长梭形,细胞核呈卵圆形位于细胞中央,胞质透亮,排列有局部方向性(图1)。采用中胚层组织细胞特征性蛋白Vimentin单克隆抗体进行免疫组化标记,FLS胞质出现棕黄色颗粒(图2)。

流式分选5例RA患者滑液108/L NKp44+NK细胞体外培养2周,细胞纯度>90%。20 μg/L的佛波酯溶液和0.5 μmol/L的离子霉素溶液刺激后NKp44+NK细胞培养上清IL-22浓度为(1 603±332) ng/L。
NKp44+NK细胞上清(IL-22浓度为1 460 ng/L)作用RA FLS 24、48、72 h后RA FLS增殖明显,与空白组比较差异有统计学意义(P<0.05),表1。
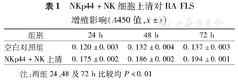
NKp44+NK细胞上清对RA FLS增殖影响(A450值, ±s)
±s)
NKp44+NK细胞上清对RA FLS增殖影响(A450值, ±s)
±s)
| 组别 | 24 h | 48 h | 72 h |
|---|---|---|---|
| 空白对照组 | 0.120±0.003 | 0.132±0.004 | 0.137±0.003 |
| NKp44+NK上清 | 0.175±0.002 | 0.186±0.002 | 0.194±0.001 |
注:两组24、48及72 h比较均 P<0.01
空白对照组、NKp44+NK细胞上清组、IL-22抗体组A值分别为0.120±0.003、0.175±0.002及0.151±0.001,3组间总差异有统计学意义,P<0.01,IL-22抗体组FLS增殖较NKp44+NK细胞上清组下降P<0.01。
rhIL-22组1及10 μg/L的MCP-1 A值分别为0.478±0.001、0.653±0.001,与空白对照组(0.350±0.002)比较差异有统计学意义(P<0.01);rhIL-22组1 μg/L与10 μg/L比较P<0.01。
NK细胞具有强大的细胞因子分泌功能,其活化后能分泌多种细胞因子,引起自身和T、B淋巴细胞的增殖活化和细胞因子产生,从而激发更有效的适应性免疫应答[1,6]。NK细胞在RA发病过程中起着重要作用。NK细胞也可通过和其他细胞间的直接接触来参与RA发病。从RA患者关节滑液中分离的NK细胞能够诱导CD14+的单核细胞分化为破骨细胞[7]。NK细胞功能与其表面受体的表达密切相关。在NK细胞多种受体中,NKp44受体属于自然细胞毒性受体,只表达于活化NK细胞表面,是NK细胞活化的主要标志受体。Pridgeon等[2]和de Matos等[3]都发现,RA患者滑液中NKp44+NK细胞明显升高。Cella等[4]发现,NKp44+NK细胞能分泌包括IL-22在内的多种细胞因子,促进自身及其他免疫细胞聚集,在炎症过程中发挥重要作用。
本研究发现,RA患者滑液NKp44+NK细胞比例明显高于患者外周血,说明NKp44+NK细胞在关节炎症部位聚集。NKp44+NK细胞培养上清可明显促进RA FLS增殖。RA FLS增殖与局部关节炎症和血管翳形成、骨破坏密切相关[8],这提示,滑液NKp44+NK细胞是参与RA发生发展的。进一步对NKp44+NK细胞功能研究发现,NKp44+NK细胞体外能分泌高浓度的IL-22。IL-22可诱导RA FLS增殖和炎性细胞因子分泌,IL-22可以促进破骨细胞生成。阻断NKp44+NK细胞上清中IL-22作用后,发现NKp44+NK细胞促RA FLS增殖的作用明显减弱,提示IL-22是NKp44+NK细胞分泌的促RA FLS增殖的一种重要细胞因子。本研究还发现,1 μg/L的rhIL-22能促进RA FLS分泌MCP-1。MCP-1为RA FLS分泌的一种炎症性趋化因子,其受体CCR2是一类表达于不同类型细胞上的含有7个跨膜区的G蛋白偶联受体。MCP-1与CCR2结合后使各种炎性细胞尤其是单核细胞向病变部位聚集,促进局部炎症反应。说明RA患者NKp44+NK细胞通过分泌IL-22促进RA FLS增殖及MCP-1分泌,在RA滑膜增生及炎症中具有重要作用。



























