
系统性评价全程新辅助治疗(TNT)在局部晚期直肠癌中的疗效和安全性。
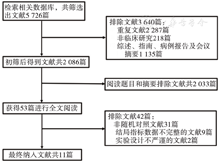
计算机检索PubMed、Embase、Web of Science、Cochrane Library、中国生物医学文献数据库、万方数据库、维普数据库和中国知网等数据库,查阅自建库至2021年5月公开发表的TNT联合全直肠系膜切除术(TME)对比标准治疗方案即新辅助放化疗(nCRT)联合TME治疗局部晚期直肠癌的临床随机对照研究文献,对两组总生存期、无病生存期、R0根治性切除率、病理完全缓解率、T分期降期率、≥3级不良反应(包括中性粒细胞下降、恶心呕吐、腹泻、放射性皮炎和神经系统不良反应等)发生率和术后30 d内并发症发生率等数据,应用Review Manager 5.3软件进行统计分析。
最终纳入9项研究,共计2 430例患者。Meta分析结果显示,TNT组的总生存期(HR=0.80,95%CI:0.65~0.97,P=0.03)和病理完全缓解率(RR=1.73,95%CI:1.44~2.08,P<0.01)均优于nCRT组,差异有统计学意义(均P<0.05);两组无病生存期(HR=0.86,95%CI:0.71~1.05,P=0.14)、R0根治性切除率(RR=1.02,95%CI:0.99~1.06,P=0.17)和T分期降期率(RR=1.04,95%CI:0.89~1.22,P=0.58)差异无统计学意义(均P>0.05)。在治疗安全性方面,两组间≥3级不良反应发生率(RR=1.09,95%CI:0.70~1.70,P=0.70)和术后30 d内并发症发生率(RR=1.07,95%CI:0.97~1.18,P=0.19)差异无统计学意义(均P>0.05)。
在局部晚期直肠癌的治疗中,TNT相比于nCRT可以带来更多的生存获益,且未明显增加不良反应发生。TNT可能是局部晚期直肠癌患者的一种推荐治疗方案。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
我国直肠癌发病率和死亡率均较高,2/3的直肠癌患者为局部晚期,目前临床上针对局部晚期直肠癌的标准治疗方案是新辅助放化疗(neoadjuvant chemoradiotherapy,nCRT)、全直肠系膜切除术(total mesorectal excision,TME)和术后辅助化疗[1,2,3]。相比于术后同步放化疗,标准治疗方案明显降低了局部晚期直肠癌患者的肿瘤局部复发率,但未能显著提高10年总生存率(overall survival,OS)[4]。为了进一步提高局部晚期直肠癌患者的疗效,多项临床研究将术后辅助化疗提至手术前进行,即全程新辅助治疗(total neoadjuvant therapy,TNT)[5]。但目前TNT相关研究结论不一[6,7,8,9]。因此,本研究通过Meta分析对TNT与nCRT治疗局部晚期直肠癌的临床随机对照试验(randomized controlled trial,RCT)相关文献进行综合评价,分析TNT的疗效及安全性,为其临床应用提供一定参考。
检索PubMed、Embase、Web of Science、Cochrane Library、中国生物医学文献数据库、万方数据库、维普数据库和中国知网等数据库。采用关键词检索,英文检索词包括"rectal neoplasms"、"rectal carcinoma"、"rectal cancer"、"total neoadjuvant therapy"、"neoadjuvant chemoradiotherapy",中文检索词包括"直肠癌"、"直肠恶性肿瘤"、"全程新辅助治疗"、"新辅助放化疗"。检索时间为对应数据库建库至2021年5月。
纳入标准:(1)已公开发表的研究;(2)研究对象:局部晚期直肠癌患者;(3)研究类型:TNT联合TME手术(试验组)对比nCRT联合TME手术(对照组)的RCT研究;(4)结局指标:研究文献报告了TNT具体治疗方案、近期疗效、生存资料和不良反应等数据。排除标准:(1)对于同一研究人群样本的重复报道;(2)综述、会议摘要、个案报道、单臂研究及回顾性分析;(3)结局指标数据不完整的文献。
由两位评价者根据文献纳入与排除标准独立完成文献筛选,出现争议时则由第3位评价者进行评定。最终提取纳入文献的基本资料包括作者、发表时间、分组、样本数及治疗策略等。本研究提取的结局指标包括OS、无病生存期(disease-free survival,DFS)、R0根治性切除率、病理完全缓解(pathological complete response,pCR)率、T分期降期率、3级以上不良反应发生率和术后30 d内并发症发生率等数据。
采用Cochrane偏倚风险评价工具对纳入的RCT进行质量评价[10]。评价项目包括选择偏倚(随机方法和分配隐藏)、实施偏倚(研究者和受试者的盲法)、测量偏倚(研究结局的盲法评价)、随访偏倚(结局数据完整性)、报告偏倚(选择性报告研究结果)和其他偏倚。根据风险评估准则,每个项目可以判定为"低风险"、"高风险"和"风险不清楚"。由2位评价者按照以上标准独立进行,若存在分歧则由第3位评价者进行评定。
使用Review Manager 5.3统计软件进行数据处理。OS与DFS的生存资料统计分析方法为倒方差法,使用风险比(hazard ratio,HR)作为效应指标。R0根治性切除率、pCR率、T分期降期率、3级以上不良反应发生率和术后30 d内并发症发生率等数据类型皆为二分类变量,使用危险比(risk ratio,RR)作为效应指标。对于各效应指标的可信区间(confidence interval,CI)范围,本研究均采用以95%CI表示,P<0.05为差异有统计学意义。采用Q检验和I2检验作为本研究异质性检验方法,若P>0.1且I2≤50%,认为各研究间统计学异质性较小,采用固定效应模型进行分析;若P<0.1且I2>50%,则认为各研究间统计学异质性较大,采用随机效应模型合并效应量进行分析。采用漏斗图分析文献的发表偏倚。
最终纳入9项研究,10篇文献(其中一项研究发表了2篇文献)[9,11,12,13,14,15,16,17,18,19]。具体文献筛选流程见图1。9项研究合计2 430例患者,其中TNT组患者1 225例,nCRT组患者1 205例。纳入分析的文献基本特征及治疗策略见表1。TNT组化疗方案包括CAPEOX(卡培他滨+奥沙利铂)、FOLFOX(亚叶酸钙+氟尿嘧啶+奥沙利铂)、mFOLFOX[亚叶酸钙+氟尿嘧啶+奥沙利铂(改良版)]、FOLFIRINOX(亚叶酸钙+氟尿嘧啶+伊立替康+奥沙利铂)、氟尿嘧啶单药和卡培他滨单药等方案,具体药物治疗剂量和治疗方式的采用均遵循药物说明书。

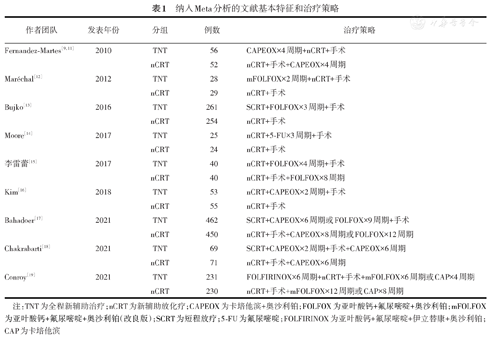
纳入Meta分析的文献基本特征和治疗策略
纳入Meta分析的文献基本特征和治疗策略
| 作者团队 | 发表年份 | 分组 | 例数 | 治疗策略 |
|---|---|---|---|---|
| Fernandez-Martes[9,11] | 2010 | TNT | 56 | CAPEOX×4周期+nCRT+手术 |
| nCRT | 52 | nCRT+手术+CAPEOX×4周期 | ||
| Maréchal[12] | 2012 | TNT | 28 | mFOLFOX×2周期+nCRT+手术 |
| nCRT | 29 | nCRT+手术 | ||
| Bujko[13] | 2016 | TNT | 261 | SCRT+FOLFOX×3周期+手术 |
| nCRT | 254 | nCRT+手术 | ||
| Moore[14] | 2017 | TNT | 25 | nCRT+5-FU×3周期+手术 |
| nCRT | 24 | nCRT+手术 | ||
| 李雷蕾[15] | 2017 | TNT | 40 | nCRT+FOLFOX×4周期+手术 |
| nCRT | 40 | nCRT+手术+FOLFOX×8周期 | ||
| Kim[16] | 2018 | TNT | 53 | nCRT+CAPEOX×2周期+手术 |
| nCRT | 55 | nCRT+手术 | ||
| Bahadoer[17] | 2021 | TNT | 462 | SCRT+CAPEOX×6周期或FOLFOX×9周期+手术 |
| nCRT | 450 | nCRT+手术+CAPEOX×8周期或FOLFOX×12周期 | ||
| Chakrabarti[18] | 2021 | TNT | 69 | SCRT+CAPEOX×2周期+手术+CAPEOX×6周期 |
| nCRT | 71 | nCRT+手术+CAPEOX×6周期 | ||
| Conroy[19] | 2021 | TNT | 231 | FOLFIRINOX×6周期+nCRT+手术+mFOLFOX×6周期或CAP×4周期 |
| nCRT | 230 | nCRT+手术+mFOLFOX×12周期或CAP×8周期 |
注:TNT为全程新辅助治疗;nCRT为新辅助放化疗;CAPEOX为卡培他滨+奥沙利铂;FOLFOX为亚叶酸钙+氟尿嘧啶+奥沙利铂;mFOLFOX为亚叶酸钙+氟尿嘧啶+奥沙利铂(改良版);SCRT为短程放疗;5-FU为氟尿嘧啶;FOLFIRINOX为亚叶酸钙+氟尿嘧啶+伊立替康+奥沙利铂;CAP为卡培他滨
采用偏倚风险评估对纳入文献进行质量评价,结果显示,7项研究描述了随机序列的产生方法[11,12,13,14,15,17,19];5项研究进行了充分的分配隐藏[11,12,13,17,19]。由于该临床试验的特殊性,9项研究中研究者和受试者双盲均无法实现[11,12,13,14,15,16,17,18,19],8项研究中报道了系统评估者对研究结果盲法评价[11,12,13,14,16,17,18,19]。9项研究中结局数据均完整,6项研究中报道偏倚属于低风险[11,13,15,16,17,19]。
有5篇文献报道了OS[9,13,15,17,19];其异质性检验提示各研究间异质性较小(P=0.74,I2=0),因此采用固定效应模型进行分析,结果显示,TNT组较nCRT组的OS更高(HR=0.80,95%CI:0.65~0.97,P=0.03),见图2A。
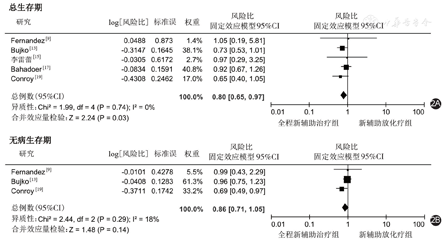

有3篇文献报道了DFS[9,13,19];其异质性检验提示各研究间异质性较小(P=0.29,I2=18%),因此采用固定效应模型进行分析,结果显示,TNT组与nCRT组的DFS相近(HR=0.86,95%CI:0.71~1.05,P=0.14),见图2B。
9篇文献均报道了R0根治性切除率[11,12,13,14,15,16,17,18,19];其异质性检验提示各研究间异质性较小(P=0.12,I2=38%),因此采用固定效应模型进行分析,结果显示,TNT组与nCRT组的R0根治性切除率相近(RR=1.02,95%CI:0.99~1.06,P=0.17),见图3A。
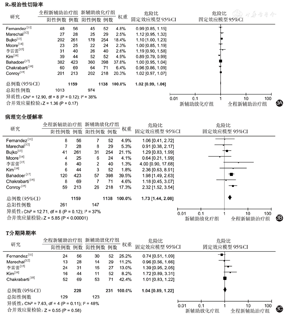

9篇文献均报道了pCR率[11,12,13,14,15,16,17,18,19];其异质性检验提示各研究间异质性较小(P=0.12,I2=37%),因此采用固定效应模型进行分析,结果显示,TNT组较nCRT组的pCR率更高(RR=1.73,95%CI:1.44~2.08,P<0.01),见图3B。
有5篇文献报道了T分期降期率[11,12,15,16,18];其异质性检验提示各研究间异质性较小(P=0.11,I2=48%),因此采用固定效应模型进行分析,结果显示,TNT组与nCRT组的T分期降期率相近(RR=1.04,95%CI:0.89~1.22,P=0.58),见图3C。
有8篇文献报道了治疗相关过程中3级以上不良反应发生率(包括中性粒细胞减少、恶心呕吐、腹泻、放射性皮炎和神经系统不良反应等)[11,12,13,15,16,17,18,19];其异质性检验提示,各研究间存在统计学异质性(P<0.01,I2=94%),因此采用随机效应模型进行分析,结果显示,TNT组与nCRT组的≥3级不良反应发生率相近(RR=1.09,95%CI:0.70~1.70,P=0.70),见图4A。
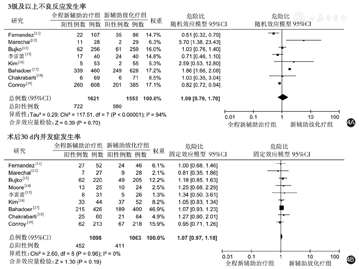

9篇文献均报道了术后30 d内并发症发生率(包括术后30 d内病死率、吻合口漏和伤口延期愈合等)[11,12,13,14,15,16,17,18,19];其异质性检验提示各研究间异质性较小(P=0.96,I2=0),因此采用固定效应模型进行分析,结果显示,TNT组与nCRT组的术后30 d内并发症发生率相近(RR=1.07,95%CI:0.97~1.18,P=0.19),见图4B。
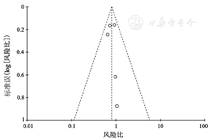
以OS为指标进行了漏斗图绘制,散点大致分布在倒置的漏斗内,可以认为潜在发表偏倚风险较小,见图5。

直肠癌早期病变症状隐匿,确诊时多为局部晚期,肿瘤体积较大,并且由于盆腔结构较为复杂,根治性手术难度较大[20]。作为局部晚期直肠癌新型治疗策略之一的的TNT方案受到了广泛关注。新近发表的RAPIDO研究将912例局部晚期直肠癌患者随机分为TNT组和nCRT组,结果显示,两组间OS无明显差别(HR=0.92,95%CI:0.67~1.25,P=0.59),但研究人员认为,OS可能会随着随访时间的延长表现出在统计学上的改善;同时,TNT组患者具有较好的pCR率(28%比14%,P<0.01)[17]。Bujko等[13]将515例局部晚期直肠癌患者随机分为TNT组和nCRT组,结果提示,TNT组具有更高的3年OS率(73%比65%,P=0.046),但两组患者3年DFS率和pCR率差异无统计学意义(53%比52%,P=0.85;16%比12%,P=0.17)。而GCR-3研究随机纳入了56例接受TNT和52例接受nCRT的中低位局部晚期直肠癌患者,结果提示,两组不仅具有相似的5年OS率和DFS率(75%比78%,P=0.64;62%比64%,P=0.85),pCR率也相似(14%比13%,P=0.94)[9,11]。上述临床研究结果并不一致,TNT对局部晚期直肠癌患者的疗效尚存争议。为此,有必要针对相关RCT研究进行Meta分析,进一步探讨TNT治疗局部晚期直肠癌的有效性及安全性。
本研究结果提示,TNT相比于nCRT提高了局部晚期直肠癌患者OS和pCR率,组间DFS、R0根治性切除率和T分期降期率相近。2021年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)大会报道的STELLAR研究,随机纳入了298例接受TNT和293例接受nCRT的来自中国的局部晚期直肠癌患者,结果表明,TNT组3年OS率明显高于nCRT组(86.5%比75.1%,P=0.036),并达到了非劣效DFS终点(P<0.01);虽然两组患者pCR率相似(16.6%比11.8%,P=0.134),但TNT组获得pCR和临床完全缓解的患者明显多于nCRT组(22.5%比12.6%,P<0.01)[21]。Conroy等[19]开展的RCT研究也表明,TNT可以改善局部晚期直肠癌患者的DFS和pCR率(HR=0.69,95%CI:0.49~0.97,P=0.034;28%比12%,P<0.01)。此外,RAPIDO研究终点还表明,TNT组相比于nCRT组,具有较低的疾病相关治疗失败率(23.7%比30.4%,P=0.019)和远处转移率(20.0%比26.8%,P=0.005)[17]。基于上述研究结果,表明TNT可以通过加强局部晚期直肠癌患者术前治疗强度,从而提高手术疗效,降低肿瘤负荷,带来更多生存获益,但仍需更多高质量的RCT进一步验证。
在TNT治疗的安全性方面,本研究结果表明,局部晚期直肠癌患者两组间3级以上不良反应发生率和术后30 d内并发症发生率均无明显差别,其中较为常见的不良反应是中性粒细胞计数下降、腹泻和吻合口漏。一项前瞻性非随机对照研究纳入了259例局部晚期直肠癌患者,结果表明,相比于术前同步放化疗模式,TNT组3级以上不良反应发生率和围手术期并发症发生率并未增加(P>0.05)[22]。翟志伟等[23]开展的回顾性临床研究结果也显示,两组术后并发症发生率差异无统计学意义,包括切口感染、吻合口漏和吻合口出血等方面。基于上述研究结果,加入术前全身化疗的TNT治疗模式和术前同步放化疗治疗模式安全性相当。
本研究也存在一定局限性,目前纳入的部分研究未进行长期随访,关于远期生存结果的报道较少;并且各项研究中实施手术医师的水平、放化疗方案以及给药剂量等差异可能导致一定程度的临床异质性,从而影响分析结果。当前,国际上有关TNT的具体治疗策略尚无明确的规范,化疗药物的种类、剂量及疗程也没有较为统一的标准。本文纳入文献中TNT组采用了CAPEOX、FOLFOX、mFOLFOX、FOLFIRINOX、氟尿嘧啶单药和卡培他滨单药等方案,可提供一定临床参考。如何寻找全身化疗与术前同步放化疗或放疗的最合理顺序、术前同步放化疗和根治性手术的最佳间隔时间等、以及进一步局限TNT潜在获益人群,仍是值得关注的关键问题。目前,正在中国开展的三期临床试验TNTCRT研究和NCT02031939研究,分别拟入组458例和194例局部晚期直肠癌患者,比较TNT与nCRT之间的差异,主要研究终点分别为DFS和OS,期待其最终结果的报道[24]。
综上所述,本研究表明,对于局部晚期直肠癌患者,TNT相比于nCRT提高了OS和pCR率,两组患者DFS、R0根治性切除率和T分期降期率相近,且治疗安全性相似。TNT是针对局部晚期直肠癌患者的一种安全有效的治疗方案,但仍有待更多三期临床研究结果验证。
所有作者均声明不存在利益冲突



























