
探索珠海市新型冠状病毒(2019-nCoV)奥密克戎(Omicron)变异株BA.1和BA.2亚型感染者的临床特征。
纳入2022年1月13日至3月8日中山大学附属第五医院收治的122例2019-nCoV Omicron变异株感染者,其中成人病例79例(BA.1亚型23例,BA.2亚型56例),儿童病例43例(BA.1亚型19例,BA.2亚型24例)。比较BA.1亚型和BA.2亚型病例不同年龄组的临床表现、实验室检查指标、病毒载量、疫苗接种和感染类型的差异。计量资料采用Mann-Whitney U检验或Kruskal-Wallis H检验,计数资料采用χ2检验或Fisher确切概率法。
在成人Omicron变异株感染者中,BA.2亚型感染者基线病毒载量比BA.1亚型高[7.64(6.92,8.55) lg拷贝/mL比6.64(6.04,7.34) lg拷贝/mL,Z=-3.022,P=0.003],且无症状感染者和轻型患者比例更高,普通型患者比例更低(χ2=8.052,P=0.012),BA.1亚型感染者肺部出现炎症比例(6/23,26.1%)高于BA.2亚型感染者(2/56,3.6%)(χ2=6.776,P=0.009)。在儿童病例中,BA.2亚型感染者发热比例(16/24,66.7%)高于BA.1亚型感染患儿(5/19,26.3%),淋巴细胞计数降低百分比(17/24,70.8%)亦高于BA.1亚型患儿(1/19,5.3%)(χ2=6.910和18.734,P=0.009和P<0.001]。与成人病例相比,BA.2亚型感染患儿发热比例更高[(16/24,66.7%)比(19/56,33.9%),χ2=7.317,P=0.007)]。成人和儿童BA.2亚型鼻拭子两周内病毒载量均呈先上升后下降趋势,下降幅度比BA.1亚型更快。
成人2019-nCoV Omicron变异株BA.2亚型感染者入院时基线病毒载量高,早期传染性更强,但病毒载量下降更快,儿童BA.2亚型感染者发热比例和淋巴细胞计数降低百分比更高,提示BA.2亚型防控形势更加严峻。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
奥密克戎(Omicron)变异株是一种新近出现的新型冠状病毒(2019-nCoV)高度变异毒株,2021年11月下旬在非洲南部地区首例报道Omicron(B.1.1.529),被世界卫生组织(WHO)指定为值得关注的2019-nCoV变种[1]。国外研究表明,与之前的德尔塔(Delta)株相比,Omicron变异株可能具有更强的传染性,传播更快,再感染率更高,同时更易在已接种疫苗的人群中免疫逃避,发生突破性感染[2,3]。根据GISAID网站(https://www.gisaid.org/hcov19-variants/)检测数据显示,截止2022年3月1日,全球已有157个国家170多万人感染了Omicron变异株,这个数字还在增长。Omicron变异株已成为全球优势流行株。目前已知Omicron变异株分为BA.1、BA.2和BA.3三个亚型,变异率高[4]。有报道指出,BA.2亚型可能比BA.1亚型具有更高的传播率和更强的传染性[5],但其对疾病严重程度的影响相关临床研究目前较少。本文对Omicron变异株BA.1亚型和BA.2亚型感染者的临床特征进行回顾性分析,旨在为Omicron变异株不同亚型感染者的防控和诊治提供一些信息。
纳入2022年1月13日至3月8日中山大学附属第五医院收治的122例2019-nCoV Omicron变异株感染者,其中成人79例,年龄15~90岁,BA.1亚型23例,BA.2亚型56例;儿童43例,年龄0~14岁,BA.1亚型19例,BA.2亚型24例。感染者包括确诊病例和无症状感染者。确诊病例诊断标准参照《新型冠状病毒肺炎诊疗方案(试行第八版)》[6]:有2019-nCoV流行病学史和临床表现,符合疑似病例的诊断,同时具备以下病原学或血清学证据之一者:(1)实时荧光RT-PCR检测2019-nCoV核酸阳性;(2)病毒基因测序,与已知的2019-nCoV高度同源;(3)2019-nCoV特异性IgM抗体和IgG抗体阳性;(4)2019-nCoV IgG抗体由阴性转为阳性或恢复期IgG抗体较急性期呈4倍及以上升高。无症状感染者定义参照《新型冠状病毒肺炎防控方案(第八版)》[7]:2019-nCoV病原学检测呈阳性,无相关临床表现,如发热、干咳、乏力、咽痛、嗅(味)觉减退及腹泻等可自我感知或可临床识别的症状和体征,且肺部CT影像学无新型冠状病毒肺炎(COVID-19)影像学特征者。无症状感染者需集中隔离医学观察,具有发展为确诊病例的可能,也纳入研究分析。纳入标准:(1)符合COVID-19确诊病例诊断标准或无症状感染者定义;(2)2019-nCoV全基因组测序和序列分析结果为Omicron变异株BA.1亚型或BA.2亚型。排除标准:2019-nCoV全基因组测序和序列分析结果为阴性或测序不成功。本研究经中山大学附属第五医院医学伦理委员会审批通过(2022第K09-1号)。
收集患者的一般资料、临床症状、新型冠状病毒疫苗(新冠疫苗)接种情况、实验室数据、2019-nCoV全基因组测序和序列分析结果、胸部CT检查结果、病情分型。实验室检验数据收集至入院前24 h,其他临床资料收集至患者达到出院标准。按不同亚型感染分为BA.1亚型组和BA.2亚型组。按年龄分层分为成人组和儿童组。比较不同亚型感染者和不同年龄感染者的临床特点,并进一步分析不同亚型感染的病毒载量变化特点。
采用SPSS 25.0软件进行分析。计量资料用中位数(M)和上下四分位数(Q1,Q3)表示,采用Mann-Whitney U检验或Kruskal-Wallis H检验。计数资料以例数(百分数)表示,采用χ2检验或Fisher确切概率法。双侧P<0.05为差异具有统计学意义。
BA.1亚型感染者42例,其中成人23例,儿童19例。BA.2亚型感染者80例,其中成人56例,儿童24例。两种亚型感染的成人与儿童的基线病毒载量与病例分型上差异无统计学意义。在BA.2亚型感染者中,儿童发热比例更高,差异具有统计学意义(χ2=7.317,P=0.007)。成人病例完成3针新冠疫苗接种比例更高(χ2=24.818和47.624,P值均<0.001)(表1)。
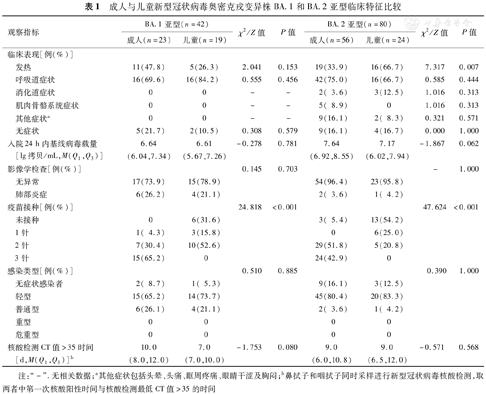
成人与儿童新型冠状病毒奥密克戎变异株BA.1和BA.2亚型临床特征比较
成人与儿童新型冠状病毒奥密克戎变异株BA.1和BA.2亚型临床特征比较
| 观察指标 | BA.1亚型(n=42) | χ2/Z值 | P值 | BA.2亚型(n=80) | χ2/Z值 | P值 | |||
|---|---|---|---|---|---|---|---|---|---|
| 成人(n=23) | 儿童(n=19) | 成人(n=56) | 儿童(n=24) | ||||||
| 临床表现[例(%)] | |||||||||
| 发热 | 11(47.8) | 5(26.3) | 2.041 | 0.153 | 19(33.9) | 16(66.7) | 7.317 | 0.007 | |
| 呼吸道症状 | 16(69.6) | 16(84.2) | 0.555 | 0.456 | 42(75.0) | 16(66.7) | 0.585 | 0.444 | |
| 消化道症状 | 0 | 0 | - | - | 2( 3.6) | 3(12.5) | 1.016 | 0.313 | |
| 肌肉骨骼系统症状 | 0 | 0 | - | - | 5( 8.9) | 0 | 1.016 | 0.313 | |
| 其他症状a | 0 | 0 | - | - | 9(16.1) | 2( 8.3) | 0.321 | 0.571 | |
| 无症状 | 5(21.7) | 2(10.5) | 0.308 | 0.579 | 9(16.1) | 4(16.7) | 0.000 | 1.000 | |
| 入院24 h内基线病毒载量[lg拷贝/mL,M(Q1,Q3)] | 6.64(6.04,7.34) | 6.61(5.67,7.26) | -0.278 | 0.781 | 7.64(6.92,8.55) | 7.17(6.02,7.94) | -1.867 | 0.062 | |
| 影像学检查[例(%)] | 0.145 | 0.703 | - | 1.000 | |||||
| 无异常 | 17(73.9) | 15(78.9) | 54(96.4) | 23(95.8) | |||||
| 肺部炎症 | 6(26.2) | 4(21.1) | 2( 3.6) | 1( 4.2) | |||||
| 疫苗接种[例(%)] | 24.818 | <0.001 | 47.624 | <0.001 | |||||
| 未接种 | 0 | 6(31.6) | 3( 5.4) | 13(54.2) | |||||
| 1针 | 1( 4.3) | 3(15.8) | 0 | 6(25.0) | |||||
| 2针 | 7(30.4) | 10(52.6) | 29(51.8) | 5(20.8) | |||||
| 3针 | 15(65.2) | 0 | 24(42.9) | 0 | |||||
| 感染类型[例(%)] | 0.510 | 0.885 | 0.390 | 1.000 | |||||
| 无症状感染者 | 2( 8.7) | 1( 5.3) | 9(16.1) | 3(12.5) | |||||
| 轻型 | 15(65.2) | 14(73.7) | 45(80.4) | 20(83.3) | |||||
| 普通型 | 6(26.1) | 4(21.1) | 2( 3.6) | 1( 4.2) | |||||
| 重型 | 0 | 0 | 0 | 0 | |||||
| 危重型 | 0 | 0 | 0 | 0 | |||||
| 核酸检测CT值>35时间[d,M(Q1,Q3)]b | 10.0(8.0,12.0) | 7.0(7.0,10.0) | -1.753 | 0.080 | 9.0(6.0,10.8) | 9.0(6.5,12.0) | -0.571 | 0.568 | |
注:"-".无相关数据;a其他症状包括头晕、头痛、眶周疼痛、眼睛干涩及胸闷;b鼻拭子和咽拭子同时采样进行新型冠状病毒核酸检测,取两者中第一次核酸阳性时间与核酸检测最低CT值>35的时间
79例成人病例中,Omicron BA.1亚型组女性患者比例高于BA.2亚型组(χ2=7.930,P=0.005),与BA.1亚型组相比,BA.2亚型组基线病毒载量更高、肺部影像学改变者更少、无症状感染者和轻型病例更多,差异均有统计学意义(Z=-3.022,χ2=6.776和8.052,P=0.003、0.009和0.012)。BA.1亚型和BA.2亚型红细胞沉降率差异具有统计学意义(Z=-3.166,P=0.002),但均处于正常范围之内。两组淋巴细胞计数低于正常参考值范围比例均超过50%(表2) 。
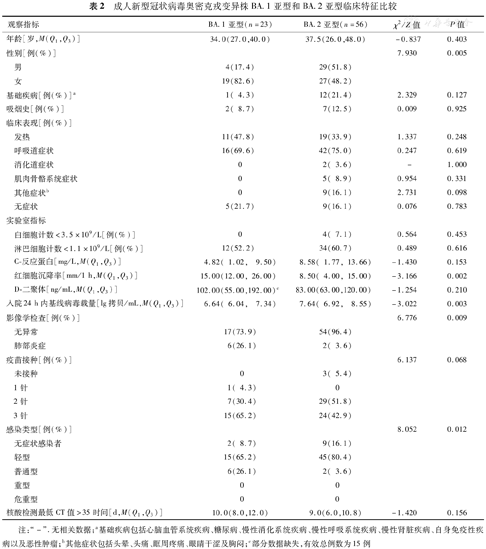
成人新型冠状病毒奥密克戎变异株BA.1亚型和BA.2亚型临床特征比较
成人新型冠状病毒奥密克戎变异株BA.1亚型和BA.2亚型临床特征比较
| 观察指标 | BA.1亚型(n=23) | BA.2亚型(n=56) | χ2/Z值 | P值 | |
|---|---|---|---|---|---|
| 年龄[岁,M(Q1,Q3)] | 34.0(27.0,40.0) | 37.5(26.0,48.0) | -0.837 | 0.403 | |
| 性别[例(%)] | 7.930 | 0.005 | |||
| 男 | 4(17.4) | 29(51.8) | |||
| 女 | 19(82.6) | 27(48.2) | |||
| 基础疾病[例(%)]a | 1( 4.3) | 12(21.4) | 2.329 | 0.127 | |
| 吸烟史[例(%)] | 2( 8.7) | 7(12.5) | 0.009 | 0.925 | |
| 临床表现[例(%)] | |||||
| 发热 | 11(47.8) | 19(33.9) | 1.337 | 0.248 | |
| 呼吸道症状 | 16(69.6) | 42(75.0) | 0.247 | 0.619 | |
| 消化道症状 | 0 | 2( 3.6) | - | 1.000 | |
| 肌肉骨骼系统症状 | 0 | 5( 8.9) | 0.954 | 0.331 | |
| 其他症状b | 0 | 9(16.1) | 2.731 | 0.098 | |
| 无症状 | 5(21.7) | 9(16.1) | 0.076 | 0.783 | |
| 实验室指标 | |||||
| 白细胞计数<3.5×109/L[例(%)] | 0 | 4( 7.1) | 0.564 | 0.453 | |
| 淋巴细胞计数<1.1×109/L[例(%)] | 12(52.2) | 34(60.7) | 0.489 | 0.616 | |
| C-反应蛋白[mg/L,M(Q1,Q3)] | 4.82( 1.02, 9.50) | 8.58( 1.77, 13.66) | -1.430 | 0.153 | |
| 红细胞沉降率[mm/1 h,M(Q1,Q3)] | 15.00(12.00, 26.00) | 8.50( 4.00, 15.00) | -3.166 | 0.002 | |
| D-二聚体[ng/mL,M(Q1,Q3)] | 102.00(55.00,192.00)c | 83.00(63.00,120.00) | -1.254 | 0.210 | |
| 入院24 h内基线病毒载量[lg拷贝/mL,M(Q1,Q3)] | 6.64( 6.04, 7.34) | 7.64( 6.92, 8.55) | -3.022 | 0.003 | |
| 影像学检查[例(%)] | 6.776 | 0.009 | |||
| 无异常 | 17(73.9) | 54(96.4) | |||
| 肺部炎症 | 6(26.1) | 2( 3.6) | |||
| 疫苗接种[例(%)] | 6.137 | 0.068 | |||
| 未接种 | 0 | 3( 5.4) | |||
| 1针 | 1( 4.3) | 0 | |||
| 2针 | 7(30.4) | 29(51.8) | |||
| 3针 | 15(65.2) | 24(42.9) | |||
| 感染类型[例(%)] | 8.052 | 0.012 | |||
| 无症状感染者 | 2( 8.7) | 9(16.1) | |||
| 轻型 | 15(65.2) | 45(80.4) | |||
| 普通型 | 6(26.1) | 2( 3.6) | |||
| 重型 | 0 | 0 | |||
| 危重型 | 0 | 0 | |||
| 核酸检测最低CT值>35时间[d,M(Q1,Q3)] | 10.0(8.0,12.0) | 9.0(6.0,10.8) | -1.420 | 0.156 | |
注:"-".无相关数据;a基础疾病包括心脑血管系统疾病、糖尿病、慢性消化系统疾病、慢性呼吸系统疾病、慢性肾脏疾病、自身免疫性疾病以及恶性肿瘤;b其他症状包括头晕、头痛、眶周疼痛、眼睛干涩及胸闷;c部分数据缺失,有效总例数为15例
与BA.1亚型组相比,BA.2亚型组发热比例和淋巴细胞计数降低百分比更高,差异均有统计学意义(χ2=6.910和18.734,P=0.009和P<0.001)(表3)。
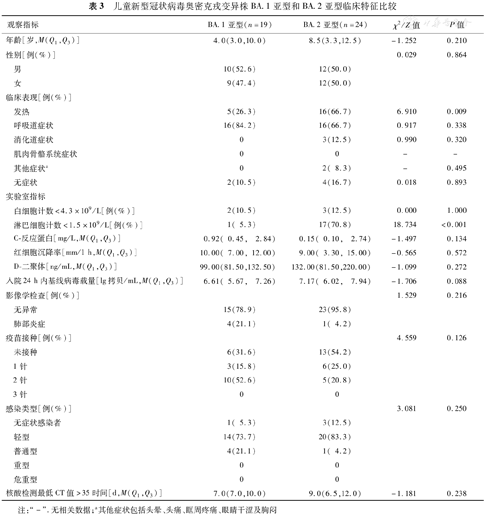
儿童新型冠状病毒奥密克戎变异株BA.1亚型和BA.2亚型临床特征比较
儿童新型冠状病毒奥密克戎变异株BA.1亚型和BA.2亚型临床特征比较
| 观察指标 | BA.1亚型(n=19) | BA.2亚型(n=24) | χ2/Z值 | P值 | |
|---|---|---|---|---|---|
| 年龄[岁,M(Q1,Q3)] | 4.0(3.0,10.0) | 8.5(3.3,12.5) | -1.252 | 0.210 | |
| 性别[例(%)] | 0.029 | 0.864 | |||
| 男 | 10(52.6) | 12(50.0) | |||
| 女 | 9(47.4) | 12(50.0) | |||
| 临床表现[例(%)] | |||||
| 发热 | 5(26.3) | 16(66.7) | 6.910 | 0.009 | |
| 呼吸道症状 | 16(84.2) | 16(66.7) | 0.917 | 0.338 | |
| 消化道症状 | 0 | 3(12.5) | 0.990 | 0.320 | |
| 肌肉骨骼系统症状 | 0 | 0 | - | - | |
| 其他症状a | 0 | 2( 8.3) | - | 0.495 | |
| 无症状 | 2(10.5) | 4(16.7) | 0.018 | 0.893 | |
| 实验室指标 | |||||
| 白细胞计数<4.3×109/L[例(%)] | 2(10.5) | 3(12.5) | 0.000 | 1.000 | |
| 淋巴细胞计数<1.5×109/L[例(%)] | 1( 5.3) | 17(70.8) | 18.734 | <0.001 | |
| C-反应蛋白[mg/L,M(Q1,Q3)] | 0.92( 0.45, 2.84) | 0.15( 0.10, 2.74) | -1.497 | 0.134 | |
| 红细胞沉降率[mm/1 h,M(Q1,Q3)] | 10.00( 7.00, 12.00) | 9.00( 3.30, 15.00) | -0.565 | 0.572 | |
| D-二聚体[ng/mL,M(Q1,Q3)] | 99.00(81.50,132.50) | 132.00(81.50,220.00) | -1.099 | 0.272 | |
| 入院24 h内基线病毒载量[lg拷贝/mL,M(Q1,Q3)] | 6.61( 5.67, 7.26) | 7.17( 6.02, 7.94) | -1.706 | 0.088 | |
| 影像学检查[例(%)] | 1.529 | 0.216 | |||
| 无异常 | 15(78.9) | 23(95.8) | |||
| 肺部炎症 | 4(21.1) | 1( 4.2) | |||
| 疫苗接种[例(%)] | 4.559 | 0.126 | |||
| 未接种 | 6(31.6) | 13(54.2) | |||
| 1针 | 3(15.8) | 6(25.0) | |||
| 2针 | 10(52.6) | 5(20.8) | |||
| 3针 | 0 | 0 | |||
| 感染类型[例(%)] | 3.081 | 0.250 | |||
| 无症状感染者 | 1( 5.3) | 3(12.5) | |||
| 轻型 | 14(73.7) | 20(83.3) | |||
| 普通型 | 4(21.1) | 1( 4.2) | |||
| 重型 | 0 | 0 | |||
| 危重型 | 0 | 0 | |||
| 核酸检测最低CT值>35时间[d,M(Q1,Q3)] | 7.0(7.0,10.0) | 9.0(6.5,12.0) | -1.181 | 0.238 | |
注:"-".无相关数据;a其他症状包括头晕、头痛、眶周疼痛、眼睛干涩及胸闷
79例成人病例中,3例未接种新冠疫苗,1例接种了1针新冠疫苗,36例接种了2针新冠疫苗,39例接种了3针新冠疫苗。与接种3针新冠疫苗病例比较,接种2针者淋巴细胞计数降低比例更高、基线病毒载量更高(χ2=6.274,Z=-2.312,P=0.012和0.021)(表4)。
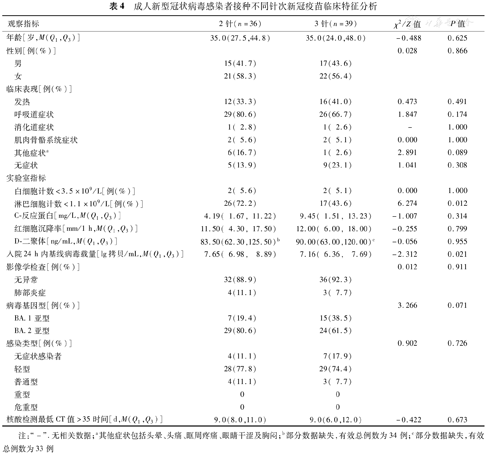
成人新型冠状病毒感染者接种不同针次新冠疫苗临床特征分析
成人新型冠状病毒感染者接种不同针次新冠疫苗临床特征分析
| 观察指标 | 2针(n=36) | 3针(n=39) | χ2/Z值 | P值 | |
|---|---|---|---|---|---|
| 年龄[岁,M(Q1,Q3)] | 35.0(27.5,44.8) | 35.0(24.0,48.0) | -0.488 | 0.625 | |
| 性别[例(%)] | 0.028 | 0.866 | |||
| 男 | 15(41.7) | 17(43.6) | |||
| 女 | 21(58.3) | 22(56.4) | |||
| 临床表现[例(%)] | |||||
| 发热 | 12(33.3) | 16(41.0) | 0.473 | 0.491 | |
| 呼吸道症状 | 29(80.6) | 26(66.7) | 1.847 | 0.174 | |
| 消化道症状 | 1( 2.8) | 1( 2.6) | - | 1.000 | |
| 肌肉骨骼系统症状 | 2( 5.6) | 2( 5.1) | 0.000 | 1.000 | |
| 其他症状a | 6(16.7) | 1( 2.6) | 2.891 | 0.089 | |
| 无症状 | 5(13.9) | 9(23.1) | 1.041 | 0.308 | |
| 实验室指标 | |||||
| 白细胞计数<3.5×109/L[例(%)] | 2( 5.6) | 2( 5.1) | 0.000 | 1.000 | |
| 淋巴细胞计数<1.1×109/L[例(%)] | 26(72.2) | 17(43.6) | 6.274 | 0.012 | |
| C-反应蛋白[mg/L,M(Q1,Q3)] | 4.19( 1.67, 11.22) | 9.45( 1.51, 13.23) | -1.007 | 0.314 | |
| 红细胞沉降率[mm/1 h,M(Q1,Q3)] | 11.50( 4.30, 17.50) | 12.00( 6.00, 18.00) | -0.255 | 0.799 | |
| D-二聚体[ng/mL,M(Q1,Q3)] | 83.50(62.30,125.50)b | 90.00(63.00,120.00)c | -0.056 | 0.955 | |
| 入院24 h内基线病毒载量[lg拷贝/mL,M(Q1,Q3)] | 7.65( 6.98, 8.89) | 7.16( 6.36, 7.69) | -2.312 | 0.021 | |
| 影像学检查[例(%)] | 0.012 | 0.911 | |||
| 无异常 | 32(88.9) | 36(92.3) | |||
| 肺部炎症 | 4(11.1) | 3( 7.7) | |||
| 病毒基因型[例(%)] | 3.266 | 0.071 | |||
| BA.1亚型 | 7(19.4) | 15(38.5) | |||
| BA.2亚型 | 29(80.6) | 24(61.5) | |||
| 感染类型[例(%)] | 0.902 | 0.726 | |||
| 无症状感染者 | 4(11.1) | 7(17.9) | |||
| 轻型 | 28(77.8) | 29(74.4) | |||
| 普通型 | 4(11.1) | 3( 7.7) | |||
| 重型 | 0 | 0 | |||
| 危重型 | 0 | 0 | |||
| 核酸检测最低CT值>35时间[d,M(Q1,Q3)] | 9.0(8.0,11.0) | 9.0(6.0,12.0) | -0.422 | 0.673 | |
注:"-".无相关数据;a其他症状包括头晕、头痛、眶周疼痛、眼睛干涩及胸闷;b部分数据缺失,有效总例数为34例;c部分数据缺失,有效总例数为33例
43例儿童病例中,19例未接种新冠疫苗,9例接种1针新冠疫苗,15例接种2针新冠疫苗,无完成3针新冠疫苗接种病例。3组比较中,未接种新冠疫苗者年龄最小,男性比例较高,接种2针者年龄最大,女性比例较高(H=13.974,χ2=7.540,P=0.001和0.023)。未接种新冠疫苗感染者发热比例最高,核酸检测最低CT值>35时间最长,3组比较差异具有统计学意义(χ2=12.670,H=7.531,P=0.002和0.023)。未接种新冠疫苗者和接种1针者轻型病例均超过88%,接种2针者轻型病例约50%,3组比较差异有统计学意义(χ2=9.035,P=0.021)(表5) 。
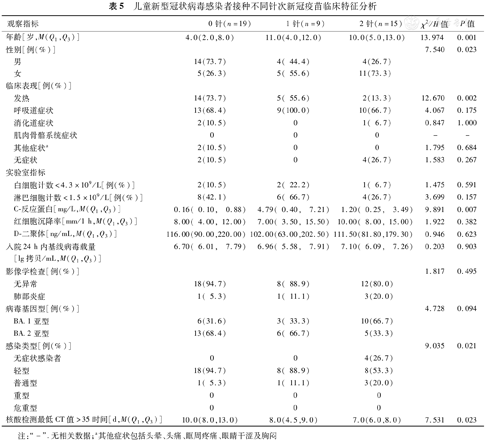
儿童新型冠状病毒感染者接种不同针次新冠疫苗临床特征分析
儿童新型冠状病毒感染者接种不同针次新冠疫苗临床特征分析
| 观察指标 | 0针(n=19) | 1针(n=9) | 2针(n=15) | χ2/H值 | P值 | |
|---|---|---|---|---|---|---|
| 年龄[岁,M(Q1,Q3)] | 4.0(2.0,8.0) | 11.0(4.0,12.0) | 10.0(5.0,13.0) | 13.974 | 0.001 | |
| 性别[例(%)] | 7.540 | 0.023 | ||||
| 男 | 14(73.7) | 4( 44.4) | 4(26.7) | |||
| 女 | 5(26.3) | 5( 55.6) | 11(73.3) | |||
| 临床表现[例(%)] | ||||||
| 发热 | 14(73.7) | 5( 55.6) | 2(13.3) | 12.670 | 0.002 | |
| 呼吸道症状 | 13(68.4) | 9(100.0) | 10(66.7) | 4.067 | 0.175 | |
| 消化道症状 | 2(10.5) | 0 | 1( 6.7) | 0.847 | 1.000 | |
| 肌肉骨骼系统症状 | 0 | 0 | 0 | - | - | |
| 其他症状a | 2(10.5) | 0 | 0 | 1.795 | 0.684 | |
| 无症状 | 2(10.5) | 0 | 4(26.7) | 1.583 | 0.267 | |
| 实验室指标 | ||||||
| 白细胞计数<4.3×109/L[例(%)] | 2(10.5) | 2( 22.2) | 1( 6.7) | 1.475 | 0.591 | |
| 淋巴细胞计数<1.5×109/L[例(%)] | 8(42.1) | 6( 66.7) | 4(26.7) | 3.699 | 0.157 | |
| C-反应蛋白[mg/L,M(Q1,Q3)] | 0.16( 0.10, 0.88) | 4.79( 0.40, 7.21) | 1.20( 0.25, 3.49) | 9.891 | 0.007 | |
| 红细胞沉降率[mm/1 h,M(Q1,Q3)] | 8.00( 4.00, 12.00) | 7.00( 3.50, 15.50) | 10.00( 8.00, 15.00) | 1.922 | 0.382 | |
| D-二聚体[ng/mL,M(Q1,Q3)] | 116.00(90.00,220.00) | 102.00(63.00,202.50) | 111.50(81.80,179.30) | 0.946 | 0.623 | |
| 入院24 h内基线病毒载量[lg拷贝/mL,M(Q1,Q3)] | 6.70( 6.01, 7.79) | 6.96( 5.58, 7.91) | 7.10( 6.09, 7.26) | 0.203 | 0.903 | |
| 影像学检查[例(%)] | 1.817 | 0.495 | ||||
| 无异常 | 18(94.7) | 8( 88.9) | 12(80.0) | |||
| 肺部炎症 | 1( 5.3) | 1( 11.1) | 3(20.0) | |||
| 病毒基因型[例(%)] | 4.728 | 0.094 | ||||
| BA.1亚型 | 6(31.6) | 3( 33.3) | 10(66.7) | |||
| BA.2亚型 | 13(68.4) | 6( 66.7) | 5(33.3) | |||
| 感染类型[例(%)] | 9.035 | 0.021 | ||||
| 无症状感染者 | 0 | 0 | 4(26.7) | |||
| 轻型 | 18(94.7) | 8( 88.9) | 8(53.3) | |||
| 普通型 | 1( 5.3) | 1( 11.1) | 3(20.0) | |||
| 重型 | 0 | 0 | 0 | |||
| 危重型 | 0 | 0 | 0 | |||
| 核酸检测最低CT值>35时间[d,M(Q1,Q3)] | 10.0(8.0,13.0) | 8.0(4.5,9.0) | 7.0(6.0,8.0) | 7.531 | 0.023 | |
注:"-".无相关数据;a其他症状包括头晕、头痛、眶周疼痛、眼睛干涩及胸闷
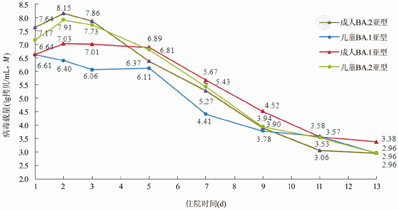
比较BA.1亚型和BA.2亚型感染者鼻拭子样本中2019-nCoV载量两周内的变化情况,BA.2亚型感染第1天的病毒载量较BA.1亚型高,呈先上升后下降趋势,在第3天开始明显下降,下降幅度更快。BA.1亚型成人感染者第1~2天病毒载量轻度上升,后缓慢下降,儿童感染者第1~3天病毒载量缓慢下降,二者均在感染第5天开始明显下降。BA.1亚型和BA.2亚型在感染第13天时病毒载量均低于3.5 lg拷贝/mL(图1)。

目前全球COVID-19疫情形势仍然十分严峻,尤其是Omicron变异株出现后,其高传播力、高感染率、高变异率和免疫逃避进一步加剧了疫情防控的困难[8]。本研究回顾性分析了珠海市2022年1至3月输入性及本土Omicron变异株BA.1亚型和BA.2亚型感染的COVID-19患者的临床特征差异,可以为2019-nCoV Omicron变异株感染者的防控和诊治提供临床证据。
本研究发现,在成人病例中,与BA.1亚型相比,BA.2亚型入院时基线病毒载量更高,表明BA.2亚型比BA.1亚型早期传染力更强。英国健康安全局指出BA.2亚型比BA.1亚型具有明显的增长优势[5],未来BA.2亚型可能取代BA.1亚型成为主要流行株。BA.2亚型为BA.1亚型之后出现的新的突变分支,有报道指出,BA.1亚型突变率高,感染和复制能力可能已经受到影响,而BA.2亚型突变较少,免疫逃避能力强,因此保持了良好的传播性和传染性[9]。这提示Omicron变异株BA.2亚型的防控比BA.1亚型更加困难。
在临床分型和临床表现上,成人病例BA.2亚型无症状感染者和轻型病例占比更高,肺部影像学改变更少。BA.2亚型和BA.1亚型感染者临床表现无明显差异,除淋巴细胞计数降低外其他实验室检验指标均处于正常水平,表明二者临床严重程度并无明显差异。在丹麦、英国、南非等报道中指出,与BA.1亚型比较,BA.2亚型传染性更强,但不会加重疾病严重程度[10]。丹麦政府运营的传染病研究中心初步分析显示,BA.2亚型更具传染性,发展迅速,但感染者入院率不高[11],但是目前尚未有更详细、大型的临床研究进一步证实该观点。儿童病例中,两组感染类型的比较未见明显差异,BA.2亚型发热比例较BA.1亚型更高,淋巴细胞计数明显比BA.1亚型降低,但考虑到本研究纳入的儿童病例较少,可能会对结果产生一定的偏移。总体来说,BA.2亚型的病例分型要比BA.1亚型更轻,对个体的健康风险更小。
在BA.1亚型和BA.2亚型两周内病毒载量变化的比较中发现,BA.1亚型感染者入院时基线病毒载量比BA.2亚型低,但病毒载量下降幅度较缓,于第5天才出现明显下降趋势。BA.2亚型感染者入院时基线病毒载量高,呈先上升后下降趋势,下降幅度比BA.1亚型更快,从病毒学的角度上看,BA.2亚型来得快,去得快,早期传染性更强,更隐匿,进一步验证了BA.2亚型的防控更加困难。另外,两种亚型感染者的病毒核酸检测最低CT值>35时间在不同年龄组中差异无统计学意义。感染者随着机体对感染产生免疫应答,病毒载量会越来越低,CT值则越来越高[12]。CT值>35时,病毒载量已明显下降,传染性降低。最新发布的《新型冠状病毒肺炎诊疗方案(试行第九版)》[13]中指出,连续两次2019-nCoV PCR检测N基因和ORF基因CT值均≥35(界限值为40)即达到出院或解除隔离标准。表明虽然BA.2亚型早期病毒载量更高,但病毒载量下降至达到出院或解除隔离的时长两组差异无统计学意义,这可能为BA.2亚型感染者的防控策略制定提供了一些信息。推测可能与病毒毒株变异突变后毒力减弱有关,但目前相关研究较少,也有可能与接种新冠疫苗后机体免疫水平提高有关。
本研究发现,尽管两种亚型感染的儿童和成人的基线病毒载量和病例分型无明显差异,但BA.2亚型感染患儿发热比例更高,这可能与患儿本身免疫系统未成熟或与新冠疫苗的接种有关。成人病例中有超过90%病例接种了2针或者3针加强针疫苗,而儿童病例中,BA.1亚型有超过一半接种了2针疫苗,而BA.2亚型仅有20.8%。这或许可以解释为何BA.2亚型儿童病例中发热比例更高。在早期的调查中发现,与BA.1亚型相比,现有疫苗对BA.2亚型的保护效力并没有明显降低[14]。2022年3月8日WHO发出的一份声明指出,目前的疫苗似乎对Omicron变异株感染相关的疾病结果具有高水平的保护作用,因此仍然支持接种新冠疫苗,包括完成加强针的接种,特别是有发展为严重疾病风险的群体,如老人和儿童[15]。
本研究存在一些局限性:第一,本研究为单中心研究,纳入的样本量较少,尤其是儿童病例,可能会对结果产生偏移,但希望能通过早期的初步研究,为2019-nCoV Omicron变异株不同亚型感染者的防控和治疗提供依据;第二,由于部分病例数据缺失,本研究未能计算接种疫苗时间至感染时间间隔的时长,有研究指出,接种疫苗时间至感染时间的间隔与不同2019-nCoV变异株突破性感染有关[16],但尚未有研究表明在Omicron变异株不同亚型中有区别。
综上所述,与2019-nCoV Omicron变异株BA.1亚型相比,成人2019-nCoV Omicron变异株BA.2亚型感染者入院时基线病毒载量更高,早期传染性更强,但病毒载量下降更快,轻症和无症状感染者比例更高,儿童BA.2亚型感染者发热比例更高,淋巴细胞计数降低百分比更高,提示BA.2亚型防控形势更加严峻。新冠疫苗对Omicron变异株感染具有高水平的保护作用,建议完成新冠疫苗全程包括加强针的接种,尤其是高风险群体。
所有作者均声明不存在利益冲突



























