
流行性感冒是严重威胁人类健康的呼吸道传染病之一,因发病率和病死率高,受到研究者的广泛关注。随着医疗技术的进步,免疫抑制患者如恶性肿瘤化疗、造血干细胞移植、实体器官移植、长期血液透析、全身糖皮质激素应用等患者逐年增多。与免疫功能正常者相比,免疫抑制患者流感病毒脱落时间延长,容易对抗病毒药物产生耐药性。本文系统总结了免疫抑制流感患者抗病毒药物应用及耐药情况,并围绕如何应对免疫抑制患者的神经氨酸酶抑制剂耐药问题及暴露后预防性抗病毒药物治疗进行了讨论。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
流行性感冒(简称流感)是由流感病毒引起的急性呼吸道传染病,流感病毒包括甲、乙、丙、丁四种类型,国外研究估测在世界范围内每年约291 243~645 832人死于季节性流感[1],国内研究估测我国每年约88 100人死于季节性流感[2]。随着医疗技术的进步,免疫抑制患者如恶性肿瘤化疗、造血干细胞移植(Haemopoietic stem cell transplants,HSCT)、实体器官移植(Solid organ transplants,SOT)、长期血液透析及全身糖皮质激素、免疫抑制剂、生物制剂应用等患者逐年增多[3,4]。与免疫功能正常者相比,免疫抑制患者病毒脱落时间延长容易对抗病毒药物产生耐药性[5,6],本文就国内外免疫抑制患者流感病毒感染的抗病毒药物应用及耐药情况予以综述,旨在为免疫抑制患者流感病毒感染的抗病毒治疗策略提供参考依据。
抗流感病毒药物主要包括M2离子通道阻滞剂、神经氨酸酶(Neuraminidase,NA)抑制剂、血凝素(Hemagglutinin,HA)抑制剂、RNA依赖RNA聚合酶(RNA-dependent RNA polymerase,RdRp)抑制剂等[7,8],常见抗流感药物的作用位点如图1所示,以下对不同种类抗流感病毒药物予以详述。
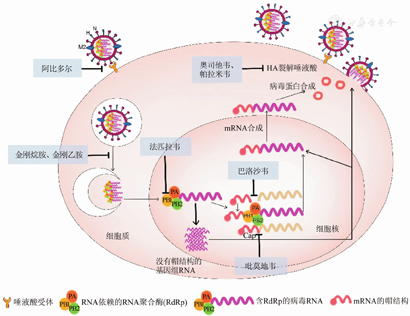

M2离子通道阻滞剂作用机制是阻断流感病毒M2离子通道,从而抑制病毒复制,仅对甲型流感病毒有抑制作用。常用药物包括金刚烷胺、金刚乙胺,但目前流行的流感病毒株对其耐药,国内外指南均已不再推荐[9,10]。
NA抑制剂是目前许多国家治疗流感病毒的一线推荐药物,其作用机制是抑制NA的活性,阻止病毒由被感染细胞释放及入侵相邻细胞,减少病毒在体内复制,对甲型、乙型流感病毒均有抑制作用。常用药物包括奥司他韦、扎那米韦、帕拉米韦、拉尼米韦。奥司他韦和扎那米韦在世界范围内使用,帕拉米韦在中国、日本、韩国和美国获得批准,拉尼米韦在日本获得批准[11]。拉尼米韦是一种长效NA抑制剂,单次吸入这种化合物就足以治疗流感病毒感染[12]。以上4种NA抑制剂在结构上都与NA的天然底物相似,通过占据NA的催化位点起到抑制剂的作用,它们的侧链不同,影响了它们的生物利用度和耐药性[13]。
HA抑制剂作用机制是通过抑制病毒复制早期膜融合发挥抗病毒作用,是一种广谱抗病毒药物[14]。目前应用于临床的是阿比多尔,阿比多尔是一种俄罗斯制造的吲哚衍生物小分子,在俄罗斯和中国获得许可,用于流感和其他呼吸道病毒感染的预防和治疗。最近的研究表明,阿比多尔与膜和蛋白质中的芳香氨基酸的双重相互作用可能是其广谱抗病毒活性的中心,这可能会影响病毒本身和/或细胞功能或病毒-细胞相互作用的关键步骤,从而将阿比多尔定位为直接作用的抗病毒药物和宿主靶向剂[14]。
RdRp抑制剂是一种新型抗病毒化合物,主要作用机制是与RdRp结合并抑制RdRp,最终阻止病毒基因组RNA的转录和复制。由于RdRp结构域在人类细胞中不存在,而在RNA病毒中是高度保守的,RdRp这个特点使其成为抗病毒药物靶点[15]。流感病毒RdRp是一个异三聚体蛋白,包含3个病毒编码的亚基:PB1、PB2和PA,PB1具有聚合酶活性,PB2与宿主mRNA的5′-甲基帽结合,PA对宿主mRNA进行切割产生帽状引物并启动转录[16]。目前常见的RdRp抑制剂主要包括法匹拉韦、吡莫地韦和巴洛沙韦,其作用位点分别为PB1、PB2和PA,三者对甲型流感病毒均有抗病毒作用,包括引起流感大流行的流行株及对目前批准的抗病毒药物耐药的病毒,同时法匹拉韦和巴洛沙韦也抑制乙型流感病毒[17]。法匹拉韦是一种嘌呤核苷类似物(采用二代测序方法发现主要作为鸟嘌呤类似物,其次是腺嘌呤[18]),其作为底物参与RNA合成,导致RNA病毒复制错误,从而导致病毒突变频率的增加,法匹拉韦在体外抑制流感病毒复制的主要机制是致死突变[19]。尽管法匹拉韦在日本已获批准,但它的使用仅限于政府颁发特别许可证的情况,如感染一种新的流感病毒亚型或观察到其他获批抗病毒药物敏感性降低的流感病毒感染,其动物模型研究中观察到致畸性和胚胎毒性,这限制了其在日常治疗流感中的应用[15]。吡莫地韦在普通流感中单独或与奥司他韦联合使用显示抗病毒效果,但在单药治疗期间经常出现敏感性降低的变异[17]。巴洛沙韦是一种帽依赖的核酸内切酶(mRNA合成起始的关键酶)抑制剂,已在包括美国、日本在内的一些国家获得许可,以PA的内切酶活性为目标,可有效缓解症状,并迅速抑制病毒复制,但在单药治疗期间也经常出现敏感性降低的变异[20]。3种常见RdRp抑制剂特点如表1所示[17,21]。
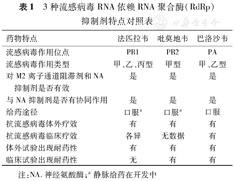
3种流感病毒RNA依赖RNA聚合酶(RdRp)抑制剂特点对照表
3种流感病毒RNA依赖RNA聚合酶(RdRp)抑制剂特点对照表
| 药物特点 | 法匹拉韦 | 吡莫地韦 | 巴洛沙韦 |
|---|---|---|---|
| 流感病毒作用位点 | PB1 | PB2 | PA |
| 流感病毒作用类型 | 甲、乙、丙型 | 甲型 | 甲、乙型 |
| 对M2离子通道阻滞剂和NA抑制剂是否有效 | 是 | 是 | 是 |
| 与NA抑制剂是否有协同作用 | 是 | 是 | 是 |
| 给药途径 | 口服a | 口服a | 口服 |
| 抗流感病毒体外疗效 | 有 | 有 | 有 |
| 抗流感病毒临床疗效 | 各异 | 无数据 | 有 |
| 体外试验出现耐药性 | 有 | 有 | 有 |
| 临床试验出现耐药性 | 无 | 有 | 有 |
注:NA.神经氨酸酶;a静脉给药在开发中
免疫抑制患者病毒脱落时间延长,长时间暴露于抗病毒药物下可促进耐药变异的选择[22],因此免疫抑制患者的病毒耐药问题备受关注。目前一线抗流感药物是NA抑制剂,故抗流感病毒药物耐药相关研究主要集中于NA抑制剂耐药问题。NA抑制剂耐药模式主要有两种,一种在没有药物选择压力的社区流行,另一种局限于抗病毒治疗的免疫抑制患者,前者病毒的适应性未发生变化,后者病毒的适应性发生变化[23]。此外流感病毒的NA亚型也可能在NA抑制剂压力影响下发生NA氨基酸变异,H275Y在N1亚型中占优势,如甲型流感病毒H1N1、H5N1亚型,相比之下,E119V、E119K、R292K、Q136K是甲型流感病毒H3N2亚型对NA抑制剂耐药的分子标记[24,25]。
奥司他韦耐药的甲型H1N1 pdm09流感病例初期主要出现在接受奥司他韦治疗的免疫抑制患者中,Tramontana等[5]报道了2009年澳大利亚多中心17例HSCT和15例恶性肿瘤患者,30例接受奥司他韦治疗的患者中4例出现了H275Y突变,其中3例为HSCT患者,这4例患者病毒脱落时间最长为28 d,最短耐药出现时间为奥司他韦抗病毒治疗4 d后,提示免疫抑制流感患者,尤其是HSCT患者应持续监测流感病毒脱落及抗病毒药物耐药情况。然而,2010至2011年在英国和世界其他地区流感季,发现奥司他韦耐药现象虽主要出现在接受奥司他韦治疗的免疫抑制患者中,但越来越多的奥司他韦耐药患者并没有奥司他韦用药史[26],推测患者可能感染奥司他韦耐药的病毒株。耐奥司他韦的甲型流感病毒H1N1亚型通常在NA蛋白H275Y位点发生突变,通过改变NA催化位点的形状来降低抑制剂的结合能力,为了使奥司他韦正确地结合,NA必须经过重新排列形成一个口袋,这些重排的关键是氨基酸E277旋转并与R225结合,体外建模和X射线晶体学显示,H275Y抑制E277残基的这种旋转,从而防止口袋的形成[8]。这种突变已被证明即使在停止治疗后仍会持续存在,并且这种突变的毒株能够以与野生型毒株相似的方式引起暴发和显著的发病率和病死率[27]。帕拉米韦以类似于奥司他韦的方式与唾液酸残基结合,并且也受到H275Y突变的影响[28]。NA突变一般不会导致对扎那米韦和奥司他韦的交叉耐药,因为这两种药物在化学结构和与NA酶活性位点结合的亲和力方面存在差异,故奥司他韦和帕拉米韦耐药时可选用扎那米韦[29]。L’huillier等[23] 2015年首次报道了HSCT患者扎那米韦治疗期间出现E119D耐药突变。由于NA的结构存在一定的差异,与甲型H1N1 pdm09相比,甲型H3N2流感和乙型流感中出现NA抑制剂耐药的可能性较小,一般不会导致NA功能的显著丧失和病毒适应度的降低。体外和体内研究表明,甲型H3N2流感和乙型流感NA抑制剂耐药株具有较低的复制能力和传播能力,其耐药现象很多出现在抗病毒治疗>10 d甚至>1个月的患者中[26],临床中抗病毒治疗疗程>10 d的患者基本都是免疫抑制患者,因此甲型H3N2流感和乙型流感也主要出现在免疫抑制患者中,与既往文献报道也是相符的[30]。
除NA抑制剂耐药外,其他机制的抗病毒药物耐药也有报道。Blaising等[14]研究发现流感病毒对阿比多尔的耐药性主要来自HA2融合蛋白的突变,这与阿比多尔的抗病毒活性与膜融合有关。PB1亚基K229R突变使得法匹拉韦具有体外抗性[31],PA亚基I38T突变被证明可迅速降低对巴洛沙韦的敏感性[32]。
对治疗没有反应和/或病毒载量持续高和/或接触过疑似或确诊耐药病例的免疫抑制患者在使用NA抑制剂治疗流感时,应监测抗病毒药物的耐药情况,鉴于耐药性变异可能在治疗后的1~2 d内出现(也可能传播),可以在治疗前、治疗中或治疗后的任何时间进行耐药性检测[26]。
免疫抑制患者是重症流感的高危人群,且其病毒脱落时间长容易对抗病毒药物产生耐药性[5,6,33],因此指南建议尽早对免疫抑制患者进行抗病毒治疗,原则上发病48 h内,但超过48 h的重症患者仍可从抗病毒治疗中获益[9,10]。2019年Katzen等[34]将早期抗病毒时间节点提前至6 h,选取2009至2014年5个流感季节中699例流感患者,比较住院后6 h前后接受第一剂抗病毒治疗患者的临床转归,发现6 h内接受NA抑制剂治疗的患者住院时间更短且未出现死亡病例,6 h后接受NA抑制剂治疗的患者病死率为4.5%,可见应尽早予流感患者抗病毒治疗,但此研究也发现免疫抑制患者早期接受NA抑制剂的可能性较小,可能与免疫抑制患者临床症状不典型,流感诊断延迟有关。
NA抑制剂联合应用、剂量加倍、延长疗程等是临床关注的热点问题。在早期的研究中对于免疫抑制患者有NA抑制剂剂量加倍使用的推荐[7,25],但目前研究发现NA抑制剂剂量加倍患者耐受性良好,但与标准剂量相比没有病毒学或临床优势[35,36]。扎那米韦和奥司他韦在化学结构和与NA酶活性位点结合的亲和力方面存在差异,故奥司他韦和帕拉米韦耐药时可选用扎那米韦[29],但帕拉米韦与奥司他韦作用位点相同[28],一般不建议奥司他韦及帕拉米韦联合用药。免疫抑制患者如果症状持续,病毒检测持续阳性,可考虑延长抗病毒治疗时间[37]。综上所述,不推荐免疫抑制患者双倍剂量或联合应用两种NA抑制剂治疗,鉴于免疫抑制患者病毒脱落时间延长,可考虑适当延长抗病毒治疗时间[9,10,38]。
英国公共卫生部(Public Health England,PHE)指南建议奥司他韦是免疫正常患者的一线抗病毒药物,但对于免疫抑制患者,NA抑制剂的选择要基于当时季节的流行优势株,当流行优势株对奥司他韦的耐药风险较低(如甲型H3N2和乙型流感),建议使用奥司他韦,如流行优势株对奥司他韦的耐药风险较高(如甲型H1N1 pdm09流感),建议使用扎那米韦[39]。在我国,国家流感中心每周公布流感病毒株流行及耐药情况,应实时关注流感优势株变化以指导免疫抑制患者抗病毒治疗。
(1)新型抗病毒药物的开发和临床应用。可以尝试针对流感病毒高度保守特征的新疗法,如HA抑制剂、RdRp抑制剂。HA抑制剂如阿比多尔在俄罗斯和中国用于流感已有多年,但似乎没有产生高度的病毒耐药性,俄罗斯多项研究显示,分离的流感流行株均对阿比多尔敏感[14,40]。此外近期研究发现阿比多尔除抑制病毒复制早期膜融合外,还有免疫调节活性,通过调节流感感染小鼠的促炎细胞因子的表达,降低了病死率、肺损伤的形成和病毒诱导的炎症反应[41]。RdRp抑制剂以法匹拉韦、巴洛沙韦为例,法匹拉韦具有异常高的耐药屏障,目前体外试验有个别耐药位点突变的报道[42],但在Ⅲ期临床试验中,未发现对法匹拉韦耐药的病毒株[43]。2020年Harada等[44]报道了1例巴洛沙韦成功治疗异基因造血细胞移植后E119D/R292K双位点帕拉米韦耐药的H3N2流感。2021年Macesic等[45]报道了2例巴洛沙韦成功治疗免疫缺陷患者奥司他韦耐药的甲型H1N1 pdm09流感。(2)不同作用位点药物联合应用。联合治疗被认为是解决免疫抑制患者抗病毒药物耐药问题的最佳策略之一,在病毒复制周期中使用两种或两种以上针对病毒不同蛋白的抗病毒药物已被证明可以减少体外病毒的复制[46]。2018年Kiso等[47]对流感病毒A/California/04/2009(H1N1)感染免疫缺陷裸鼠给予奥司他韦、拉尼米韦或法匹拉韦或其组合治疗,在免疫缺陷的宿主中联合治疗可以延长生存时间,但不能抑制NA抑制剂耐药变异的出现。同年Baz等[48]学者发表的研究结果与之一致,在甲型H1N1 pdm09流感病毒感染的免疫抑制小鼠模型中采用奥司他韦(20 mg/kg)、法匹拉韦(20 mg/kg或50 mg/kg)或两种药物联合治疗(2次/d,给药5 d或10 d),评估患病小鼠体质量损失、存活率、肺组织病毒载量、细胞因子水平和病毒耐药情况,研究发现法匹拉韦(50 mg/kg)联合奥司他韦(20 mg/kg)与奥司他韦单药治疗10 d相比存活率升高、肺组织病毒载量下降,但同样并不能阻止奥司他韦H275Y耐药突变出现。2020年Checkmahomed等[20]对甲型H1N1 pdm09和H3N2流感病毒采用CompuSyn软件测定药物间的协同或拮抗作用。巴洛沙韦与任何一种NA抑制剂联合具有协同作用,巴洛沙韦与法匹拉韦联合也具有较高的协同活性,但巴洛沙韦与利巴韦林的联合具有拮抗效应。对于甲型H1N1 pdm09亚型流感病毒两种药物组合的抗病毒效果高于单药治疗,特别是在巴洛沙韦+扎那米韦/奥司他韦的情况下,与最有效的单一药物治疗相比,在所有时间点的平均病毒载量至少降低了1 lg;对于甲型H3N2亚型流感病毒两种药物组合的抗病毒效果也高于单一药物治疗,巴洛沙韦+奥司他韦组合获得了最佳协同效果,在48 h平均病毒载量降低了3 lg,在72 h平均病毒载量降低了2 lg。2020年Kiso等[49]发表研究法匹拉韦与抗HA和抗受体结合位点的单克隆抗体的三联疗法完全阻止了流感病毒在裸鼠中的复制,促使病毒清除,提示人类免疫功能低下的重症流感患者可考虑三联疗法治疗。以上研究尚处于动物实验或体外试验阶段,免疫抑制流感患者临床效果如何尚需进一步研究。(3)调节宿主炎症反应,保护上皮细胞。临床和实验证据表明,流感病毒感染的结局不仅取决于病毒的传播,还取决于宿主的炎症反应和肺上皮损伤,免疫调节药物及针对上皮细胞的药物作为奥司他韦或其他抗病毒药物辅助用药的可行性还需要进一步研究进行评估[8]。
免疫抑制人群疫苗反应程度常低于免疫功能正常人群,在获得疫苗有效保护之前,抗病毒药物被认为是流感大流行时主要控制策略[50],暴露后预防(Post-exposure prophylaxis,PEP)用药可预防流感发生或减轻其严重程度[51]。针对免疫抑制人群流感PEP目前证据较多的是NA抑制剂,推荐给药时间为流感暴露后48 h内。Ison等[52]的研究纳入477例HSCT(19%)和SOT(81%)患者,发现奥司他韦预防用药耐受性良好,并能降低移植患者流感发生率,保护率可达80%。Álvarez等[53]建议SOT和HSCT的患者流感PEP用药方案为奥司他韦75 mg,1次/d,疗程10 d或扎那米韦10 mg,1次/d,疗程10 d。Fontana建议HSCT和恶性血液病高风险患者使用奥司他韦75 mg,1次/d,疗程10~14 d进行PEP治疗,但同时指出广泛使用PEP的风险是出现奥司他韦耐药问题[54]。当存在可传播的耐药毒株时,PEP可促进耐药的传播,在存在耐药毒株情况下,优先治疗患者在降低大流行的发病率和病死率方面最有效,PEP的影响在很大程度上取决于治疗水平和耐药毒株的传播能力,当治疗维持在中等水平时,有限的PEP提供了一种最佳策略[55]。
随着医疗技术的发展,免疫抑制患者群体逐渐增多,免疫抑制患者是重症流感的高危人群,早期抗病毒治疗可以使免疫抑制患者缩短流感病毒脱落时间、降低病死率、减少并发症、缩短住院时间及降低抗病毒药物耐药,但免疫抑制患者流感症状不典型致早期诊断困难,从而影响了早期抗病毒治疗,因此免疫抑制患者怀疑流感病毒感染时要尽早进行病原学检测以明确诊断。免疫抑制患者NA抑制剂的选择要基于当时季节的流行优势株情况。由于免疫抑制患者病毒脱落时间延长,长时间暴露于抗病毒药物下可促进耐药变异,对于NA抑制剂耐药的免疫抑制流感患者治疗的方向包括新型抗病毒化合物、不同作用机制的药物联合抗病毒治疗、免疫调节剂应用等,但部分研究尚处于动物实验或体外试验阶段,临床效果如何尚需进一步研究。对治疗没有反应、病毒载量持续高、接触过疑似或确诊耐药病例的免疫抑制患者在使用NA抑制剂治疗流感时,应监测抗病毒药物的耐药情况。免疫抑制人群疫苗反应程度常低于免疫功能正常人群,在获得疫苗有效保护之前,接触流感患者后预防性抗病毒药物治疗可以使免疫抑制患者受益,但需警惕PEP引起的抗病毒药物耐药风险。
所有作者均声明不存在利益冲突



























