
由新型冠状病毒(2019-nCoV)引起的疫情自2019年底出现以来,至今仍在全球肆虐,并持续威胁全球的公共卫生安全和经济发展。新型冠状病毒疫苗(新冠疫苗)是预防新型冠状病毒肺炎的有效手段,但研究表明疫苗接种诱导的免疫保护效果随着时间的延长不断下降,而一些新的、免疫逃逸强的变异株不断出现,因此亟需完成加强免疫接种以提高保护力。目前我国已有基于多种技术平台的新冠疫苗获批上市,因此特撰写此新冠疫苗序贯接种策略,为2019-nCoV及其变异株的防控提供专家建议。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
由新型冠状病毒(2019-nCoV)引起的新型冠状病毒肺炎(COVID-19)大流行造成了全球公共卫生危机和难以估量的经济损失。据世界卫生组织(WHO)报道,截至2022年5月初,全球累计确诊病例超过5.1亿,导致超过624万人死亡[1]。尽管多种疫苗和治疗性药物陆续上市,但病毒在全球的传播以及不断出现的2019-nCoV变异株引起的免疫逃逸,对疫苗保护效力构成严重挑战。接种疫苗仍是防治疫情最经济有效的手段。目前,全球共有344种2019-nCoV候选疫苗,其中有31种获批上市或紧急授权使用[2]。而在我国获批上市或紧急授权使用的疫苗有7种,主要包含灭活疫苗、病毒载体疫苗以及重组蛋白疫苗三种技术路线(表1)。
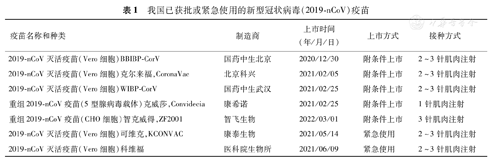
我国已获批或紧急使用的新型冠状病毒(2019-nCoV)疫苗
我国已获批或紧急使用的新型冠状病毒(2019-nCoV)疫苗
| 疫苗名称和种类 | 制造商 | 上市时间(年/月/日) | 上市方式 | 接种方式 |
|---|---|---|---|---|
| 2019-nCoV灭活疫苗(Vero细胞)BBIBP-CorV | 国药中生北京 | 2020/12/30 | 附条件上市 | 2~3针肌肉注射 |
| 2019-nCoV灭活疫苗(Vero细胞)克尔来福,CoronaVac | 北京科兴 | 2021/02/05 | 附条件上市 | 2~3针肌肉注射 |
| 2019-nCoV灭活疫苗(Vero细胞)WIBP-CorV | 国药中生武汉 | 2021/02/25 | 附条件上市 | 2~3针肌肉注射 |
| 重组2019-nCoV疫苗(5型腺病毒载体)克威莎,Convidecia | 康希诺 | 2021/02/25 | 附条件上市 | 1针肌肉注射 |
| 重组2019-nCoV疫苗(CHO细胞)智克威得,ZF2001 | 智飞生物 | 2022/03/01 | 附条件上市 | 3针肌肉注射 |
| 2019-nCoV灭活疫苗(Vero细胞)可维克,KCONVAC | 康泰生物 | 2021/05/14 | 紧急使用 | 2~3针肌肉注射 |
| 2019-nCoV灭活疫苗(Vero细胞)科维福 | 医科院生物所 | 2021/06/09 | 紧急使用 | 2~3针肌肉注射 |
截至2022年4月28日,国家卫生健康委员会统计数据显示,我国新型冠状病毒疫苗(新冠疫苗)累计接种已超33亿剂次,约12.5亿人完成常规接种;约7.5亿人完成加强免疫接种,其中,自2022年2月我国启动序贯加强免疫以来,目前已有近3 000万人完成了序贯接种[3]。研究表明疫苗接种诱导的免疫保护效果随着时间的延长不断下降[4,5],而一些新的、免疫逃逸强的突变株不断出现,因此亟需完成加强免疫接种以提高保护力。目前我国已有基于多种技术平台的新冠疫苗获批上市,因此特撰写此新冠疫苗序贯接种策略,为2019-nCoV及其变异株的防控提供专家建议。
目前国内外正在进行或已经完成众多不同疫苗组合方式以及新型疫苗的临床研究,这对于进一步优化疫苗接种策略具有重要启示。
研究显示,在完成常规接种程序后4~5个月,均观察到中和抗体滴度明显降低[4,5]。与抗体衰减相一致,突破性感染病例变得更为普遍[6]。在以色列最先开始的加强免疫研究结果表明,在完成2针BNT162b2 mRNA疫苗接种5个月后,使用第三针BNT162b2疫苗进行同源加强免疫,加强免疫组的感染率和重症率相较于对照组分别降低了11.3倍和19.5倍,60岁以上老年人的血清中和抗体水平在加强免疫后提高了57.9倍[7,8]。使用科兴灭活疫苗CoronaVac完成2针接种后8个月,再使用相同疫苗进行同源加强免疫后血清中和抗体提高了3~5倍,同时延长了抗体的持续时间并提高了针对变异株的中和抗体水平[9]。另一项在常规接种完成后5~9个月同样使用CoronaVac疫苗进行同源加强免疫的临床研究显示,高剂量组的加强免疫使针对奥密克戎(Omicron)变异株的中和抗体提高了7.7倍[10]。以上研究均表明,使用同种疫苗进行第三针加强免疫,均能显著提高中和抗体水平,并可有效降低2019-nCoV变异株的有症状感染率。
国外多项研究表明,由腺病毒载体疫苗和mRNA疫苗组成的序贯加强免疫效果优于使用单一同源疫苗的加强免疫[11,12,13]。由于灭活疫苗在我国大规模使用,基于灭活疫苗的序贯免疫研究更有借鉴意义。研究显示,两剂科兴灭活疫苗CoronaVac常规免疫后使用康希诺腺病毒载体疫苗Convidecia异源加强诱导针对野生株和德尔塔(Delta)变异株的中和抗体水平分别比同源免疫组高了5.9倍和6.8倍,安全性良好,且序贯接种后可显著激发人体的细胞免疫应答[14]。土耳其研究人员对比了接种2针灭活疫苗CoronaVac后,第三针继续接种灭活疫苗CoronaVac与选择接种BNT162b2 mRNA疫苗的抗体水平,结果显示,用mRNA疫苗进行序贯免疫诱导的抗体水平是灭活疫苗同源加强接种的14.2倍,而且可以诱导较强的细胞免疫[15]。巴西的一项临床研究表明,在2针2019-nCoV灭活疫苗的基础上,分别使用腺病毒载体疫苗和mRNA疫苗进行加强免疫,也出现了类似的结果[16]。另外两项研究表明,在灭活疫苗基础上用智飞生物的重组蛋白疫苗ZF2001加强免疫,也可以获得比同源加强免疫更高的中和抗体保护[17,18]。以上结果均表明,不同疫苗的安全性和有效性以及优缺点不同,由不同的疫苗进行序贯加强免疫往往能取长补短,取得更好的免疫保护效果[19]。
基于以上研究结果,并考虑到我国绝大部分人群已完成不同疫苗的常规接种程序,对于一般群体的加强免疫策略提出以下建议:
(1)完成正常免疫接种程序后超过6个月的人群,尽快完成加强免疫接种。
(2)对于已接种2针灭活疫苗者在考虑疫苗成本和可及性的情况下,基于目前国内可以获取使用的疫苗,优先使用不同于灭活疫苗的重组蛋白疫苗或腺病毒载体疫苗,可采用"1针蛋白亚单位+1针腺病毒载体疫苗"的序贯策略进行加强。已接种腺病毒载体5型疫苗者,可采用"2针蛋白亚单位疫苗"的方式进行加强免疫接种;未接种疫苗者可采用"2针蛋白亚单位疫苗+1针腺病毒载体5型疫苗"的方式进行加强免疫接种。
(3)对于目前处在研发阶段但尚未上市的疫苗,建议以临床研究的方式进行,逐渐推广。对于已接种疫苗者,最理想的加强免疫方式为"1针肌注mRNA疫苗+1针鼻喷腺病毒/流感病毒载体疫苗";对于未接种疫苗者,建议按照"2针肌注mRNA疫苗+1针鼻喷腺病毒/流感病毒载体疫苗"的方式进行接种。
(4)已有数据表明,利用原始株开发的疫苗对Omicron变异株的保护不如基于变异株研发的疫苗。因此,待变异株疫苗上市后,应优先考虑选择这些基于变异株免疫原开发的疫苗进行加强免疫,尤其是基于Omicron毒株开发的疫苗。
高龄是COVID-19发展为重症甚至死亡的独立危险因素。已有实验证据表明,高龄群体也可以从新冠疫苗接种中获益,因此高龄群体接种新冠疫苗有着必要性和紧迫性[20,21]。但是高龄群体常伴随各种基础疾病,加重了疫苗接种的复杂性,对疫苗接种的安全性要重点关注。目前已经上市的新冠疫苗均为肌肉注射疫苗,其不良反应主要有肌肉疼痛、发热以及极低比例的疱疹等。此外,由于老年人免疫系统的老化,对疫苗的应答弱,故建议均采用3针的接种方式,间隔可以均采用4周。
疫苗序贯接种策略建议:
(1)"肌注蛋白亚单位疫苗+鼻喷流感病毒载体疫苗"的序贯策略。考虑到蛋白亚单位疫苗与鼻喷流感病毒载体疫苗的安全性更高一些,建议有基础疾病的老年人主要采用这两种疫苗序贯的接种方式:第一、二针采用智飞的蛋白亚单位疫苗,第三针可以采用厦门大学的鼻喷流感病毒载体疫苗。这一组合优势是:安全性高,并能有效建立黏膜保护,同时激活中和抗体和细胞免疫,且对老年人流感具有潜在的保护作用。考虑到该鼻喷流感病毒载体疫苗未上市,这一方案的实施可以临床研究的方式进行,逐渐推广。
(2)"肌注mRNA疫苗+鼻喷腺病毒载体疫苗"的序贯策略。与上一策略的最大区别在于:这一策略的有效性最高,同时在呼吸道黏膜和全身建立高水平的中和抗体应答和细胞免疫应答,适合没有基础疾病的老年人接种。第一、二针可以采用丽凡达的mRNA疫苗,第三针采用康希诺的鼻喷(雾化吸入)腺病毒载体疫苗。考虑两个疫苗均未上市,这一方案的实施同样可以临床研究的方式进行,逐渐推广。
(3)"肌注蛋白亚单位疫苗+肌注腺病毒载体5型疫苗"的序贯策略。这一策略的最大优点是疫苗的可及性高,在国内均有上市。第一、二针可采用智飞的蛋白亚单位疫苗,第三针采用康希诺的肌注腺病毒载体疫苗接种。
科兴生物的2019-nCoV灭活疫苗CoronaVac在3~17岁人群中的临床试验结果显示,灭活疫苗具有良好的安全性与耐受性,接种后的抗体水平高于18岁及以上人群,并且不良事件发生率与18岁及以上人群相似,未发现疫苗相关的严重不良反应。儿童及青少年接种疫苗后的不良反应主要表现为发热、局部疼痛、红肿。目前大部分儿童及青少年已经接种两剂灭活疫苗,应尽快完成加强免疫。
疫苗接种策略建议:3~11岁儿童尚未接种疫苗的,建议开展"2针肌注mRNA疫苗+1针鼻喷腺病毒/流感病毒载体疫苗"的序贯策略的临床研究。这一方案可有效活化抗COVID-19的中和抗体和T细胞应答,并同时激活对腺病毒或者流感病毒载体本身的体液免疫和T细胞应答,因而,这一方案对预防腺病毒引起的儿童肝炎、肠炎或者流感具有潜在价值。两种鼻喷疫苗中流感病毒载体减毒较为彻底,比腺病毒载体疫苗安全性更好;但腺病毒载体疫苗免疫原性更强,产生的体液免疫和细胞免疫效果更好。因此,可以根据需要进行选择。已经接种过疫苗的儿童,建议开展"1针肌注mRNA疫苗+1针鼻喷腺病毒/流感病毒载体疫苗"加强免疫策略的临床研究。考虑到疫苗的可及性,基于目前国内已上市的疫苗,对于尚未接种疫苗的儿童,建议接种3针蛋白亚单位疫苗;已经接种了灭活疫苗的儿童,应尽快完成2针蛋白亚单位疫苗的加强接种。
免疫缺陷人群主要包括AIDS患者、实体器官移植受体以及癌症患者等,他们的免疫系统处于抑制状态,相较于普通人群对2019-nCoV的易感性更高,并且在感染病毒后其重症化与死亡的风险高于普通人群[22,23,24,25,26]。在意大利、美国以及西班牙的研究中发现,HIV-1的慢性感染不会增加患者感染2019-nCoV的概率,但会增加患者的重症率及病死率[27,28,29]。HIV-1合并2019-nCoV感染者体内2019-nCoV抗体的产生缓慢,并且在个别患者中发现2019-nCoV抗体短暂出现并迅速转阴的现象[30],这种现象可能是由于HIV患者体内免疫系统受损所致。美国在新冠疫情早期的一项研究发现,28例感染2019-nCoV的肾移植患者,3周内的病死率为28%,远高于同期美国正常人群感染2019-nCoV的病死率(1%~5%),以及70岁及以上人群感染2019-nCoV的病死率(8%~15%)[31]。有研究表明在器官移植受者中进行新冠疫苗接种可以使一部分人产生体液免疫反应,但远低于正常人群的抗体水平[32]。对于肿瘤患者,研究证明其接种新冠疫苗是安全和有效的,并在一定程度上能预防2019-nCoV变异株导致的重症,但治疗期患者对疫苗的免疫应答往往弱于缓解期患者,血液肿瘤患者一般弱于实体瘤患者[33,34,35,36]。
在以色列进行的一项针对有既往过敏史人群的前瞻性研究发现,过敏患者尤其是严重过敏患者接种BNT162b2疫苗后的过敏反应发生率高于普通人群[37],因此严重过敏患者接种新冠疫苗仍需慎重。在风湿免疫等自身免疫性疾病人群中进行的观察性研究表明,在这些人群中进行疫苗接种的安全性是可以接受的,但一些免疫抑制剂治疗会显著降低疫苗诱导的免疫保护[38,39]。
疫苗接种策略建议:
(1)免疫缺陷患者,由于免疫功能低下,肌肉接种的方式激活免疫应答弱,应尝试利用加强黏膜免疫(可利用黏膜部位抗原递呈细胞)来提升免疫应答;同时,应考虑免疫原性更强的疫苗进行接种。故建议采用老年人群的第1和第2种方案。上面已经提到,两种鼻喷载体疫苗在有效性和安全性方面各有所长,都具有能够激发黏膜免疫的特点,且对免疫低下人群具有预防腺病毒和流感病毒感染的潜在价值,建议可积极推进相关的临床研究。
(2)HIV患者应适当增加接种次数。
(3)等待接受器官移植的患者,有必要接种新冠疫苗。但是由于其特殊的免疫状态,应在器官移植前,提前接种新冠疫苗。如已经进行了器官移植,应在移植6个月后再进行新冠疫苗接种。
(4)对于肿瘤患者,应视肿瘤病种、治疗阶段和方案以及身体状况而定。处于早期或者治疗后康复期的患者可以按照老年人合并严重基础疾病的人群方案选用安全性高的疫苗进行接种;治疗期患者不建议接种;晚期患者应遵循主治医师建议决定是否接种。具体可以参见最近发表的专家意见[40]。
(5)有过敏史人群原则上应谨慎接种,但如果对相关疫苗无既往过敏史,可以在医师指导下考虑接种同类型疫苗。
(6)大部分自身免疫性疾病并不是疫苗接种的禁忌证,无论是疾病控制较好的阶段还是在接受免疫抑制治疗,均建议进行新冠疫苗接种。
由于2019-nCoV变异株在免疫压力下发生的突变越来越多,与原始株的差异越来越大,因此,如继续使用基于原始毒株的疫苗进行加强免疫,针对变异株只能产生有限的交叉免疫保护[51]。有研究表明,在原始毒株mRNA疫苗免疫的基础上,相较于同种原始毒株的加强免疫,使用基于贝塔(Beta)变异株的mRNA疫苗或者其与原始毒株mRNA疫苗的双价混合苗进行加强免疫,在小鼠以及人群中均可以诱导出更强的针对Beta变异株的中和抗体,且对部分其他变异株产生交叉保护[52,53]。在基于原始毒株灭活疫苗的基础上,使用Beta或Delta变异株的RBD疫苗进行序贯免疫,可以在小鼠上诱导出针对7种变异株的广谱中和保护[54]。另外,最近的一项研究表明,在低剂量原始毒株mRNA疫苗免疫的基础上,使用基于Omicron变异株BA.1亚型的mRNA疫苗进行序贯免疫,在小鼠上可诱导出针对BA.1和BA.2亚型更强的免疫保护[55]。
mRNA新冠疫苗具有更好的免疫效果。香港大学医学院的梁卓伟教授团队公布了一项新的研究,对所有年龄段人群来说,无论是灭活疫苗还是mRNA疫苗,都能有效预防Omicron BA.2亚型引起的重症和死亡,尤其是接种第三针后效果最佳,保护效力超过97.9%。但是在预防新冠轻度/中度症状的20~60岁人群中,两款新冠疫苗拉开了差距。研究者估算,3针mRNA疫苗对预防此类人群轻度/中度疾病的有效率是71.5%,而3针灭活疫苗有效率是42.3%。这个结果与之前研究相似,从有效防御的角度来说,mRNA疫苗更有优势。同时,mRNA疫苗具有研发周期短、生产工艺简单、成本低、易于标准化生产的特点,适用于目前新冠疫情全球大流行以及病毒经常变异的情况。
黏膜免疫是人体免疫系统的重要组成部分,成人拥有约400 m2的黏膜边界,90%以上的感染发生在人体的黏膜系统,人体80%的免疫细胞存在于此处,其中包括大量的具有很强T细胞活化能力的树突细胞,可以诱导免疫反应的发生[56,57,58]。当病原体从呼吸道黏膜入侵人体并诱导免疫应答发生后,在黏膜处会存在大量的组织驻留记忆T细胞,其可以快速消灭再次入侵的病原体[59]。临床实验结果显示,雾化吸入Convidecia疫苗可以诱导与肌肉注射疫苗相似的抗体水平,并且接种后不良反应发生率更低,同时可以诱导黏膜形成原位免疫保护,产生更好的免疫保护效果[60];AdCOVID腺病毒疫苗与ChAd36腺病毒疫苗通过鼻给药的方式在小鼠体内也可以诱导形成足够的免疫应答[61,62]。由于2019-nCoV主要通过呼吸道进行传播,因此呼吸道黏膜免疫疫苗(鼻喷/雾化疫苗)具有更强的防护效果。接种鼻喷/雾化疫苗可以更有效阻止新冠疫情的传播,是预防2019-nCoV感染和传播、遏制大流行传播的重要方式。我国有多款鼻喷疫苗正处在不同的研发阶段,如由厦门大学、香港大学、北京万泰公司联合研发的鼻喷流感病毒载体COVID-19疫苗,是在双重减毒的流感病毒载体(CA4-dNS1)基础上引入2019-nCoV S基因RBD片段制备而成的对温度敏感的复制型活病毒载体疫苗,通过鼻腔喷雾方式接种,可在呼吸道形成预防2019-nCoV入侵的第一线免疫屏障,目前正处于临床Ⅲ期。广州恩宝生物医药科技有限公司联合广州实验室、呼吸疾病国家重点实验室等开发的鼻喷腺病毒载体Omicron变异株疫苗,研究者自愿接受鼻喷疫苗的数据初步显示具有良好的安全性,在灭活疫苗接种基础上进行序贯免疫可诱导人体产生有效的体液免疫、细胞免疫,以及呼吸道特异性黏膜免疫。
研究表明新冠疫苗产生的体液免疫针对变异株的保护作用下降,是变异株发生突破性感染的重要原因之一;但疫苗接种后产生的细胞免疫针对变异株的保护可维持较好的广谱性和持久性,是降低重症和死亡的关键因素。针对2019-nCoV的通用保守序列T细胞疫苗的加强针接种策略可以大大增强接种者的特异性T细胞免疫应答,针对所有变异株可产生保护,是一种通用型新冠疫苗接种策略。目前正在进行临床研究的Ii-Key-SARS-CoV-2多肽疫苗是其中具有前景的新型T细胞疫苗。"Ii-key"技术疫苗本质上是"抗原肽-MHC复合物",表位设计针对人类的MHC分子,可以绕过通常的细胞内抗原处理机制,直接将抗原提呈到细胞表面,显著增加了MHC II类分子的载量和呈递能力。不仅能够快速发挥作用,而且也避免了"抗原呈递细胞对抗原消化加工"造成抗原的变化脱靶和毒副作用。与传统疫苗相比,这种疫苗可提高500~2 000倍抗原呈递效率,可以将T细胞免疫应答提高250倍以上。
佐剂作为疫苗的一部分,具有呈递抗原并刺激免疫应答的作用。尤其是灭活疫苗和蛋白亚单位疫苗的免疫原性较弱,更需要使用强力的佐剂来提高其免疫保护效力。然而新型佐剂的研发对于我国仍旧是一个短板,绝大部分疫苗企业仍在使用传统的铝佐剂。目前已经被FDA批准使用的有AS01、AS03、AS04、CpG ODN和MF59,这些佐剂在提高疫苗免疫原性方面显著优于铝佐剂[63]。在新型的mRNA疫苗中,包裹mRNA进入细胞的LNP本身就是一种佐剂。因此优化LNP的构成,以便更有效地递呈mRNA分子,也是未来的一个研究方向。鼻喷或者雾化吸入方式接种疫苗在预防呼吸道传染病上具有优势,但目前还缺乏有效的黏膜佐剂,这也是未来需要解决的问题。
疫苗接种后的不良反应主要包括发热、注射部位红肿疼痛、疲劳、皮疹、食欲减退,以及由过敏导致的休克、喉头水肿等,严重时可致死亡。新冠疫苗研发周期短,属于紧急授权上市使用的药物,大规模接种后时有不良反应发生。辉瑞公司生产的mRNA疫苗出现了严重的过敏反应[64],阿斯利康与强生公司生产的腺病毒载体疫苗出现了血栓反应,并且出现了死亡事件[65,66,67]。国内生产的相关疫苗至今没有出现威胁生命的严重不良反应事件。建议根据自身的免疫状况选择疫苗的种类,灭活疫苗的不良反应率比mRNA疫苗的低,黏膜免疫疫苗的不良反应率比肌肉注射疫苗的低。若担心接种新冠疫苗产生不良反应,可以选择灭活疫苗或者黏膜免疫疫苗。
基于目前上市的新冠疫苗种类和处在临床中的各类新冠疫苗,以及临床研究获得的免疫效力数据,对于普通人群,建议在进行新冠疫苗免疫或者加强免疫时,遵循优先选用免疫原性强的疫苗,且不同技术路线的疫苗相结合以及不同变异株的疫苗相结合的总体原则,以获得更强、更广谱、更持久的免疫保护。对于特殊人群,则要在保证安全性的前提下,根据不同的情况,选用合适的免疫策略进行疫苗接种,具体见表2。
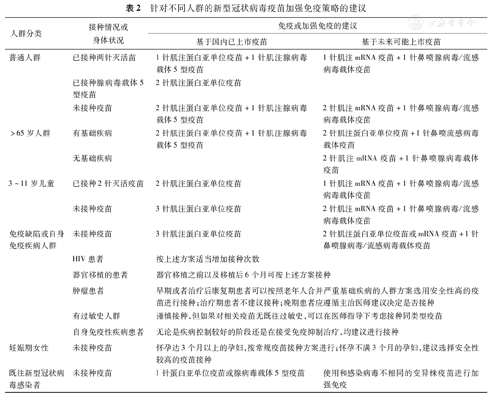
针对不同人群的新型冠状病毒疫苗加强免疫策略的建议
针对不同人群的新型冠状病毒疫苗加强免疫策略的建议
| 人群分类 | 接种情况或身体状况 | 免疫或加强免疫的建议 | |
|---|---|---|---|
| 基于国内已上市疫苗 | 基于未来可能上市疫苗 | ||
| 普通人群 | 已接种两针灭活苗 | 1针肌注蛋白亚单位疫苗+1针肌注腺病毒载体5型疫苗 | 1针肌注mRNA疫苗+1针鼻喷腺病毒/流感病毒载体疫苗 |
| 已接种腺病毒载体5型疫苗 | 2针肌注蛋白亚单位疫苗 | ||
| 未接种疫苗 | 2针肌注蛋白亚单位疫苗+1针肌注腺病毒载体5型疫苗 | 2针肌注mRNA疫苗+1针鼻喷腺病毒/流感病毒载体疫苗 | |
| >65岁人群 | 有基础疾病 | 2针肌注蛋白亚单位疫苗+1针肌注腺病毒载体5型疫苗 | 2针肌注蛋白亚单位疫苗+1针鼻喷流感病毒载体疫苗 |
| 无基础疾病 | 2针肌注mRNA疫苗+1针鼻喷腺病毒载体疫苗 | ||
| 3~11岁儿童 | 已接种2针灭活疫苗 | 2针肌注蛋白亚单位疫苗 | 1针肌注mRNA疫苗+1针鼻喷腺病毒/流感病毒载体疫苗 |
| 未接种疫苗 | 3针肌注蛋白亚单位疫苗 | 2针肌注mRNA疫苗+1针鼻喷腺病毒/流感病毒载体疫苗 | |
| 免疫缺陷或自身免疫疾病人群 | 未接种疫苗 | 3针肌注蛋白亚单位疫苗 | 2针肌注蛋白亚单位疫苗或mRNA疫苗+1针鼻喷腺病毒/流感病毒载体疫苗 |
| HIV患者 | 按上述方案适当增加接种次数 | ||
| 器官移植的患者 | 器官移植之前以及移植后6个月可按上述方案接种 | ||
| 肿瘤患者 | 早期或者治疗后康复期患者可以按照老年人合并严重基础疾病的人群方案选用安全性高的疫苗进行接种;治疗期患者不建议接种;晚期患者应遵循主治医师建议决定是否接种 | ||
| 有过敏史人群 | 谨慎接种,但如果对相关疫苗无既往过敏史,可以在医师指导下考虑接种同类型疫苗 | ||
| 自身免疫性疾病患者 | 无论是疾病控制较好的阶段还是在接受免疫抑制治疗,均建议进行接种 | ||
| 妊娠期女性 | 未接种疫苗 | 怀孕达3个月以上的孕妇,按常规疫苗接种方案进行;怀孕不满3个月的孕妇,建议选择安全性较高的疫苗接种 | |
| 既往新型冠状病毒感染者 | 未接种疫苗 | 1针蛋白亚单位疫苗或腺病毒载体5型疫苗 | 使用和感染病毒不相同的变异株疫苗进行加强免疫 |
鉴于新型疫苗和新技术在防控新冠疫情中的优势和潜力,我们建议:在保证安全和有效性的前提下,加快推进我国本土mRNA疫苗、针对Omicron或其他新型变异株疫苗以及多价或广谱疫苗的研发和审批,重点支持鼻喷或雾化吸入等可以激发黏膜免疫接种方式的疫苗尽快上市使用,加大对T细胞疫苗研究的投入,开发新型佐剂,探索不同免疫加强策略的免疫保护效果以及合适的加强免疫剂量,深入研究不同疫苗的不良反应并设计科学的应对措施。在将来具有更多选择的情况下,优先选用具备以上特点的疫苗进行序贯加强免疫。
所有作者均声明不存在利益冲突



























