
近年来,免疫检查点抑制剂(ICI)尤其是程序性死亡受体1(PD-1)抑制剂在肿瘤免疫治疗中得到了广泛的运用,但其导致的免疫相关不良事件的报道也逐渐增加,其中ICI相关心肌炎发病率虽然低,但病情进展迅速且病死率高,因此备受关注。该文报道1例危重型PD-1抑制剂相关心肌炎患者经积极救治后痊愈。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
患者女,60岁,因“乏力、气促4 d”于2021年8月4日入院。患者4 d前无明显诱因出现乏力,起初主要表现为眼睑下垂,进而出现四肢乏力,需他人搀扶才可行走,伴有胸闷、气促,无头晕、头痛、视物模糊、口角歪斜、发热、咳嗽、咳痰、咯血等不适,至当地医院就诊,考虑为营养不良性疾病,未予特殊处理。但患者症状进行性加重,遂来我院急诊就诊。心电图示:窦性心律,频发室性早搏,短阵室性心动过速,ST-T改变。实验室检查:肌钙蛋白I(cTnI)4.000 mg/L(参考值0.010~0.023 mg/L),肌酸激酶同工酶(CK-MB)625 U/L(参考值3~25 U/L),肌酸激酶(CK)24 196 U/L(参考值26~174 U/L),N末端B型利钠肽原(NT-proBNP)5 240 ng/ml(参考值300~900 ng/ml),丙氨酸氨基转移酶(ALT)916 U/L(参考值7~40 U/L),天门冬氨酸氨基转移酶(AST)1 295 U/L(参考值13~35 U/L)。血常规:白细胞计数15.5×109/L,中性粒细胞比例88.73%,淋巴细胞比例8.12%,血小板219×109/L,红细胞计数4.63×1012/L,血红蛋白144.1 g/L。电解质:钠125.2 mmol/L,钾4.4 mmol/L,氯90.6 mmol/L。拟诊为急性非ST段抬高型心肌梗死?急诊行冠状动脉造影,未见明显异常。患者否认高血压、糖尿病、冠心病、肝炎、自身免疫性疾病病史,个人史、婚育史及家族史无特殊。2018年行“胆囊切除+胆总管囊肿切除+腹腔肿物切除活检+胆肠吻合术”,术后病理提示胆管癌(中分化),并于2018年9月至2019年3月期间进行8次化疗(化疗方案:吉西他滨联合替吉奥)。2021年6月患者复诊期间上腹部核磁共振提示胰腺新增占位,考虑转移瘤,遂于6月22采取“吉西他滨+奥沙利铂+替吉奥+卡瑞丽珠单抗”方案进行治疗,7月14日改为“吉西他滨+替吉奥+信迪利单抗”方案。
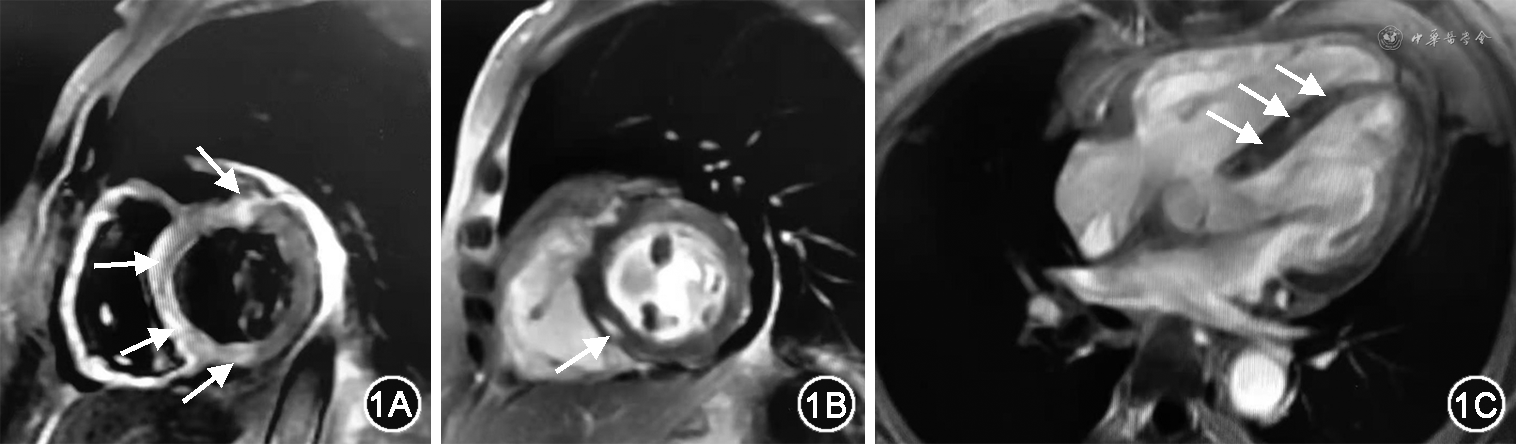
入院体格检查:体温36.2 ℃,心率103 次/min,呼吸20 次/min,血压100/69 mmHg(1 mmHg=0.133 kPa),神清,双侧眼睑下垂,左侧明显。双肺呼吸音清,未闻及干湿啰音。心律齐整,各瓣膜听诊区未闻及病理性杂音。腹部皮肤见手术瘢痕,双下肢无水肿,双下肢肌力4+级。实验室检查(2021-08-05):cTnI 2.200 mg/L,CK-MB 595 U/L,CK 20 313 U/L,NT-proBNP 6 580 ng/ml,ALT 950 U/L,AST 1 176 U/L,凝血功能、血沉、甲状腺功能、肝炎系列抗体未见明显异常,肌炎相关自身抗体(抗ANA抗体、抗ScL-70抗体、抗PM-ScL抗体、抗SSA抗体、抗SSB抗体)阴性,肌炎特异性自身抗体(抗Jo-1抗体)阴性。胸部CT:双肺散在渗出,心脏增大。肌电图:双侧尺神经、左侧腋神经、双侧副神经、双侧面神经低频(3 Hz)重复电刺激试验阴性,右侧腋神经低频(3 Hz)重复电刺激试验可疑阳性,左侧三角肌肌电图未见明显异常。超声心动图:心脏结构未见明显异常,室壁运动普遍减低,左心室射血分数(LVEF)34%。心脏磁共振(图1):左心室室间隔及毗邻前壁、下壁心肌组织T2压脂序列信号增强,考虑心肌水肿;左心室室间隔及毗邻前壁肌壁间见条片状及斑片状延迟强化。结合病史特点,且近期有PD-1抑制剂使用史,考虑“药物性心肌炎:免疫检查点抑制剂(immune checkpoint inhibitors,ICI)相关心肌炎可能性大”。

入院后患者血压降至80/46 mmHg,给予多巴胺(3 μg·kg-1·min-1)治疗后血压维持在90~100/50~68 mmHg,心电监护提示频发室性期前收缩(室早)、短阵性室性心动过速(室速),予维持电解质平衡、抗心律失常药物(胺碘酮、艾司洛尔、尼非卡兰)治疗效果不佳,并发生多次持续性室速、尖端扭转型室速,多次行电复律可转律,并继续予艾司洛尔抗心律失常治疗。住院过程中患者出现咳嗽、咳痰,并出现双肺呼吸音增粗,双肺底闻及湿啰音。多学科会诊后考虑PD-1抑制剂相关急性心肌炎(危重型)、急性肝损伤、肌炎,自2021年8月5日起连续3 d予以甲基强的松龙1 g/d 静脉滴注,并予以护肝、抗感染、保护胃黏膜、营养支持治疗,患者症状缓解,复查cTnI、CK、CK-MB、ALT、AST等实验室指标均较前下降。2021年8月8日将激素减量为0.12 g/d(连用5 d),并联合吗替麦考酚酯0.5 g(每12 h)及免疫球蛋白10 g/d(连用4 d)进行治疗。2021年8月9日复查超声心动图:室壁运动普遍减低,LVEF 37%。当天开始予以沙库巴曲缬沙坦50 mg(每日2次)抗心力衰竭(心衰)治疗。2021年8月13日将激素减量为0.06 g/d(连用7 d)。8月16日复查实验室指标均接近正常范围,超声心动图示室壁运动良好,LVEF 61%。患者未再发生恶性心律失常事件。后期将激素改为口服并逐渐减量,继续给予沙库巴曲缬沙坦、呋塞米、螺内酯、琥珀酸美托洛尔抗心衰治疗。患者症状好转出院。门诊随访期间患者一般状况良好,各项实验室指标未见明显异常。激素逐渐减量至停药,并继续维持3个月抗心衰治疗。
ICI开启了肿瘤免疫治疗的新纪元,目前以PD-1抑制剂、PD-L1抑制剂、细胞毒性T淋巴细胞相关抗原4(CTLA-4)抑制剂为代表的ICI已经被广泛应用于肿瘤患者并取得了良好的疗效。ICI可抑制肿瘤细胞的免疫逃逸,增强T淋巴细胞的免疫应答,发挥了良好的抗肿瘤作用,但是与此同时其也可破坏机体自身免疫耐受,引起免疫相关不良事件(immune-related adverse events,irAE)[1]。ICI相关的不良反应可累及全身各个器官和系统,以内分泌腺体、皮肤、胃肠道、肌肉受累最为常见,累及心脏的机率较小,有研究显示PD-1抑制剂心脏毒性事件发生率在1%以下[2]。而ICI相关心肌炎占所有ICI相关心脏不良反应的50.8%[3],且其病死率极高。
ICI相关心肌炎的发病机制尚不明确,大部分学者认为可能与自身免疫耐受异常、心肌细胞和肿瘤细胞存在同源抗原有关[4]。相较于其他irAE,ICI相关心肌炎出现较早,多发生在首次给药后30 d左右[5]。ICI相关心肌炎可单独或同时与心衰、各种类型的心律失常、心肌/心包炎、心肌病和心脏猝死等同时出现。合并其他心血管疾病临床表型的ICI相关心肌炎患者往往病情较重,且出现较早。严重的心律失常是导致患者死亡的常见原因。2016年Johnson等[6]报道了2例ICI相关心肌炎合并心律失常的患者,一例因难治性室速死亡,另一例因完全性房室传导阻滞死亡。本例患者发生了电风暴,并且合并心衰、肝功能损害,使病情变得更加危重、复杂,增加了治疗难度和死亡风险。
关于ICI相关心肌炎的治疗,由于尚缺乏前瞻性研究,仍以经验性治疗为主,治疗方案需根据其临床分型及评级制定。对于无症状稳定的亚临床心肌损伤患者临床密切监测即可。对于重症及危重症的患者,需采取综合治疗模式。一方面是针对病因的治疗,其中糖皮质激素是治疗重症型和危重型心肌炎患者的核心药物,早期、大剂量使用激素是治疗的关键。研究表明早期、大剂量的糖皮质激素使用可降低患者主要不良心血管事件风险[5]。目前共识推荐静脉注射甲基强的松龙(1 g/d)冲击治疗3~5 d,病情缓解后改为1~2 mg·kg-1·d-1[7]。另外,免疫调节药物在危重的ICI相关心肌炎治疗中也发挥了重要作用。NCCN指南指出危重型心肌炎患者接受糖皮质激素冲击治疗24 h若无改善,可考虑使用吗替麦考酚酯或血浆置换进行免疫抑制治疗[8]。另一方面,针对使用大剂量激素可能导致的诸多不良反应,密切监测及预防性治疗可明显降低严重不良反应的发生风险。同时对于合并心律失常、心衰等其他心血管疾病的ICI相关心肌炎患者积极进行对症支持治疗也至关重要。2020年我国学者报道了一例合并难治性室速及心原性休克的ICI相关心肌炎患者,经过积极的病因治疗、抗心律失常治疗、体外膜肺氧合支持等综合治疗后患者救治成功[9]。
本例患者属于危重型ICI相关心肌炎,短期大剂量糖皮质激素治疗为首选治疗。经过早期大剂量激素冲击治疗,患者的心脏生物标志物、肝功能指标明显改善。但是考虑到本例患者存在肺部感染,使用大剂量糖皮质激素可能导致感染加重且消化道出血风险增加,因此在连续3 d使用大剂量激素后即减量,同时予以抗感染及抑酸护胃治疗。目前关于激素使用及剂量调整尚无明确方案,需根据患者的个体情况进行调整。另外,共识也明确指出若ICI相关心肌炎危重型患者糖皮质激素冲击治疗效果不佳,可增加1~2类甚至3类其他药物(1种化学药物+1~2种生物制剂+免疫球蛋白)进行治疗[7]。对于此类患者早期联合其他免疫治疗可能会效果更好。本例患者在激素减量后,联用了吗替麦考酚酯、免疫球蛋白进行免疫治疗,取得了良好疗效。
在本例患者的诊疗过程中,我们发现使用短期激素及其他免疫治疗药物后,患者的酶学指标虽然下降,但心功能改善并不明显,为什么会出现这种现象?我们认为患者的酶学指标好转提示体内免疫炎症反应得到了一定的控制,但由于其导致功能障碍的心肌组织受累范围大,功能修复需要一定时间;并且激素减量过早可能导致心肌细胞对激素及免疫药物的反应差,从而造成心衰时间延长;另外,患者本身合并感染、ICI相关肝损伤,进一步加重了心脏的负担。此时,血浆置换似乎是另外一种治疗方案,但是考虑到患者血流动力学不稳定,进行血浆置换风险大,因此未进行血浆置换。在心衰治疗方面,除了使用传统的螺内酯、呋塞米等药物之外,我们还予以沙库巴曲缬沙坦治疗。目前关于沙库巴曲缬沙坦治疗ICI相关心肌炎所致的射血分数降低的心衰疗效如何尚不清楚。本患者联合沙库巴曲缬沙坦治疗1周后心功能明显好转,LVEF恢复至61%,推测沙库巴曲缬沙坦主要通过抗炎效应及抑制肾素-血管紧张素-醛固酮系统发挥作用,这需要进一步证实。
此外,由于本例患者同时合并了ICI相关肝损伤,护肝治疗是个值得探讨的问题。由于ICI相关肝损伤的病理基础——免疫炎症反应,与ICI相关心肌炎相同,因此使用激素以及免疫抑制剂对因治疗,二者疗效有重叠。关于ICI相关肝损伤的激素使用,共识指出需依据肝损伤严重程度分级,对于最严重的4级肝损伤激素推荐用量为2 mg·kg-1·d-1[10],这远少于危重型ICI相关心肌炎的激素用量。本例患者在大剂量激素以及吗替麦考酚酯、免疫球蛋白治疗的背景下,其他护肝治疗可否省略?目前的指南和共识鲜有提及。本例患者我们给予了常规的护肝药物治疗。
总之,随着肿瘤免疫治疗的发展,将会有更多的肿瘤患者采用ICI治疗,而ICI相关心肌炎也会更为常见。早期识别、诊断、治疗是改善此类患者预后的关键,临床上应予以重视。
所有作者声明无利益冲突



























