
颈静脉孔区副神经节瘤(即颈静脉球瘤)起源于颈静脉球血管外膜的神经嵴细胞,其起病隐匿,临床症状不典型,早期易被忽视。病变可累及中耳、外耳道、面神经、颈静脉球、后组颅神经、颈内动脉甚至颅内,并引起相应临床症状。影像学检查以及SDHx相关基因检测对疾病的诊断和治疗方案的确立至关重要。处理策略包括随访观察、手术切除及立体定向放射治疗。治疗方案的制定需根据患者年龄、病变范围、全身情况及患者意愿等多方面综合考虑,制定个体化治疗方案,其手术治疗是耳鼻咽喉头颈外科领域最具挑战性手术之一。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经全国继续医学教育委员会批准,本刊开设继教专栏,每年从第1期至第12期共刊发10篇继教文章,文后附5道选择题,读者阅读后可扫描标签二维码答题,每篇可免费获得Ⅱ类继教学分0.5分,全年最多可获5分。
颈静脉球顶部血管外膜存在类似颈动脉体化学感受器的血管结构,称为颈静脉球体(glomus jugularis),颈静脉孔区副神经节瘤起源于颈静脉球副交感神经系统化学感受器副神经节的嵴细胞。这类嵴细胞也可分布于舌咽神经鼓室支(Jacobson神经)及迷走神经耳支(Arnold神经)的走行区。起源于鼓室的副神经节瘤称为鼓室体瘤。若起源于迷走神经,即为迷走神经副神经节瘤[1]。
颈静脉孔区副神经节瘤约占所有头颈肿瘤的6‰,好发于40~50岁人群,女性发病率约为男性的2~3倍。10%~20%的颈静脉孔区副神经节瘤表现为多发性,可双侧发病或同时伴有颈动脉体瘤、肾上腺嗜铬细胞瘤[2]。颈静脉孔区副神经节瘤多为良性,2%~5%有远处转移倾向,转移部位包括颈淋巴结、肝、肺、骨等[3, 4, 5]。
听力下降、搏动性耳鸣为最常见的症状,大约70%的颈静脉孔区副神经节瘤患者主诉搏动性耳鸣。其他症状包括耳闷胀感,面神经受累可出现患侧面神经麻痹。后组颅神经Ⅸ、Ⅹ、Ⅺ受累可出现颈静脉孔综合征,表现为软腭麻痹、声带固定、咽部感觉减退,引起呛咳、声嘶,饮食鼻腔反流;患侧耸肩无力,胸锁乳突肌、斜方肌麻痹等症状;瘤体压迫后内下的Ⅻ颅神经可出现伸舌偏斜,患侧舌肌萎缩。肿瘤累及外耳道可导致外耳道深部胆脂瘤形成,合并感染时患者表现为流脓性或脓血性液体,甚至耳部疼痛。作者团队的一项回顾性研究表明,颈静脉孔区肿瘤的症状,最常见的是听力下降(92.3%),其次是耳溢液(82.7%),其他常见症状为搏动性耳鸣(67.3%)、面神经麻痹(43.4%)、后组颅神经症状(13.5%)[6]。1%~3%的颈静脉孔区副神经节瘤为功能性肿瘤,可分泌儿茶酚胺如肾上腺素、去甲肾上腺素、多巴胺等,引起血压升高、头痛、心悸、出汗等[7]。
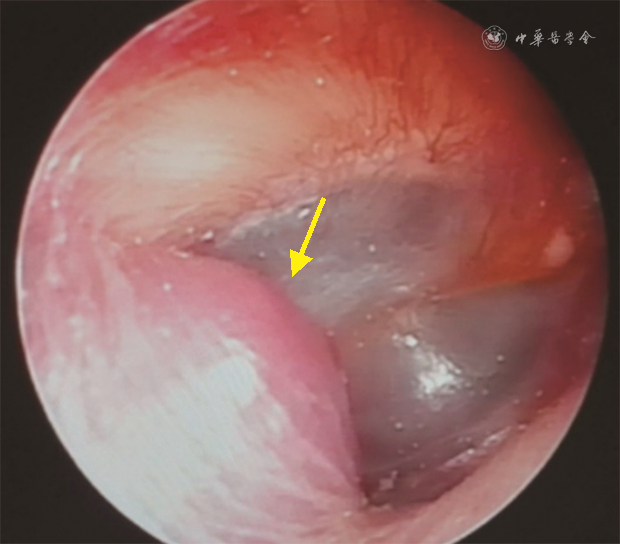
体检可发现位于完整鼓膜后方的樱桃红色搏动性新生物,新生物可突破鼓膜进入外耳道,表现为外耳道新生物(图1)。颈静脉孔区其他类型肿瘤也可在鼓膜后方或外耳道形成新生物,然而由于血供没有副神经节瘤丰富,其外观颜色不如副神经节瘤鲜红。由于肿瘤多侵犯或压迫邻近骨质或颅神经,颅神经损伤常为主要表现。颅神经损伤的出现次序和损伤程度与肿瘤位置和起源有关,如肿瘤向后上发展累及面神经可导致口角歪斜,闭眼欠佳,Ⅸ~Ⅺ颅神经受损可出现颈静脉孔综合征,病变扩大累及Ⅻ颅神经可能会出现患侧舌肌萎缩。

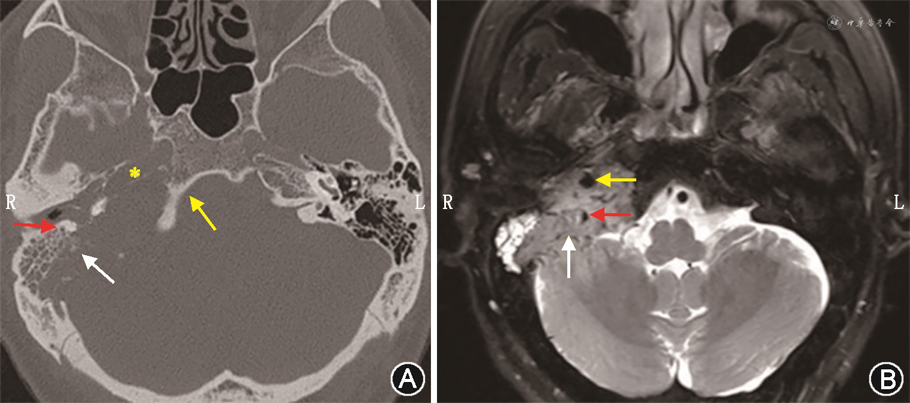
常规的辅助检查包括听力测试、颞骨高分辨CT、MRI、磁共振血管成像(magnetic resonance angiography,MRA)和磁共振静脉成像(magnetic resonance venography,MRV)、数字减影血管造影(digital subtraction angiography,DSA)、血生化检查等。依据病变侵犯结构和程度的不同,听力下降可表现为传导性听力损失、感音神经性听力损失或混合性听力损失等。影像学检查对肿瘤的定位,定性非常重要。颞骨高分辨CT扫描,可显示颈静脉孔扩大、周围骨质边缘呈现不规则蚕蚀样改变。应特别关注肿瘤累及面神经骨管、颈内动脉骨管、舌下神经管的程度(图2A);副神经节瘤具有极其丰富的血管结构,高流速血管在MRI上表现为流空低信号,慢流速血管表现为高信号、斑点,再加上肿瘤实质信号,形成所谓的“胡椒盐”征(图2B),是其特征性表现;增强MRI应特别关注肿瘤与颈内动脉、椎动脉的关系,对于向前方生长的肿瘤,颈内动脉可能被推压或包绕。另外,大多数颈静脉孔区副神经节瘤可侵入颈静脉球内,并沿乙状窦向上生长,向下沿颈内静脉生长。了解肿瘤在乙状窦及颈内静脉中的位置,有助于术者确定乙状窦填塞位置及颈内静脉结扎部位。颈静脉孔区副神经节瘤与颈静脉球、颈内动脉关系密切,建议常规行磁共振无对比剂血管成像技术(MRA、MRV)检查。MRA可以评估肿瘤血液供应及其附近的动脉分布,颈内动脉可能被包绕,被肿瘤组织压迫狭窄;MRV可以明确乙状窦、颈静脉球、颈内静脉是否通畅或被阻塞,以及对侧乙状窦、颈静脉球、颈内静脉是否优势引流。一旦优势侧乙状窦、颈静脉球、颈内静脉被阻断,对侧侧支循环开放不足可导致静脉相关性颅内高压。DSA可了解肿瘤血供,评估异常血管团的范围、供血动脉、回流静脉等信息,清晰显示血管变异情况,并能动态显示病灶血流动力。颈内动脉球囊闭塞实验可以评估动脉被阻断后脑组织的耐受性,判断患者是否可以耐受动脉闭塞治疗,明确颈内动脉损伤后结扎的可行性。术前可行供血动脉栓塞,以减少术中出血。

尽管只有4%患者的颈静脉孔区副神经节瘤具有神经内分泌功能即嗜咯性或功能性副神经瘤,一旦考虑手术,还是应该常规检测血清儿茶酚胺水平,常规可检测血变肾上腺素和血去甲变肾上腺素,以避免术中出现恶性高血压。
副神经节瘤可分为散发型和家族遗传型,家族遗传型主要有4种表型,均与编码琥珀酸脱氢酶(succinate dehydrogenase,SDH)基因有关,统称为SDHx基因,包含SDHD、SDHAF2、SDHC、SDHB四种亚型[8]。高志强教授团队发现SDHD突变在中国人群副神经节瘤患者中具有创建者效应[9]。SDHB基因突变携带者的全身转移的概率增加[10]。VHL、SDHA、TMEM127、RET、NF1等基因突变也被证实与头颈部副神经节瘤相关,但相对罕见。SDHx突变基因携带者相比无突变的患者更年轻,多发病变及恶性转移概率更高[11]。临床上对初次确诊副神经节瘤的患者及时进行SDHx基因突变检测,对患者管理、临床预后、生存率均有相当积极的影响[12]。
颈静脉孔区副神经节瘤外观呈红色不规则团块状。显微镜下肿瘤细胞呈多形性,胞质丰富,内含嗜酸性颗粒,细胞核深染,核分裂象少见,肿瘤细胞周围被富含血管的纤维结缔组织穿插包绕[13, 14]。
根据病变范围及重要结构受累程度的不同,多位学者提出颞骨副神经节瘤的临床分型,其中以1981年Fisch等[15]提出的颞骨副神经节瘤分型被广泛应用,其大体分为4型(表1)。

Fisch颈静脉球副神经节瘤分型[15]
Fisch颈静脉球副神经节瘤分型[15]
| 类型 | 肿瘤部位 |
|---|---|
A B C1 C2 C3 C4 De1 De2 Di1 Di2 | 局限于鼓室内 瘤体位于鼓室乳突内,但未累及骨迷路 肿瘤累及颈静脉孔、颈静脉球、颈动脉管垂直段 肿瘤累及骨迷路及颈动脉管垂直段 肿瘤累及骨迷路、岩尖部及颈动脉管水平段 肿瘤累及破裂孔及海绵窦 瘤体侵入颅内,但未突破硬脑膜,范围≤2 cm 瘤体侵入颅内,但未突破硬脑膜,范围>2 cm 瘤体侵入颅内并突破硬脑膜,范围≤2 cm 瘤体侵入颅内并突破硬脑膜,范围>2 cm |
笔者团队根据颈静脉孔副神经节瘤生长方式及是否累及岩下窦,提出球内生长型和球外生长型的分型。大多数肿瘤向颈静脉球腔内生长,颈静脉球内充满肿瘤并阻塞岩下窦,我们将其命名为球内生长型;肿瘤以球腔外生长为主,岩下窦呈开放状态,颈静脉球为血液充盈,我们将其命名为球外生长型。球外生长型肿瘤可采取乙状窦隧道填塞法控制岩下窦的出血;球内生长型肿瘤可采用推压法控制岩下窦出血[16]。
颈静脉孔区副神经节瘤需与原发于颈静脉孔区的肿瘤以及起源于邻近结构累及颈静脉孔区的肿瘤进行鉴别。其他原发于颈静脉孔区的肿瘤包括神经鞘瘤、脑膜瘤、软骨肉瘤等,起源于邻近结构累及颈静脉孔区的肿瘤包括颞骨恶性肿瘤、胆脂瘤、胆固醇肉芽肿等。本文主要对原发于颈静脉孔区的肿瘤进行说明。
1.神经鞘瘤:颈静脉孔区神经鞘瘤起源于后组颅神经(Ⅸ、Ⅹ、Ⅺ)的神经上皮及神经鞘膜的雪旺细胞,在颈静脉孔区肿瘤中的发病率仅次于副神经节瘤,占所有颅内神经鞘瘤的2.9%~4%[17],占颈静脉孔区肿瘤的10%~30%,以女性多见,年龄多在40岁左右[18]。颈静脉孔神经鞘瘤根据肿瘤起源、肿瘤大小、生长方向等因素具有不同的临床表现,颅神经麻痹最常见,如吞咽困难、饮水呛咳、声音嘶哑、伸舌向一侧偏斜、构音障碍、耸肩困难等,肿瘤较大时可累及面听神经,可伴有耳鸣、眩晕、听力障碍及不同程度的面神经麻痹。
神经鞘瘤是膨胀性生长的肿瘤,血供较副神经节瘤差,瘤内可有大小不等的囊变区,颞骨CT平扫示颈静脉孔扩大,边缘骨质光滑完整(图3A);颞骨MRI检查在T1WI上肿瘤呈等或稍低信号,边界清楚,病灶内囊变区呈更低信号,T2WI呈高信号或信号不均匀,增强MRI可见肿瘤不同程度增强。增强后瘤体中央囊变明显者表现为环状或蛋壳样强化,囊变不明显者表现为均匀或不均匀强化。由于肿瘤起源于颈静脉球内侧壁深面,增强后可见肿瘤将颈静脉球向后上方推压,同时将上颈部的颈内动脉向前内侧推压(图3B)。
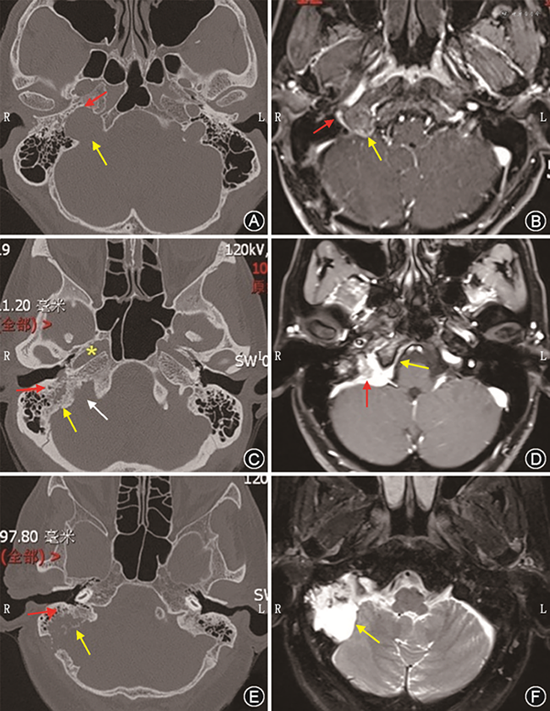

2.脑膜瘤:颈静脉孔区脑膜瘤主要起源于颈静脉孔区蛛网膜绒毛细胞,发生率占颈静脉孔区肿瘤的5.3%,仅次于副神经节瘤、神经鞘瘤,该部位脑膜瘤生长缓慢,但与副神经节瘤相比易复发。颞骨CT可表现为颈静脉孔骨质被肿瘤侵蚀破坏,同时可有骨质增生(图3C);MRI表现为T1WI在血管丰富时高信号,纤维组织丰富时等或低信号,增强后见肿瘤明显均匀强化,同时可见脑膜尾征,多数肿瘤呈匍匐状生长,常紧贴颅骨、硬脑膜,基底较宽,颅外部分可环绕颈动脉鞘生长(图3D);DSA检查有助于了解周围血供情况,对于排除副神经节瘤很有帮助,但常无法区别脑膜瘤和神经鞘瘤,术前明确颈静脉孔是否闭塞对于手术操作有重要的意义。
3.软骨肉瘤:颈静脉孔区的软骨肉瘤无明显特异性临床表现,其症状取决于肿瘤生长方向、体积、压迫临近神经血管结构及性质。回顾性研究表明,患者初次就诊时最常见的主诉依次为面神经麻痹(80%)、听力下降(60%)、耳鸣(60%)以及眩晕(20%)[19]。
颈静脉孔区软骨肉瘤在高分辨CT上表现为颈静脉孔边缘骨质不规则破坏,病灶内可出现钙化斑(图3E),为颈静脉孔软骨肉瘤特征性表现,在诊断上有重要指导意义;在MRI T1WI序列为等信号,T2WI序列为高信号,增强后强化不均匀(图3F)[20]。我们的一项回顾性研究中,所有病例均出现病灶钙化斑,这有助于与面神经瘤进行鉴别诊断,面神经瘤也可侵及颈静脉孔及腮腺深叶,但病灶中无钙化斑[19]。
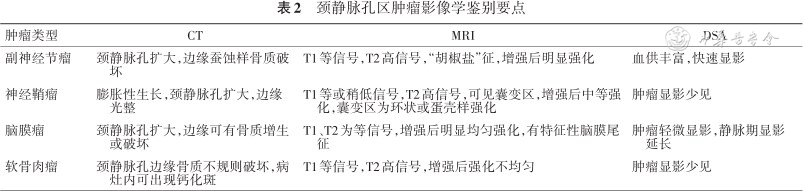
颈静脉孔区肿瘤影像学鉴别要点
颈静脉孔区肿瘤影像学鉴别要点
| 肿瘤类型 | CT | MRI | DSA |
|---|---|---|---|
| 副神经节瘤 | 颈静脉孔扩大,边缘蚕蚀样骨质破坏 | T1等信号,T2高信号,“胡椒盐”征,增强后明显强化 | 血供丰富,快速显影 |
| 神经鞘瘤 | 膨胀性生长,颈静脉孔扩大,边缘光整 | T1等或稍低信号,T2高信号,可见囊变区,增强后中等强化,囊变区为环状或蛋壳样强化 | 肿瘤显影少见 |
| 脑膜瘤 | 颈静脉孔扩大,边缘可有骨质增生或破坏 | T1、T2为等信号,增强后明显均匀强化,有特征性脑膜尾征 | 肿瘤轻微显影,静脉期显影延长 |
| 软骨肉瘤 | 颈静脉孔边缘骨质不规则破坏,病灶内可出现钙化斑 | T1等信号,T2高信号,增强后强化不均匀 | 肿瘤显影少见 |
颈静脉孔区副神经节瘤的治疗策略包括:观察随访,手术切除,放射治疗。
1.随访观察:副神经节瘤为良性肿瘤,生长缓慢(0.8~0.9 mm/年)。对于肿瘤较小无症状者可以根据患者意愿采取保守观察策略。然而有研究认为,肿瘤的生长速度同患者年龄呈负相关,即年轻患者肿瘤生长较快,而老年患者肿瘤生长速度较慢[21]。考虑年轻患者的期望寿命较长,肿瘤生长速度较快,故纳入随访观察时应谨慎,且随访期间患者需时刻承受带瘤生存的心理压力、长期影像学随访的经济负担以及肿瘤增大后导致并发症的可能。年龄较大患者由于肿瘤生长速度较慢,术后一旦出现后组颅神经损伤,代偿困难,故一般建议观察。对于无症状、无脑干受压、排除恶性倾向的患者也可采取观察策略,定期随访。然而,观察随访期间肿瘤的生长可导致相关颅神经功能损伤。有一项随访观察研究表明,短期随访36个月,92%的患者肿瘤未见增大或退缩,随访观察60个月,82%的患者肿瘤仍未见增大或退缩,然而随访时间超过60个月,肿瘤未见增大或退缩者仅为45%[22]。
2.手术治疗:手术切除是根治颈静脉孔区副神经节瘤的唯一手段,颈静脉孔区副神经节瘤的外科治疗极具挑战性,颈静脉孔区是颅底解剖最为复杂的区域之一,该区肿瘤可跨颈静脉孔同时累及颅后窝及咽旁间隙。手术不仅需要暴露颈静脉孔,还要暴露邻近相关区域,包括内侧的舌下神经、前方的颈内动脉及后方的椎动脉。对于颅底外科医师而言,一方面要充分显露肿瘤以利彻底切除,减少肿瘤残留或复发,另一方面要避免损伤大血管,保护邻近各颅神经的功能,避免影响术后患者的生活质量。因此,如何根据全身状况,肿瘤的部位、性质及范围选择个性化的手术方式具有重要意义。
目前认为颈静脉孔区副神经节瘤的手术适应证包括但不限于以下方面:(1)瘤体的生长已损伤邻近颅神经甚至压迫脑干;(2)肿瘤累及外耳道,可导致反复外耳道出血或外耳道深部胆脂瘤形成并发严重耳部疼痛;(3)部分患者因放射治疗失败,肿瘤继续生长;(4)年轻患者及有较长的期望寿命者均应以积极手术治疗为主[23],肿瘤越小手术效果越好,建议早期手术。
术前准备包括以下方面:一般建议对瘤体较大且血供丰富者行肿瘤供血动脉栓塞,栓塞后应密切观察可能导致的并发症,如耳后疼痛、面神经麻痹、视力下降、颅内血栓形成导致脑梗;其次,颈内动脉受累者术前应行球囊闭塞试验来评估患者对侧颈内动脉代偿及对缺血的耐受情况,球囊试验阳性患者可考虑颈内动脉放置覆膜支架或行动脉搭桥;再次,对于具有内分泌功能的瘤体术前应给予β受体阻滞剂,控制血压稳定以确保手术安全;另外,术前应全面评估病变对侧是否存在头颈部副神经节瘤,若对侧存在头颈副神经节瘤,应充分评估对侧颈内静脉、乙状窦的受累及静脉回流情况,因为术侧病变累及的乙状窦及颈内静脉结扎后将影响颅内血液回流,若对侧病变已累及颈内静脉或乙状窦而使管腔受压,可严重影响大脑血液回流从而产生术后颅内高压,脑水肿等不良后果。
手术入路需根据肿瘤大小、位置、有无颅内侵犯、神经功能的保护及术者的个人经验等因素综合考虑。(1)外侧入路:包括Fisch A型颞下窝入路、经颈-乳突入路、迷路入路、耳蜗入路以及经岩骨的各种改良入路等。(2)后侧入路:即颅后窝入路,包括乙状窦后入路和远外侧经颞颈入路等。(3)前侧入路:包括Fisch B型和C型颞下窝入路。其中Fisch A、B、C型颞下窝进路是最为常用的手术入路,手术治疗目标是最大限度切除肿瘤的同时尽量保留颅神经功能,减少术后并发症。在提高术后面神经功能方面,笔者团队在国际上首次提出无张面神经前移位,即将面神经自茎乳孔至膝状神经节从面神经骨管中游离后,连同二腹肌后腹,腮腺一道前移位,将腮腺上极同颞肌下缘用粗线缝合后,撑开器45度前上撑开达到面神经的无张前移位,能充分暴露颈静脉孔及肿瘤,术后90%的患者可达到面神经功能HB分级Ⅰ~Ⅱ级,肿瘤全切率为95%[24]。吴皓教授团队回顾分析颈静脉孔区肿瘤患者术后面神经功能,手术中根据肿瘤部位及大小,分别应用面神经全程移位,面神经部分移位和面神经骨桥技术,其中面神经全程移位后面神经功能HB分级Ⅰ~Ⅱ级为48.4%,面神经部分移位后HB分级Ⅰ~Ⅱ级为82.6%,应用面神经骨桥技术患者术后HB分级Ⅰ~Ⅱ级为95.1%[25]。在改善患者术后听力方面,高志强教授团队利用胸锁乳突肌瓣重建鼓室下后壁,维持外耳道通畅,改善术后的听力,气骨导差为14 dB[26]。因此随着手术经验的积累和手术技术的不断改进,颞下窝径路切除颈静脉孔区副神经节瘤变得更为安全和有效。
3.放射治疗:目前在欧美国家,放射治疗被多数医生考虑为颈静脉孔区副神经节瘤的首选治疗方案。放射治疗能使肿瘤中的供血动脉纤维化,控制肿瘤的进一步生长甚至出现部分退缩,放射治疗在神经功能保护方面具有优势,患者生活质量较手术全切者高[27, 28]。然而放射治疗的优点也是其缺点,其仅能控制肿瘤的生长,最多使其部分退缩。目前各家报道随访时间不一,放射治疗对肿瘤的控制率也不尽相同,一般认为近期的效果较好[29],随访放射治疗20年的患者,其中80%有肿瘤进一步增大的表现,因此放射治疗有可能将这类患者的手术治疗留给下一代的颅底外科医生。Sanna教授团队的一项研究表明,由于副神经节瘤的生长速度慢,短期的随访观察同放射治疗的效果没有差别[22]。
目前放射治疗副神经节瘤的方式包括根治性放射治疗和部分切除后的术后补充放射治疗[30]。放射治疗的适应证包括:患者惧怕手术风险选择放射治疗;年龄过大且肿瘤渐进性生长;全身情况较差,有手术禁忌证;双侧肿瘤无法手术;术后肿瘤残留或肿瘤复发者[31, 32]。尽管放射治疗对颅神经功能的损伤较小,但可能导致口腔干燥,感音神经性听力损失,放射诱导的恶性肿瘤及放射性坏死等[33]。研究表明Gamma刀较传统的放射治疗提供的肿瘤控制率相当[34],但所需放疗次数少,产生副作用诸如放射性骨坏死概率低,为目前较多临床中心首选的放疗技术。
所有作者声明无利益冲突
1. 家族遗传型颈静脉孔区副神经节瘤常见的基因突变不包括()
A. MYB
B. SDHx
C. VHL
D. NF1
2. 颈静脉孔区副神经节瘤颞骨MRI中特征性表现为“胡椒盐征”中的“胡椒”指的是()
A. 瘤内出血灶
B. 流空的血管影
C. 脂肪
D. 钙化灶
3. 颈静脉孔区副神经节瘤累及颈内动脉水平段和迷路岩尖骨质,按照Fisch分型,应为哪一类型()
A. A型
B. B型
C. C1型
D. C3型
4. 对于瘤体较大并累及面神经和后组颅神经但未侵入颅内的颈静脉孔区副神经节瘤,首选何种治疗方式()
A. 放疗
B. 化疗
C. 手术治疗
D. 随访观察
5. 颈静脉孔区副神经节瘤手术治疗的常见并发症包括()
A. 出血
B. 面神经麻痹
C. 声嘶,呛咳
D. 以上都是



























