
经导管左心耳封堵术(transcatheter left atrial appendage occlusion, LAAO)是一种通过在心房颤动(atrial fibrillation, AF)患者左心耳内置入封堵器,以达到预防AF相关的栓塞性事件的治疗方法[1-4]。经典式LAAO要求采用全身麻醉、经食管超声心动图(transesophageal echocardiography,TEE)引导,且需要心外科及体外循环医师后备支持,以随时应对各种突发情况[5]。但是,随着经验累积、器械迭代发展,LAAO的手术风险不断降低,全身麻醉、TEE检测等措施在一些情况下反而可能会增加患者的相关风险,增加手术及康复的时间和费用。已有临床研究表明,X线透视下引导LAAO也是安全和有效的[6-8]。截至2021年底,我国LAAO总数已突破30 000例,可实施LAAO的中心数量超过500家,国内外的部分术者已积累了丰富的经典式和简化式的LAAO经验。为规范简化式LAAO,由中国医师协会心血管内科医师分会结构性心脏病专业委员会组织国内相关领域的专家起草,经多次专家讨论,制定了《简化式左心耳封堵术临床路径中国专家共识(2022)》。
版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
经导管左心耳封堵术(transcatheter left atrial appendage occlusion, LAAO)是一种通过在心房颤动(atrial fibrillation, AF)患者左心耳内置入封堵器,以达到预防AF相关的栓塞性事件的治疗方法[1,2,3,4]。经典式LAAO要求采用全身麻醉、经食管超声心动图(transesophageal echocardiography,TEE)引导,且需要心外科及体外循环医师后备支持,以随时应对各种突发情况[5]。但是,随着经验累积、器械迭代发展,LAAO的手术风险不断降低,全身麻醉、TEE检测等措施在一些情况下反而可能会增加患者的相关风险,增加手术及康复的时间和费用。已有临床研究表明,X线透视下引导LAAO也是安全和有效的[6,7,8]。截至2021年底,我国LAAO总数已突破30 000例,可实施LAAO的中心数量超过500家,国内外的部分术者已积累了丰富的经典式和简化式的LAAO经验。为规范简化式LAAO,由中国医师协会心血管内科医师分会结构性心脏病专业委员会组织国内相关领域的专家起草,经多次专家讨论,制定了《简化式左心耳封堵术临床路径中国专家共识(2022)》。
简化式LAAO一般采用局部麻醉,术中主要在X线透视、经胸超声心动图(transthoracic echocardiography,TTE)引导评估下完成。这种操作流程一般不需要全身麻醉和TEE的全程引导,简化了经典式LAAO的流程。术后患者可直接被转运至普通病房,无手术相关并发症的情况下,可在术后6~12 h下床活动,缩短康复过程和住院时间。
但简化式LAAO也并不排斥TEE或心腔内超声(intracardiac echocardiography,ICE)的引导及监测,若术前影像学评估提示手术难度较大和/或手术风险高的患者,可视具体情形转为镇静或全身麻醉,予TEE或ICE辅助引导及进一步评估封堵效果(表1)。

经典式与简化式经导管左心耳封堵术术式对比
经典式与简化式经导管左心耳封堵术术式对比
| 项目 | 经典式LAAO | 简化式LAAO |
|---|---|---|
| 推荐人群 | 存在以下情况之一者:1.严重脊柱畸形;2.心脏先天性或后天性畸形(严重心脏转位、异位心等);3.左心血液极度瘀滞者;4.认知障碍、精神异常等;5.复杂左心耳解剖(多分叶、反鸡翅等) | 1.全身情况良好;术前评估提示心脏及左心耳解剖不复杂;能较好配合局部麻醉手术;2.尤其适合:口咽部及上消化道疾病导致TEE不能配合或多次失败者;麻醉高风险或存在麻醉禁忌 |
| TEE术前评估 | + | + |
| MSCT术前评估 | +/- | +/- |
| 麻醉方式 | 全身静脉麻醉(采用导尿管、气管插管、有创血压监测、心电图) | 局部麻醉(袖带血压监测、指尖氧饱和度监测、心电图) |
| TEE术中引导与评估 | + | - |
| TTE术中引导与评估 | - | + |
| X线透视 | + | + |
| 多角度左心耳造影 | + | + |
| 器械型号选择标准 | X线透视/TEE/CT | X线透视 |
| 封堵效果评估 | TEE/X线透视 | X线透视 |
| 术后患者管理 | CCU或普通病房在监护下麻醉苏醒,需要留置导尿,住院时间长 | 普通病房,无需留置导尿,住院时间短 |
注:LAAO,经导管左心耳封堵术;TEE,经食管超声心动图;MSCT,多层螺旋电子计算机断层扫描仪;TTE,经胸超声心动图;CCU,心脏重症监护室;+,常规做;-,常规不做;+/-,视情况而定
2012年Guérios等[6]首次报道使用Amplatzer Cardiac Plug (ACP,雅培公司,美国)封堵器进行简化式LAAO,结果显示76例接受简化式LAAO的患者手术成功率高达99%。陈良龙等[7]于2017年报道简化式LAAO的初步经验。So等[9]也曾报道,使用LAmbre封堵器成功完成31例简化式LAAO,手术成功率达到100%,未发生围手术期及短中期的严重心血管病事件。2019年,Yuniadi等[10]首次进行简化式与经典式LAAO的小样本、中长期随访对比研究,结果显示两组患者手术成功率均为96%,死亡率差异无统计学意义(P=0.467)。2021年,Zhang等[11]比较经典式与简化式LAAO的有效性与安全性,进一步证明使用X线透视引导LAAO也能满足释放标准,为规范简化式LAAO提供了可靠的参照方案。
拟开展简化式LAAO的医院应具备进行经典式LAAO的硬件设备,必要时可迅速转化为ICE引导或全身麻醉下TEE引导。应有如下硬件配置:(1)超声心动图机(含食管探头),确保每例拟接受简化式LAAO的患者都可以在术前完成TEE评估;(2)多层螺旋电子计算机断层扫描仪(multislice computed tomography,MSCT),若患者不能耐受TEE,可进行MSCT评估;(3)其他相关导管和器械,如心包穿刺包、圈套器、异物钳和血管缝合器等;(4)心脏重症监护室(cardiac care unit,CCU),包括场所和设备。
1.开展简化式LAAO术者有3年以上心脏导管介入经验,累计完成50例以上经典式LAAO,熟练掌握心脏解剖和影像,熟悉应用TEE或MSCT进行术前评估,具备丰富的LAAO围手术期管理经验。
2.多学科参与:麻醉团队、心脏外科团队、血管外科团队及超声团队。
适应证与经典式相同[12,13,14,15,16],简述如下:非瓣膜性AF患者;高卒中风险者,男性CHA2DS2-VASc评分≥2分、女性≥3分。具有下列情况之一:(1)不适合长期规范抗凝治疗;(2)长期规范抗凝治疗的基础上仍发生血栓栓塞事件;(3)HAS-BLED评分≥3分;(4)左心耳电隔离后的患者;(5) AF行导管消融术的患者,存在LAAO的适应证,可同时行LAAO。
优先推荐简化式的患者类型:(1)全身情况良好;(2)经术前评估,心脏及左心耳解剖不复杂;(3)能较好配合局部麻醉手术;(4)合并口咽部及上消化道等疾病,TEE不能配合或多次失败者;(5)麻醉高风险或存在麻醉禁忌。
简化式LAAO的禁忌证同经典式LAAO,特别应注意以下情况:(1)严重脊柱畸形;(2)存在心脏先天性或后天性畸形,如严重心脏转位、异位心等;(3)高凝状态,不能排除心腔内血栓;(4)因认知障碍、精神异常等因素不能配合局麻手术;(5)胸腔外科手术后存在心脏转位。
TTE检查可明确心脏功能及结构,排除瓣膜性AF;术中指导房间隔穿刺,评估围手术期并发症。
TEE可以显示二维和三维静态和动态图像,评估左心耳形态/结构、测量左心耳开口直径及可用深度,为封堵器尺寸选择提供依据。TEE是识别左心耳内血栓的金标准,是术前必要完善的检查,若术前发现有明确血栓,则本次不可进行封堵手术。术前TEE检查中,应该至少从0°、45°、90°和135° 4个角度观察左心耳形态及分叶、最大开口直径、可用深度(着陆区深度)、左心房和左心耳内自发显影程度及血栓情况、左心耳内梳状肌位置及分布。应描述房间隔状态(缺损、房间隔瘤等),以及二尖瓣、肺静脉等左心耳邻近组织的情况。TEE检查应在LAAO术前48 h内进行。
患者有食管疾患等不能耐受TEE检查者,MSCT可作为替代方案。有研究提示,TEE测量值和MSCT测量值存在微小差别(可能与超声切面有关)[17],MSCT测量的左心耳开口直径比TEE测量值大2~3 mm[18,19],LAAO中需综合考虑选择封堵器的尺寸。有研究提示,MSCT检查左心房、左心耳内血栓的敏感性和特异性略逊于TEE[20]。
MSCT具有良好的空间分辨率,可从任意切面显示左心耳形态及其毗邻结构。三维重建可从多个角度观察左心耳的形态、轴向及分叶,指导术中房间隔穿刺点以及最佳投射体位。MSCT检查建议在术前24 h内完成,建议使用的参数如下:造影剂50~80 ml,速率4.0~5.0 ml/s,追加30 ml生理盐水,速率4.0~5.0 ml/s,触发点设在升主动脉,触发阈值100 Hu,触发后延迟10 s屏气扫描,采用回顾性心电门控或前瞻性方式扫描,以收缩期相采集为主。第1期扫描结束后延迟30~60 s行第2次扫描,用来评估左心耳内有无血栓[21,22,23]。
拟行LAAO的患者多为高龄且合并症多,存在抗凝禁忌或高出血风险,个体差异大,目前无围手术期抗栓策略的统一方案[24]。临床中,需根据患者的个体情况而定。
手术前的抗凝策略遵循AF的抗凝治疗原则。应用华法林的患者,如国际标准化比值(international normalized ratio,INR) 2~3,术中根据活化凝血时间(activated clotting time,ACT)调整肝素的剂量;服用非维生素K拮抗剂口服抗凝药(non-vitamin K antagonist oral anticoagulants, NOAC)的患者当天停用;推荐术中使用普通肝素抗凝(60~100 IU/kg),完成房间隔穿刺后,维持ACT在250~350 s。普通肝素使用禁忌时,可选择使用比伐芦定[25,26]。
术前半小时给予抗生素1次,术后预防性使用抗生素1~2 d;对于既往有胃肠道出血或胃溃疡病史患者,可使用护胃药物预防应激性消化道出血;肾功能不全的患者需要围手术期水化等保肾治疗;对于血容量不足者可予术前适当补液。
术前完善血尿便常规、血生化及TEE等检查。做好健康教育,向患者介绍手术目的、注意事项,告知患者术中听从术者指令、保持平卧,减轻紧张心理,避免术前血压波动过大。术前禁食、禁饮6~8 h,为必要时镇静或全身麻醉做好准备。手术日做好皮肤准备,检查皮肤、指甲及口腔是否存在感染,取出活动义齿,取下饰品。术前测量生命体征,建立静脉通路。
术者在术前应详细了解患者临床和相关检查资料,确认LAAO适应证,排除禁忌证,根据术前TTE、TEE或MSCT图像资料制定手术策略及必要的替代方案。
术中全程监测患者心电图和血压,必要时使用氧饱和度监测。
使用Seldinger血管穿刺技术建立股静脉通路。
LAAO房间隔穿刺有其特殊性,除反鸡翅型左心耳要偏下、偏前外,其余类型要求穿刺点位置中间偏后、偏下。穿刺针、鞘管在送入体内之前需要根据心房大小对其头端塑形。
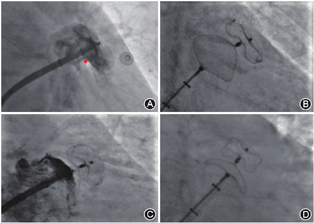
在正位X线透视下,房间隔穿刺鞘沿配套导丝送至上腔静脉,退出导丝后送入连接造影剂的穿刺针,距鞘管头端1 cm处固定,在X线透视下缓慢回撤,同时将穿刺鞘和穿刺针由12点钟方向逐渐指向5点钟左右方向的房间隔部位(根据心房大小调整方向),后前位(postero-anterior,PA)时鞘尖以位于左心房影下缘上半个至一个椎体高度为宜(图1A)。当鞘尖顶住房间隔后,在右前斜位(right anterior oblique,RAO )45°适当再次调整穿刺点至左心房后缘前半个至一个椎体为宜(图1B),以穿刺针及鞘管远段弧度消失呈直线状或接近直线状为理想穿刺点。
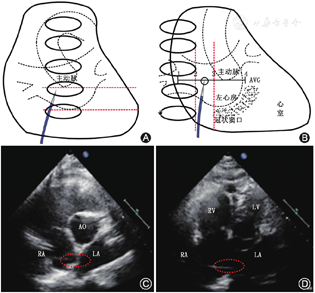

TTE下可观察到穿刺鞘尖端抵在房间隔上形成的"帐篷顶"现象。对于大多数患者穿刺的合适位置:(1)胸骨旁主动脉短轴切面,位于房间隔下端的中下1/3处(图1C);(2)心尖四腔心切面,位于房间隔中部(图1D)。
对穿刺针进行排气后,送入穿刺针的内芯,在X线透视下将穿刺针(芯)缓慢前推刺破房间隔,注射少量造影剂使左心房显影以判断针尖是否进入左心房,可使用0.014 in (1 in=2.54 cm)导丝进行保护,右手固定穿刺针后,穿刺鞘沿其缓慢穿过房间隔进入左心房,撤回穿刺针,将配套导丝送入左上肺静脉(left superior pulmonary vein,LSPV)后,再沿导丝将穿刺鞘完整推送进入左心房。
当面临患者TTE透声不佳、外科手术后心脏转位、畸形或反复调整下房间隔仍难以穿过时,可行上腔静脉造影(一般为RAO 45°),延迟显影,明确右心房、左心房、左心耳、房间隔及主动脉的解剖关系,有助于房间隔穿刺。当房间隔穿刺成功后,建议立即进行TTE检查,排除心包积液,并补充普通肝素(60~100 IU/kg),5~10 min后抽血监测ACT,目标值250~350 s。根据手术时程,必要时追加肝素。
房间隔穿刺后要注意术中抗凝和左心房压监测。通常按60~ 100 IU/kg给予普通肝素,5~10 min后进行ACT测量,术中ACT控制在250~350 s;维持左心房平均压≥ 10 mmHg (1 mmHg=0.133 kPa),若<10 mmHg,建议酌情补液。
房间隔穿刺成功后,在X线透视指引下,送入配套导丝至LSPV,顺时针旋转房间隔穿刺鞘并沿配套导丝缓慢推送至LSPV口部,撤出内鞘及导丝,保留外鞘,送入加硬导丝至LSPV,若导丝难以送入LSPV,可将加硬导丝塑形成两圈半形状在左心房内展开。
固定加硬导丝位置,沿导丝缓慢撤出房间隔穿刺鞘、按压止血。用肝素盐水对封堵器导引鞘进行冲洗排气,将外鞘与内鞘同轴组装,在X线透视下,导引鞘沿加硬导丝缓慢送至LSPV口部后,撤出内鞘和导丝。
将肝素盐水冲洗过的猪尾导管,沿封堵器外鞘送至LSPV。将外鞘和猪尾导管缓慢后撤,旋转猪尾导管送入左心耳内。
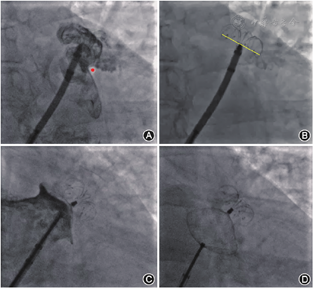
利用猪尾导管在左心耳内造影,确认猪尾导管进入左心耳,一般通过"三体位"造影图像来确认左心耳的形态:(1)RAO+头位(cranial,CRA),即右肩位,如RAO 30°~45°+CRA 20°(图2A);(2)左前斜位(left anterior oblique,LAO)+足位(caudal,CAU),如LAO 0°~15°+CAU 20°(图2B);(3)RAO+CAU,即肝位,如RAO 30°~45°+ CAU 20°(图2C)。不同患者造影角度可能会有所不同,为获得清晰的左心耳图像,可对造影角度进行调整。一般将"RAO+CAU"称为工作体位,在此体位下大多数患者左心耳能够充分展开,也可通过MSCT提前确定工作体位,在工作体位进行封堵器的展开,完成LAAO。
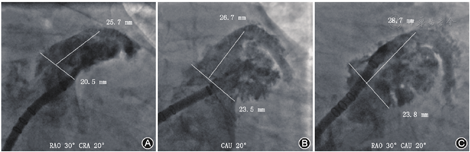

将猪尾导管置于左心耳的远端,尾端连接20 ml注射器;外鞘头端置于左心耳口部,尾端连接造影装置(如冠状动脉造影三联三通连接管、环柄注射器)。造影前确定X线透视工作模式以及视野大小(冠状动脉模式、帧率15幅/s为宜)。在鞘管以及猪尾导管中预充造影剂后再同时造影,可获得更清晰的左心耳影像。造影后,测量各个体位下的左心耳口部直径和可用深度,选择合适型号的封堵器,不同类型封堵器选择方式详见后述。
WATCHMAN封堵器(波士顿科学公司,美国)一般在最大开口直径的基础上加4~6 mm作为封堵器的选择标准。若左心耳开口为椭圆、极度不规则或心耳收缩幅度较大等特殊情况,需结合术前TEE或MSCT综合考虑,选择封堵器型号。
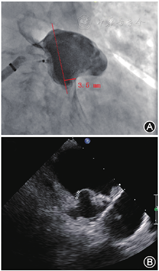
旋开止血阀回拉释放手柄数厘米,确认钢缆与封堵器连接良好。首先进行近端排气,输送系统远端浸没于肝素盐水中,助手用手指轻轻堵住输送系统远端,用50 ml螺口注射器在输送系统Y阀注射肝素盐水,近端连续出水完成排气后,持续注射肝素盐水同时旋紧止血阀;然后进行远端排气,助手松开输送系统的远端,保持其完全浸没于肝素盐水中,在Y阀处以"慢抽快冲"的方式注射肝素盐水,冲洗2~3次,保留30~ 40 ml肝素盐水于螺口注射器内,完成排气。最后使封堵器远端对齐输送系统标记环,若左心耳可用深度受限时,可体外借深度,即使封堵器远端超出标记环1~2 mm,建议不超过3 mm(图3)。


在X线透视下,沿猪尾导管将外鞘送入左心耳远端,确保对应尺寸的标记环与封堵工作线一致。此时,左手固定外鞘,确保外鞘的轴向和位置没有发生变化,缓慢撤出猪尾导管,确认外鞘回血顺畅后,将持续灌注的输送系统沿外鞘送入体内。在X线透视下,将输送系统的标记环与外鞘最远端的标记环对齐,固定输送系统,回撤外鞘,与输送系统的连接端锁合。此时外鞘与输送系统连为一体。
展开封堵器时,尽量保持封堵器肩部与封堵工作线相对位置固定,助手旋开止血阀,术者右手固定住释放手柄,避免前推或后退,左手向后缓慢回撤鞘管,直至封堵器完全展开。
当封堵器展开后,可利用X线透视评估封堵效果,有研究表明左心耳造影与TEE对于封堵器残余分流(peri-device leak,PDL)的检出率类似,X线透视下测量的器械压缩比略低于TEE测量值[27]。
X线透视下评估PASS原则(视频9),总结如下:(1) P代表位置(Position):封堵器肩部位于心耳口部。X线透视下可行"三体位造影",分别查看封堵器上、下缘与左心耳开口的位置关系。建议露肩高度控制在封堵器直径的1/3以内。露肩通常在CAU 20°+RAO 0°~45°之间调整,将封堵器心房侧伞面的切线位显示清楚,结果与TEE对应角度吻合(图4)。(2) A代表锚定(Anchor):将止血阀略旋开,回撤外鞘距离封堵器伞面约2 cm,力量适度回拉释放手柄1.0~1.5 cm,并立即松开,该过程中有较明显的牵拉阻力,在X线透视下观察到封堵器与心耳壁同步运动,并且封堵器在牵拉后回弹明显,且无位置变化(可同时注射造影剂),器械稳定。当封堵器稳定性存疑时,可再次牵拉验证。取侧伞面切线位进行牵拉更易判断封堵器位置变化。(3) S代表尺寸(Size):在X线透视下进行压缩比的测量。可在右足或右肩位(调整至封堵器切线位)下曝光,量取封堵器最大直径计算压缩比,压缩比的计算方式为:(原始尺寸-展开直径)/原始尺寸×100%,数值推荐10%~30%为宜(图5)。可在LAO 40°~50°观察封堵器心房侧的整个伞面,过圆心连接帽进行最大直径测量,进行压缩比计算。(4) S代表密封(Seal):判断置入封堵器后是否存在PDL。X线透视下可行"三体位造影",分别查看封堵器边缘与心耳口部的位置关系,注意是否有造影剂从封堵器周围进入左心耳,若PDL≥3 mm,调整封堵器位置或更换封堵器。


评估符合PASS原则,推进鞘管,抵住封堵器,逆时针旋转释放手柄3~5圈后,完成封堵器的释放。
钢缆回撤至鞘管后,再次造影,观察封堵器释放后位置形态情况。
WATCHMAN FLX是目前最新一代的WATCHMAN左心耳封堵器(图6),安全性、有效性及可操作性均较其上一代有明显提高[28,29,30,31]。
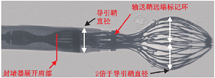

WATCHMAN FLX的展开操作可概括为4步法(图7,视频10):(1)输送系统置于心耳体部,退鞘生成球形形态(FLX Ball,球体直径约2倍于鞘管直径);(2)整体推送输送系统(保持其球形形态),使封堵器肩部对齐封堵工作线;(3)固定释放手柄,缓慢退鞘展开封堵器;(4)封堵器展开瞬间抵住释放手柄至少10 s。
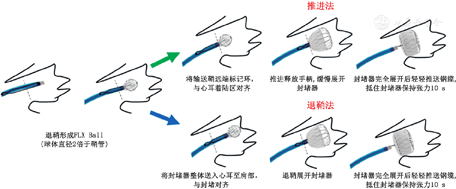

封堵效果评估与WATCHMAN类似,仍由"PASS"四项内容组成。在位置(Position)的评估上有细微差异:建议露肩控制在"封堵器展开长度的1/3"以内。
LACbes封堵器(上海普实医疗公司)固定盘的型号选择一般在着陆区测量的基础上加2~4 mm,封堵盘的型号选择一般在心耳口部测量的最大直径基础上加4~ 6 mm。若合并左心耳开口极度不规则、心耳内部梳状肌发达或左心耳收缩幅度较大等特殊情况,需结合术前TEE和MSCT综合考虑选择封堵器型号。
(1)组装装载装置:将装载器、钢缆进行组装;(2)组装封堵器:将在盐水中排气后的LACbes封堵器与钢缆组装,顺时针旋紧,最后回半圈约1/3圈至锁合处有轻微跳动感即可(防止因锁合过紧释放时无法解脱);(3)装置排气:先排尾端,旋紧止血阀;再排头端,反复排水3次即可;整个过程需保持装置头端完全浸没在肝素盐水中;(4)装置准备完成,将封堵器稍突出装置;(5)装载装置与鞘管锁合,推送钢缆,送入封堵器至与头端标记环对齐;(6)封堵器展开过程:固定输送鞘,位于左心耳口部的输送鞘的远端在向前推送封堵器时不能发生位移,整个推送过程应缓慢轻柔,避免发生跳跃。当封堵器远端与输送外鞘远端标记环平齐时,固定钢缆,缓慢回撤输送鞘使封堵器的固定盘部分打开,形成倒三角形或圆盘形时,再整体向前推送,送入固定盘至左心耳口部以内约10 mm(着陆区),然后在固定输送鞘的同时向前推送钢缆,固定盘完全打开,固定在着陆区。继续回撤输送鞘并向前推送钢缆,使封堵盘完全打开。
(1) P(Proper position):代表封堵器位于合适位置,即固定盘至少有2/3在回旋支内左心耳侧(图8)。LACbes封堵器的固定盘展开后,需要通过"三体位"造影来确定放置位置,确定固定盘至少有2/3位于回旋支[32]左心耳侧,以确保封堵盘展开后和心耳口部贴合更佳。(2)A (Absolute anchor):代表固定盘可靠铆定,即牵拉封堵盘,固定盘无位移。封堵盘展开后,固定钢缆,回撤外鞘,使其离开封堵器伞面2~ 3 cm,牵拉封堵盘成半球形,"三体位"调整至切线位各完成一次牵拉,固定盘位置不变即可推送钢缆将封堵盘复位。(3)S (Separate and seal):代表固定盘与封堵盘分离,且封堵盘PDL≤3 mm。"三体位"X线透视下观察内外盘是否分离;同时,造影判断封堵器PDL情况,若PDL>3 mm,则需要调整封堵器位置或更换型号。若钢缆对封堵器有提拉现象,可推送钢缆使封堵盘尽量贴靠心耳口,以便更好地判断PDL。(4) T (Typical tyre):代表固定盘成轮胎状。LACbes封堵器主要通过观察固定盘形态判断其与心耳壁的贴合情况,如成"轮胎状",则证明固定盘贴合情况理想;如固定盘完全无压缩或呈现"草莓状",则固定盘与左心耳壁贴合欠佳,无法保证倒钩钩挂住梳状肌,影响封堵器稳定性,需要更换型号或调整固定盘位置。

封堵器固定盘建议在着陆区最大直径的基础上加2~4 mm,封堵盘的选择在开口测量最大直径的基础上加4~6 mm。若开口直径与着陆区直径相差≥10 mm,则选择特殊型号的小伞大盘封堵器。如左心耳结构较为复杂,建议根据MSCT或者术前TEE进行选择。
(1)取出合适型号的封堵器,放置于肝素盐水中,连接在钢缆和装载器上,旋紧之后回旋半圈,防止封堵器无法解脱。(2)将封堵器完全浸没在肝素盐水中后,回拉钢缆,将封堵器完全收入装载器中。(3)推荐使用50 ml的螺口注射器,冲洗封堵器至少3次,保证装载器和封堵器内部的空气完全排出。(4)将封堵器连同装载器放置于手术台上,装载器尾端连接高压盐水冲洗后,关闭阀门待用。
(1) X线透视确认输送鞘远端标记环位于左心耳开口与着陆区中间位置后,撤出止血阀和猪尾导管,观察输送鞘内是否有血液流出。若无血液流出,则输送鞘可能存在贴壁、血栓或左心房压力过低等情况,需明确具体原因,并予以处理。(2)在高压盐水冲洗下,将装载器与正在有血液流出的输送鞘连接,确认连接紧密后,松开装载器后的止血阀,向前推送输送钢缆,至封堵器接近输送鞘头端后,关闭高压盐水。(3)确认封堵器远端标记环位于左心耳开口与着陆区中间位置,缓慢推送输送钢缆,封堵器与输送鞘远端标记环对齐后,逐渐推送并打开固定盘,确认旋紧输送鞘近端的止血阀后,造影观察固定盘与心耳之间的位置关系,若固定盘完全打开,且在理想位置,后退输送鞘打开封堵盘,完成封堵。(4)对于梳状肌比较发达的左心耳,推荐采用渐进式。在左心耳口部半打开固定盘[33],然后连同输送鞘整体推送至接近着陆区后,继续推送固定盘,使其在着陆区完全打开,封堵盘的展开步骤与LACbes封堵器的展开方式相同。
(1) C (Circumflex artery):封堵器固定盘在回旋支内心耳侧(图9)。LAmbre封堵器的固定盘展开后,需要通过"三体位"造影确定固定盘在回旋支内心耳侧。(2)O(Opening):固定盘充分展开,即X线透视切线位下,固定盘U型勾末端与封堵器的连接键呈一直线。如未充分展开,需回收固定盘,整体回撤鞘管,重新推送固定盘使其充分展开。(3 )S (Sealing):封堵盘展开后贴合左心耳口部,且封堵盘PDL≤ 3 mm;展开封堵盘后,以"三体位"造影确定封堵器位置,造影时回撤输送鞘2~3 cm, X线透视下判断封堵盘展开后是否有PDL。若PDL≤3 mm,则符合封堵要求。若PDL>3 mm,则需调整封堵器位置或更换封堵器。(4)T (Tug test):封堵器稳定,通过牵拉测试,即将封堵盘牵拉呈菱形,维持15 s,以"三体位"造影判断固定盘的位置,以适当的力度牵拉封堵盘呈菱形,维持15 s,固定盘在牵拉前后的位置没有变化,则封堵器稳定。如出现固定盘移位,需要调整固定盘的位置或者更换封堵器。

确认满足COST原则以及对周围结构无影响后,推送输送鞘抵住封堵盘,逆时针旋转钢缆3~5圈,则释放封堵器。再次行"三体位"造影,确认封堵器状态。
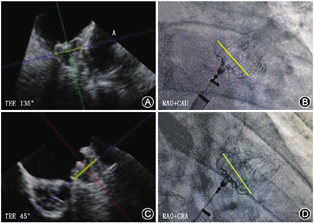
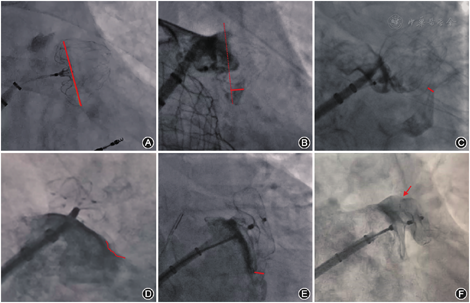
需要转化术式的情况:(1)房间隔穿刺困难的患者,包括解剖因素、外科术后或曾多次穿刺及房间隔缺损封堵术后,若出现该情况,则建议全身麻醉;(2)造影显示不清、无法看清左心耳解剖,原因包括心耳结构复杂、鞘管轴向差及患者肥胖X线透视显影不清;(3)术中封堵效果不确定的患者,包括露肩、压缩比、稳定性、PDL大小以及对毗邻组织的影响,需要借助其他影像学手段进一步明确(图8)。如出现虽然牵拉十分稳定,但是无法准确测量封堵器压缩比或露肩,以及疑似PDL>3 mm等情况,为进一步确保封堵效果,建议采用TEE或ICE来验证(图10)。

术后密切监测心率、心律、血压、呼吸及神志状况,并行心电图检查。观察伤口有无出血、血肿,手术肢体皮色、皮温及动脉搏动情况,按医嘱制动,嘱趾端活动。观察有无不适症状(胸闷、心悸、头晕、恶心、气促及烦躁等)及异常体征(心动过速/过缓、血压下降、脉搏细弱、面色苍白及出冷汗等)。出现相应症状时应立即检查超声心动图,排除心包积液、填塞和封堵器移位等并发症,若有心包填塞,立即协助开展心包穿刺引流。术中接受镇静麻醉、食道插管的患者,术后需密切观察是否存在呼吸抑制、误吸和上消化道损伤等异常情况。术后鼓励饮水,促进造影剂排出,关注肾功能的变化,发现异常按医嘱水化干预,预防对比剂肾病。
鼓励患者进行早期康复运动,防止围手术期出现血栓栓塞等并发症。患者出院前可完善包括运动功能、关节活动度、肌张力、感知功能、言语及吞咽、日常生活能力和认知能力的综合评估。
目前,LAAO术后最佳的抗凝或抗栓方案尚无统一标准。不同封堵器置入后的抗栓方案不尽相同。本临床路径根据不同封堵器类型和相应的临床试验结果,对简化式LAAO术后的抗栓方案进行简单介绍。(1)以WATCHMAN为代表的塞式封堵器[4],使用华法林抗凝治疗(INR 2.0~3.0),也可直接应用NOAC,维持45 d后,改为双联抗血小板治疗至3个月,再单抗治疗,后续根据患者情况决定单抗使用时间[34,35]。若患者存在抗凝禁忌,术后也可直接接受抗血小板治疗[36]。(2)LAmbre和LACbes为代表的盖式封堵器,封堵术后可直接使用双联抗血小板治疗6个月,继而改为单抗治疗。术后规范化抗栓治疗对于预防器械相关血栓(device related thrombus,DRT)发生具有重要作用,应根据患者的病情,制定个体化抗栓方案[34,35,36,37,38,39,40,41,42,43]。
联合其他介入治疗的术后抗凝治疗,多以LAAO的抗凝方案为主[44,45,46,47,48],略有不同之处在于,联合经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的LAAO术后,根据患者冠状动脉病变的轻重、AF卒中的风险程度以及出血风险等情况选择适合患者的方案,单抗血小板联合抗凝药物或直接选用双联抗血小板药物[47]。另外值得注意的是,相比单纯AF导管消融治疗,联合术式术后的用药方案,华法林或NOAC的服用时间要明显缩短[44,49,50]。
LAAO术后随访,除常规检查外,还应在45~90 d之间进行影像学随访。建议使用TEE进行多角度评估PDL和DRT等,不能耐受TEE者可使用MSCT替代进行术后随访。
近年来,MSCT在LAAO术后的价值已被认可[22]。术后随访MSCT诊断PDL的敏感度和特异度高于TEE[51]。发生DRT的患者需延长抗凝时间,每90天复查一次影像学检查(TEE或MSCT),直至DRT消失。
心脏压塞与封堵器脱落是LAAO较严重的围手术期并发症。近年来多项临床研究表明,经典式LAAO心包积液发生率为0.5%~2.0%,器械脱落发生率为0.24%~0.87%[52,53,54,55,56];而简化式的临床研究表明,简化式LAAO围手术期需要处理的心包积液发生率为1.1%~1.9%,器械脱落发生率为0.93%~ 1.10%,与经典式无明显差异[6,10,57]。且无论经典式或简化式LAAO,围手术期脑血管事件和心血管死亡事件均较为罕见。另有研究表明,简化式LAAO术后3个月TEE随访发现PDL<3 mm的发生率较经典式LAAO稍高[11]。
AF导管消融未复发不能作为术后停止抗凝的依据[58]。卒中高风险和药物难以控制的症状性AF患者合并以下情况之一:(1)高出血风险;(2)无法长期耐受抗凝;(3)导管消融时发生的左心耳电隔离或电静止,可行导管消融与LAAO"一站式治疗"[43,48,49]。两者先后顺序皆可,但各具优缺点[59,60,61,62]。
AF是房间隔缺损(atrial septal defect,ASD)的常见并发症之一[63]。有研究提示卵圆孔未闭(patent foramen ovale,PFO)封堵术后AF的发生率增加[64,65],这类患者如先行ASD/PFO封堵术,将增加建立经房间隔至左心房通路的操作难度,难以再次进行导管消融和LAAO等。因此,有学者总结了LAAO联合ASD/PFO封堵术[66,67,68,69,70,71],并证实了其安全性及有效性。
本共识的制定将为简化式左心耳封堵术的临床实践提供参考。该共识虽凝聚了国内诸多学者的丰富经验,但尚缺乏大样本量对照研究的数据,故仍有诸多不足之处,有待后续完善。本共识是国内第一版简化式左心耳封堵术的专家共识,希望随着国内外更多的关于术式改进的对照研究成果的发布,为术式的优化提供循证医学依据,从而造福患者。
共同执笔人:
张晓春(复旦大学附属中山医院心内科);白元(海军军医大学附属长海医院心内科);储慧民(宁波市第一医院心内科);肖方毅(温州医科大学附属第一医院心内科);曾杰(四川省人民医院心内科);姜小飞(珠海市人民医院心内科);王群山(上海交通大学医学院附属新华医院心内科);孙健(上海交通大学医学院附属新华医院心内科);周陵(南京市第一医院心内科);阮中宝(泰州市人民医院心内科);石瑞正(中南大学湘雅医院心内科);林颖(复旦大学附属中山医院护理部)
参与共识制定的专家(按姓氏拼音排序):
白明(兰州大学第一医院心内科);卜军(上海交通大学医学院附属仁济医院心内科);曾广伟(西安国际医学中心医院心内科);陈发东(同济大学附属同济医院心内科);陈建英(广东医科大学附属医院心内科);陈良龙(福建医科大学附属协和医院心内科);陈琦(南昌大学第二附属医院心内科);陈韬(解放军总医院心内科);陈维(上海市第十人民医院心内科);储慧民(宁波市第一医院心内科);丁风华(上海交通大学附属瑞金医院心内科);杜先锋(宁波市第一医院心内科);樊友启(浙江大学医学院附属第二医院心内科);方军(福建协和医院心内科);方咸宏(广东省人民医院心内科);葛均波(复旦大学附属中山医院心内科);龚辉(复旦大学附属金山医院心内科);桂春(广西医科大学第一附属医院心内科);郭军(解放军总医院心内科);何建桂(中山大学附属第一医院心内科);侯凯(复旦大学附属中山医院放射科);胡伟(上海市闵行区中心医院心内科);江立生(上海市胸科医院心内科);蒋晨阳(浙江大学医学院附属邵逸夫医院心内科);孔德红(复旦大学附属中山医院心内科);孔祥清(南京医科大学第一附属医院心内科);李伟(复旦大学附属中山医院心内科);李妍(空军军医大学唐都医院心内科);李岩松(上海市松江区中心医院心内科);李耀东(新疆医科大学第一附属医院心内科);李毅刚(上海交通大学医学院附属新华医院心内科);李岳春(温州医科大学附属第二医院心内科);刘海波(复旦大学附属中山医院青浦分院心内科);刘海涛(空军军医大学西京医院心内科);刘雄涛(空军军医大学唐都医院心内科);刘煜昊(阜外华中心血管病医院心内科);陆林祥(上海市东方医院心内科);马为(北京大学第一医院心内科);宁忠平(上海浦东新区周浦医院心内科);欧阳繁(株洲市中心医院心内科);潘翠珍(复旦大学附属中山医院心内科);潘宏伟(湖南省人民医院心内科);潘文志(复旦大学附属中山医院心内科);潘欣(上海胸科医院心内科);钱菊英(复旦大学附属中山医院心内科);秦永文(海军军医大学附属长海医院心内科);曲新凯(华东医院心内科);施海峰(北京医院心内科);石瑞正(中南大学湘雅医院心内科);舒先红(复旦大学附属中山医院心内科);宋光远(首都医科大学附属北京安贞医院心内科);苏晞(武汉亚心总医院心内科);陶四明(云南省第二人民医院心内科);万继业(中国医科大学附属盛京医院心内科);王诚(徐州医科大学附属医院心内科);王利宏(浙江省人民医院心内科);王琦光(沈阳军区总医院心内科);王兴祥(浙江大学医学院附属第一医院心内科);王智勇(内蒙古自治区人民医院心内科);吴素华(中山大学附属第一医院心内科);吴忠东(上海市徐汇中心医院心内科);伍广伟(广西壮族自治区人民医院心内科);谢启应(中南大学湘雅医院心内科);谢瑞芹(河北医科大学第二医院心内科);徐吉喆(兰州大学第一医院心内科);徐亚伟(上海市第十人民医院心内科);杨兵(同济大学附属东方医院心内科);叶平(武汉市中心医院心内科);殷然(南昌大学第一附属医院心内科);于波(中国医科大学附属第一医院心内科);袁杰(深圳市人民医院心内科);袁义强(河南省胸科医院心内科);张波(泰州市人民医院放射科);张曹进(广东省人民医院心内科);张刚成(武汉大学中南医院心内科);张俊峰(上海市第九人民医院心内科);张澎湃(上海交通大学医学院附属新华医院心内科);张伟华(昆明市延安医院心内科);张勇华(武汉梨园医院心内科);张玉顺(西安交通大学第一附属医院心内科);赵冬冬(上海市第十人民医院心内科);赵仙先(海军军医大学附属长海医院心内科);郑文庆(威海中心医院心内科);郑武扬(厦门市第一医院心内科);钟敬泉(山东省齐鲁医院心内科);钟炜(梅州市人民医院心内科);周纬(贵州医科大学附属医院);朱丽(复旦大学附属中山医院心内科);朱鲜阳(解放军北部战区总医院心内科心内科);朱政斌(上海交通大学附属瑞金医院心内科)

























