
胆管癌是一种主要起源于胆管上皮细胞,具有高度异质性和侵袭性的恶性肿瘤,未经治疗的胆管癌患者中位生存时间为12~24个月,手术切除和新辅助化疗有效性和持久性均有限。下一代测序发现免疫系统失调在胆管癌的发病机制中起重要作用,为针对侵袭性胆管癌自然进程的治疗研究提供了新可能,如免疫检查点抑制剂、过继细胞治疗和肿瘤疫苗等。笔者立足胆管癌免疫治疗的现状,综合阐述目前胆管癌免疫治疗策略的疗效和困境,展望胆管癌未来治疗前景。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
胆管癌是一种起源于胆管上皮的恶性肿瘤[1]。根据解剖学分为源自肝内胆管树的肝内胆管癌(10%~20%)和位于肝实质外的肝外胆管癌,后者又可分为肝门周围胆管癌(50%~60%)和远端胆管癌(20%~30%)[2]。近年来胆管癌的发病率和病死率日益上升,约占消化道恶性肿瘤的3%,原发性肝癌的15%[3]。手术治疗是目前最有效的治疗选择,但即使根治性手术后5年生存率也仅能达到25%~50%[4]。合并淋巴结转移、肿瘤切缘阳性和低分化胆管癌的患者选择辅助化疗获益也很低,总生存时间<1年[5]。肝移植作为胆管癌患者的治疗方案,其疗效良好,但是供器官紧缺是难以逾越的障碍[6]。随着对肿瘤基因组学下一代测序技术的发展和肿瘤免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的问世,免疫治疗使宿主免疫反应成为肿瘤治疗的干预靶点,改变了肿瘤治疗学理念,是过去10年肿瘤研究中重大突破之一。目前,胆管癌的免疫疗法中最有前景的探索集中在基于肿瘤免疫微环境的ICIs、过继细胞疗法及肿瘤疫苗等方面。笔者以此为切入点,总结胆管癌免疫治疗的现状并探讨其应用前景。
胆管癌的典型组织学特征是结缔组织增生,即肿瘤周围微环境内丰富的纤维基质的存在。肿瘤细胞局部周围微环境包括基质细胞(成纤维细胞、免疫细胞、内皮细胞、平滑肌细胞等)和非细胞成分(ECM、趋化因子、细胞因子等),被认为是胆管癌生长和转移的调节因子[7]。见图1。
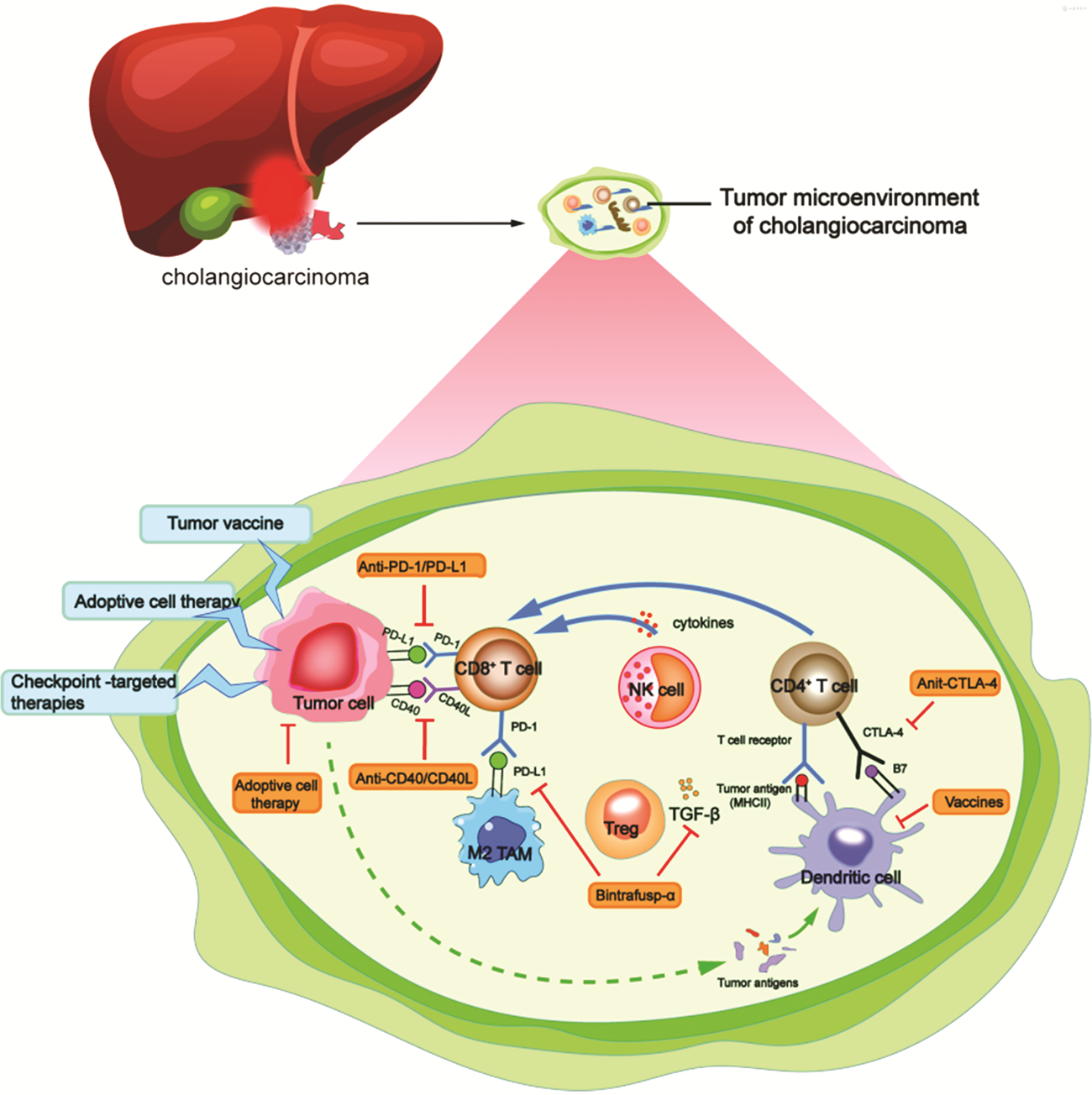

注:cholangiocarcinoma为胆管癌;tumor microenvironment of cholangiocarcinoma为胆管癌的肿瘤免疫环境;tumor vaccine为肿瘤疫苗;adoptive cell therapy为过继细胞治疗;checkpoint⁃targeted therapies为免疫检查点治疗;CTLA⁃4为细胞毒性T淋巴细胞抗原4;CD40为肿瘤坏死因子家族成员5;CD40L为肿瘤坏死因子相关激活蛋白;MHC为主要组织相容性复合体;PD⁃1为程序性死亡[蛋白]⁃1;PD⁃L1为程序性死亡[蛋白]配体⁃1;M2 TAM为M2型肿瘤相关巨噬细胞;Treg为调节性T细胞;Cytokines为细胞因子;T cell receptor为T细胞受体;Dendritic cell为树突状细胞;Bintrafusp为新一代PD⁃L1和转化生长因子⁃β的双靶点光谱抗癌药;Tumor cell为肿瘤细胞;NK cell为自然杀伤细胞;TGF⁃β为转化生长因子⁃β;Tumor antigens为肿瘤抗原
肿瘤相关成纤维细胞是参与胆管癌纤维化形成和肿瘤进展的主要细胞,其释放多种介质维持和增强胆管癌细胞的恶性生物学特性[8]。肿瘤相关成纤维细胞还通过STAT3-CCL2信号调节免疫细胞的功能、抑制T细胞增殖,诱导肿瘤细胞免疫逃逸[9]。肿瘤相关成纤维细胞促进具有干细胞特性的肿瘤细胞亚群扩张,增强其对多种疗法的抵抗力;激活肿瘤相关成纤维细胞替代信号机制,如MAPK和PI3K通路,影响胆管癌免疫治疗效果[10, 11]。
胆管癌微环境中的肿瘤相关巨噬细胞通常有M1和M2 2种亚型[12]。2种类型的肿瘤相关巨噬细胞被激活都可以触发胆管细胞增殖、纤维化形成和恶变,与胆管癌不良预后显著相关。M2型相关的趋化因子,如CCL17和CCL22募集调节性T细胞,进而抑制肿瘤发生部位的宿主反应,下调M2型巨噬细胞的活性可增加T细胞对肿瘤细胞的杀伤作用将成为胆管癌治疗新思路[13]。
NK细胞是机体抗肿瘤免疫的第一道防线,其不需要抗原刺激可直接识别并杀伤肿瘤细胞[14]。肝窦内NK细胞高表达TRAIL和Fas L,分泌IFN-γ、TNF-α、集落刺激因子和IL-2具有较强的细胞毒活性[15]。移植NK细胞可以促进机体NK伤细胞对肿瘤的杀伤活性,并抑制肿瘤细胞的生长,通过增加NK细胞数量可能是治疗胆管癌新方法。
肿瘤浸润性淋巴细胞是一组异质性免疫细胞,包括CD20阳性B细胞和CD8阳性细胞毒性T细胞,是机体对肿瘤细胞发生免疫应答的直接因素[16]。Wnt/β-catenin、TGF-β信号通路、aPKC-I/P-Sp1/Snail信号通路、B7-H1/PD-1通路和Fas/FasL信号通路均可通过增加肿瘤浸润性淋巴细胞的凋亡而参与肿瘤免疫逃逸,肿瘤浸润性淋巴细胞可检测肿瘤抗原、产生抗肿瘤免疫反应。不同胆管癌亚型的肿瘤浸润性淋巴细胞没有显著变化,这为持久抗肿瘤免疫治疗提供新方向[17]。
肿瘤的发生发展需要细胞外基质广泛重组,并通过调节信号级联反应,解除对基质细胞行为的调控,促进致癌微环境是研究焦点[18]。癌变的ECM硬度更高,异常的ECM通过直接促进细胞增殖、存活、迁移和分化影响肿瘤进展[19]。肿瘤细胞分泌含有核酸、脂肪和蛋白质的细胞外囊泡,参与肿瘤的进展和行为,如周围肿瘤微环境的重建、免疫调节或肿瘤血管生成[20]。
近年来在细胞间通讯、促进肿瘤发展中的潜在作用靶点细胞外囊泡受到极大关注[21]。胆管癌来源的细胞外囊泡通过诱导表达α-平滑肌肌动蛋白等标志物促使胆管癌间充质干细胞的迁移及多种与肿瘤进展相关的细胞因子和趋化因子的分泌[22]。细胞外囊泡介导胆管癌细胞相互作用为胆管癌治疗提供新治疗靶点。
肿瘤细胞中高表达的免疫检查点通过多种途径抑制T细胞活化以发挥抗肿瘤作用。肿瘤ICIs是通过阻断免疫抑制点的蛋白表达、恢复有效的免疫监视,抑制胆管癌的生长并清除肿瘤细胞[23]。阻断细胞毒性T淋巴细胞抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)和针对PD-1及PD-L1的相互作用是肿瘤免疫检查点阻断中研究最深入的2种方法,也可能是胆管癌患者目前最有希望的治疗选择。
PD-1是CD28大家族成员之一,通过与PD-L1和PD-L2相互作用调节T细胞活性[24]。其中,PD-L1表达于免疫系统的各种细胞表面,我国胆管癌患者中PD-L1阳性率约为35%,其表达水平与胆管癌的分期和预后密切相关[25]。与PD-L1表达阴性的肿瘤比较,PD-L1表达阳性胆管癌有更好的总生存时间和无进展生存时间[26]。
与PD-1类似,CTLA-4是存在于T细胞表面的共抑制受体。CTLA-4与CD28竞争结合抗原提呈细胞膜上表达的CD80和CD86结合,但与CD28触发作用相反,阻断此检查点对肿瘤治疗更具有吸引力[27]。最近研究结果显示:体外从高表达CTLA-4胆管癌中分离的肿瘤浸润性淋巴细胞暴露于抗CTLA-4抗体可促进T细胞成熟和激活[28]。Lim等[29]研究77例肝外胆管癌患者的临床资料,结果显示:CTLA-4高表达患者肺转移率降低,有更好预后。
免疫检查点CD40和CD40配体(CD40/CD40L)是一种共刺激分子,主要表达在T辅助淋巴细胞膜上。激活免疫检查点CD40/CD40L刺激Th1细胞因子的表达、增殖,促进M2型到M1型巨噬细胞分化[30]。Sadeghlar等[31]用CD40L腺病毒体外转化健康供者的抗原递呈细胞,并用肿瘤细胞裂解物冲击抗原递呈细胞,不仅增加CD40L的表达,还增加共刺激因子表达和Th1细胞因子和趋化因子的产生,增强细胞毒细胞对肝外胆管癌细胞株EGI-1的增殖和刺激。
1.ICIs单药治疗:关于胆管癌患者的2项Pem-brolizumab单药治疗研究(Keynote-028、Keynote-158)分别取得PD-L1阳性患者客观缓解率为13.0%(3/23,均为部分缓解)中位疾病无进展生存时间为1.8个月、中位总生存时间为5.7个月,整个队列客观缓解率为5.8%(6/104,均为部分缓解)的可喜效果[32]。美国Ⅱ期临床试验(NCT02829918)和日本Ⅰ期临床试验(JAPICCTI-153098)由胆管癌和胆囊癌患者组成的2个队列研究结果显示:不同种族和环境风险因素条件下,PD-L1表达存在差异;抗PD-1单克隆抗体Nivolumab的治疗能发挥抗肿瘤作用,持续反应时间≥1年[33, 34]。Durvalumab在治疗晚期胆管癌联合或不联合抗CTLA-4单克隆抗体Tremelimumab疾病控制率为16.7%。中位有效时间为9.7个月,中位总生存时间为8.1个月[35]。而Toripalimab单药用于可切除的肝内胆管癌的安全性和有效性正在进行Ⅰb和Ⅱ期临床试验(NCT03867370),目前还没有公布初步结果;除上述ICIs外,其他PD-L1阻断IgG1mAb(阿替唑珠单克隆抗体、Avelumab、CK-301、Cbt-502、BgB-A33)以及IgG4(BMS-936559、CS-1001、Adebrelimab)药物也在进行临床试验。但只有CBT-502(NCT03825705)、阿替唑单克隆抗体(NCT0320 1458)和阿德雷米单克隆抗体(NCT04634058)在胆管癌患者中进行了安全性和有效性测试,临床疗效还有待大样本、对照研究验证。
2.ICIs联合治疗:ICIs单药治疗在胆管癌患者已经取得一定疗效。在此基础上,多项ICIs联合或ICIs与其他类型免疫疗法的研究临床试验正在开展中[36]。CTLA-4参与早期免疫反应的调节,PD-L1主要是调节晚期外周组织的免疫反应。基于这种调节机制,将PD-1、PD-L1和CTLA-4的免疫抑制剂的组合可以使其通过互补机制发挥协同效应达到抗肿瘤治疗的目的。已有研究结果显示:CTLA-4和PD-1抑制剂的联合治疗比单一治疗更有效,可能是因为协同作用导致肿瘤浸润性淋巴细胞数量增加,调节性T细胞减少,总体上改善了对肿瘤生长的抑制,胆管癌总有效率为10.8%(7/65,均为部分缓解),疾病控制率为32.2%,总生存时间为10.1个月[37]。尽管ICIs联合治疗应用PD-1抗体+CTLA-4抑制剂临床试验中联合应用Nivolumab和CTLA-4靶向抑制剂Ipilimumab,在一组胆管癌患者中客观缓解率和疾病控制率分别进一步降低到19.2%和30.8%[38]。另外,GITR和ICIs的组合也将在不久的将来临床试验中得到评估。
胆管癌患者治疗中ICIs联合其他新辅助化疗或靶向治疗的方法是一种潜在具有前景的治疗手段。见表1。
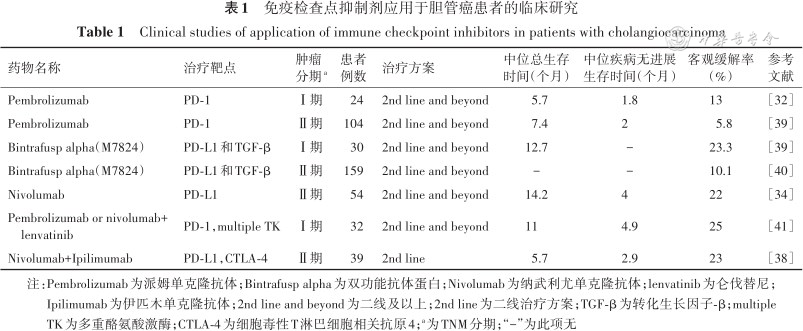
免疫检查点抑制剂应用于胆管癌患者的临床研究
Clinical studies of application of immune checkpoint inhibitors in patients with cholangiocarcinoma
免疫检查点抑制剂应用于胆管癌患者的临床研究
Clinical studies of application of immune checkpoint inhibitors in patients with cholangiocarcinoma
| 药物名称 | 治疗靶点 | 肿瘤分期a | 患者 例数 | 治疗方案 | 中位总生存 时间(个月) | 中位疾病无进展 生存时间(个月) | 客观缓解率(%) | 参考 文献 |
|---|---|---|---|---|---|---|---|---|
| Pembrolizumab | PD-1 | Ⅰ期 | 24 | 2nd line and beyond | 5.7 | 1.8 | 13 | [32] |
| Pembrolizumab | PD-1 | Ⅱ期 | 104 | 2nd line and beyond | 7.4 | 2 | 5.8 | [39] |
| Bintrafusp alpha(M7824) | PD-L1和TGF-β | Ⅰ期 | 30 | 2nd line and beyond | 12.7 | - | 23.3 | [39] |
| Bintrafusp alpha(M7824) | PD-L1和TGF-β | Ⅱ期 | 159 | 2nd line and beyond | - | - | 10.1 | [40] |
| Nivolumab | PD-L1 | Ⅱ期 | 54 | 2nd line and beyond | 14.2 | 4 | 22 | [34] |
| Pembrolizumab or nivolumab+lenvatinib | PD-1,multiple TK | Ⅰ期 | 32 | 2nd line and beyond | 11 | 4.9 | 25 | [41] |
| Nivolumab+Ipilimumab | PD-L1,CTLA-4 | Ⅱ期 | 39 | 2nd line | 5.7 | 2.9 | 23 | [38] |
注:Pembrolizumab为派姆单克隆抗体;Bintrafusp alpha为双功能抗体蛋白;Nivolumab为纳武利尤单克隆抗体;lenvatinib为仑伐替尼;Ipilimumab为伊匹木单克隆抗体;2nd line and beyond为二线及以上;2nd line为二线治疗方案;TGF-β为转化生长因子-β;multiple TK为多重酪氨酸激酶;CTLA-4为细胞毒性T淋巴细胞相关抗原4;a为TNM分期;“-”为此项无
过继细胞疗法是一种新型免疫治疗策略,其通过基因修饰T细胞表达嵌合抗原受体(chimeric antigens receptor,CAR)以增强其识别和杀伤肿瘤细胞的能力[42]。近年来,由于T细胞提取、体外扩增和活化以及基因工程技术的进步,使用CAR修饰的T细胞抗肿瘤治疗成为一种有前景的恶性肿瘤治疗方式,也成为传统疗法难以治疗的胆管癌等肿瘤患者的一种可行治疗选择。
CAR是一种既可以与抗原结合也可激活T细胞的改造。CAR-T细胞疗法在治疗部分血液恶性肿瘤中取得一定疗效,但在应用于实体肿瘤时遇到诸如缺乏有效的靶点(如CD19)和高度异质性等困难。但部分研究已经取得令人振奋的结果。Feng等[43]应用EGFR和CD133特异性CAR-T鸡尾酒序贯疗法治疗晚期不能切除的胆管癌患者先后获得8.5个月和4.5个月的部分缓解。已有研究结果显示:添加PD-1或PD-L1阻断剂可以提高CAR-T细胞在实体瘤中的抗肿瘤效果[44]。近期又有关于胆管癌的肿瘤浸润性淋巴细胞-过继细胞疗法临床研究在进行,研究结果有望在不久的将来公布。
肿瘤疫苗利用基于多肽和树突状细胞的肿瘤特异性抗原来激活T细胞,增强抗肿瘤免疫反应。疫苗治疗最常用的靶点是Wilms Tumor-1(WT-1)和Mucin-1(MUC-1),均在胆管癌中过度表达(表2)。约80%的胆管癌中发现WT1突变,而90%胆管癌中过表达MUC1,并与预后不良相关[45]。树状突细胞是专业的抗原提呈细胞,具有启动适应性免疫反应的独特能力,外周型常规树突状细胞在抗肿瘤免疫反应的激活中起关键作用,也在肿瘤周围肿瘤微环境局部起作用,在肿瘤周围肿瘤微环境中,通过产生趋化因子CXCL9和CXCL10,它们吸引富含外周型常规树突状细胞区的肿瘤浸润性T细胞,并维持局部T细胞的再刺激。一项回顾性研究中65例复发或无法切除胆管癌患者接受针对WT-1和MUC-1的树状突细胞疫苗;77%患者同时接受化疗,化疗和树状突细胞免疫治疗相结合与单独接种疫苗比较,联合治疗有更好的应答率和生存结果。作者得出结论:尽管在没有联合化疗的情况下不足以达到有意义的临床反应,但树状突细胞疫苗是安全的[46]。一项四肽疫苗疗法(HLA-A*2402限制性表位多肽)用于9例晚期和化疗耐药胆管癌患者的临床研究结果显示:7例患者出现多肽特异性T细胞免疫应答,6例患者出现临床反应;中位疾病无进展生存时间和总生存时间分别为156 d和380 d;由同一医疗单位进行的9例晚期胆管癌患者接种了包括循环相关蛋白1、钙黏附素3和激动素家族成员20A在内的三肽联合疫苗;该疫苗同样耐受性良好,9例患者出现多肽特异性T细胞反应和5例患者观察期间肿瘤没有进展[47]。尽管早期研究取得令人鼓舞的结果,但胆管癌疫苗疗法仍处于研究阶段。过继细胞疗法和肿瘤疫苗应用于胆管癌患者的主要临床研究见表2。
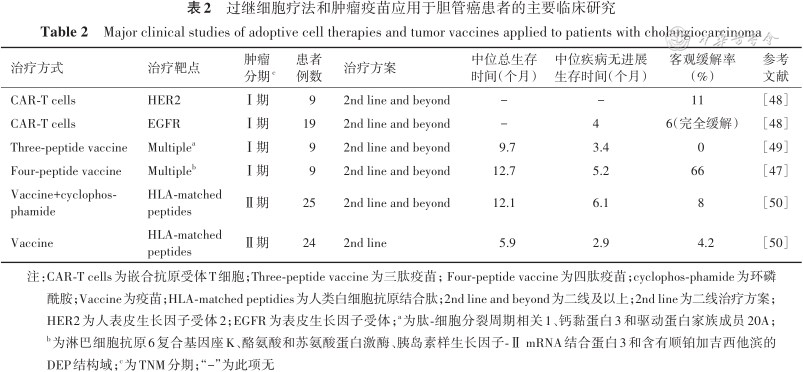
过继细胞疗法和肿瘤疫苗应用于胆管癌患者的主要临床研究
Major clinical studies of adoptive cell therapies and tumor vaccines applied to patients with cholangiocarcinoma
过继细胞疗法和肿瘤疫苗应用于胆管癌患者的主要临床研究
Major clinical studies of adoptive cell therapies and tumor vaccines applied to patients with cholangiocarcinoma
| 治疗方式 | 治疗靶点 | 肿瘤 分期c | 患者 例数 | 治疗方案 | 中位总生存时间(个月) | 中位疾病无进展生存时间(个月) | 客观缓解率 (%) | 参考 文献 |
|---|---|---|---|---|---|---|---|---|
| CAR-T cells | HER2 | Ⅰ期 | 9 | 2nd line and beyond | - | - | 11 | [48] |
| CAR-T cells | EGFR | Ⅰ期 | 19 | 2nd line and beyond | - | 4 | 6(完全缓解) | [48] |
| Three-peptide vaccine | Multiplea | Ⅰ期 | 9 | 2nd line and beyond | 9.7 | 3.4 | 0 | [49] |
| Four-peptide vaccine | Multipleb | Ⅰ期 | 9 | 2nd line and beyond | 12.7 | 5.2 | 66 | [47] |
| Vaccine+cyclophos-phamide | HLA-matched peptides | Ⅱ期 | 25 | 2nd line and beyond | 12.1 | 6.1 | 8 | [50] |
| Vaccine | HLA-matched peptides | Ⅱ期 | 24 | 2nd line | 5.9 | 2.9 | 4.2 | [50] |
注:CAR-T cells为嵌合抗原受体T细胞;Three-peptide vaccine为三肽疫苗;Four-peptide vaccine为四肽疫苗;cyclophos-phamide为环磷酰胺;Vaccine为疫苗;HLA-matched peptidies为人类白细胞抗原结合肽;2nd line and beyond为二线及以上;2nd line为二线治疗方案;HER2为人表皮生长因子受体2;EGFR为表皮生长因子受体;a为肽-细胞分裂周期相关1、钙黏蛋白3和驱动蛋白家族成员20A;b为淋巴细胞抗原6复合基因座K、酪氨酸和苏氨酸蛋白激酶、胰岛素样生长因子-Ⅱ mRNA结合蛋白3和含有顺铂加吉西他滨的DEP结构域;c为TNM分期;“-”为此项无
胆管癌特征性的免疫微环境和免疫炎症发病机制,是临床治疗策略捉襟见肘的主要原因,但也是胆管癌成为免疫疗法候选者的原因[51]。然而,免疫疗法的临床观察研究仅取得有限成功,大量核心技术和理论有待突破。过多的冗余免疫抑制信号、缺乏可靠的分层生物标志物可能是开发有效免疫疗法的最主要障碍。目前,只有抗PD-1抗体的免疫检查点疗法在Ⅱ期临床试验中产生了良好的结果,上述结果仍需大样本RCT验证。过继细胞疗法在过继转移细胞群的制备、免疫活性稳定维持、旁观者效应控制等方面仍需进一步探索。肿瘤疫苗方面更需要大量的经验累积,疫苗治疗的时机,疫苗大批量扩增、载体安全性选择、接种方案、佐剂和监测方法尚待标准化。
综上,胆管癌的免疫治疗仍处于起步阶段,个性化新抗原发现、个性化免疫疗法定制、有效性和安全性量化标准、大量基础和临床实验基础上的胆管癌免疫疗法共识和指南形成是学者们探寻的主要方向。笔者相信:不久的将来免疫治疗势必成为类似于胆管癌这样具有高度侵袭性和异质性、预后不良且发病率不断增加的恶性肿瘤患者有效、安全的治疗选择。
所有作者均声明不存在利益冲突



























