
脊索瘤好发于中轴骨,以颅底及骶尾区域最为常见,发生在其他部位较罕见。笔者报道了1例经组织病理学检查结果证实的发生在右侧鼻腔-筛窦的脊索瘤病例,分别从临床症状、术前CT及MRI影像学表现、手术所见及术后组织病理学、免疫组织化学检查结果分析了该病的特点,并通过文献复习鉴别诊断,加深了对该病的认识,为临床诊断及治疗方式提供有价值的参考。

版权归中华医学会所有。
未经授权,不得转载、摘编本刊文章,不得使用本刊的版式设计。
除非特别声明,本刊刊出的所有文章不代表中华医学会和本刊编委会的观点。
脊索瘤起源于原始胚胎脊索组织,好发于人体中轴骨,尤其是颅底及骶尾的区域。笔者报道了1例发生于右侧鼻腔-筛窦的脊索瘤,旨在增加对发生在罕见部位脊索瘤的认识,为临床治疗提供参考。
患者女性,49岁,因"右侧鼻反复鼻塞流涕3个月"入院就诊,入院后自诉3个月前出现无明显诱因的鼻塞,偶伴右侧鼻流涕,为清亮液体,未予重视,自感右侧鼻鼻塞逐渐加重,伴右眼胀痛感,发病以来体重无明显下降。专科检查外鼻无畸形,鼻腔黏膜充血,鼻腔内可见黏性涕。双侧下鼻甲肥厚,无苍白,右侧鼻腔中鼻道可见粉红色肿物堵塞,表面尚光滑,右侧鼻腔余结构未窥清,左侧中鼻道未见分泌物及新生物,鼻中隔基本居中,两侧鼻旁窦区无压痛。实验室检查(血常规、大小便常规、肝肾功能等)均未发现异常。
鼻窦CT平扫(图1A、图1B)示右侧鼻腔-筛窦内见团块状软组织密度影,大小为3.0 cm×4.9 cm×4.2 cm,密度不均匀,边界尚清,其内可见小斑片状稍高密度影,边缘见结节状钙化灶,右侧上颌窦、筛窦及鼻腔内骨质破坏、吸收,鼻中隔受推压向左侧偏移,双侧下鼻甲肥大。鼻窦MRI示右侧鼻腔-筛窦内可见团块状信号异常灶,大小为3.0 cm×4.9 cm×4.2 cm,T1加权成像(T1 weighted image,T1WI)横断面图像(图1C)示病灶与邻近肌肉信号相仿,内见小斑片状稍高信号,T2加权成像(T2 weighted image,T2WI)横断面图像(图1D)和T2压脂序列矢状面图像(图1E)示病灶呈混杂高信号,内见斑片状低信号。MRI增强扫描(图1F、图1G、图1H)示病灶呈明显不均匀强化,肿物呈膨胀样生长,邻近右侧眼眶的内侧壁、中鼻甲受压偏移。肿物阻塞右侧额窦、筛窦、蝶窦及上颌窦开口,窦腔内可见斑片状T2WI高信号,右侧眼内直肌未见肿物侵犯征象。左侧上鼻道内见斑片状异常信号,T1WI和T2WI呈低信号,大小为1.1 cm×1.0 cm×1.1 cm,双下鼻甲肥大。
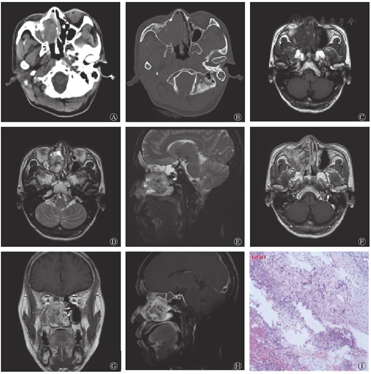

行鼻内镜下右侧鼻腔鼻窦肿物切除术+右侧全组鼻窦开放术,术中见右侧中鼻甲大部分已被吸收,左侧下鼻甲上缘、中鼻道有粉红色新生物。肿物侵犯颅底,颅底骨质尚完整,右侧纸样板已吸收,右侧眼眶筋膜尚完整,右侧上颌窦内侧壁已完全被吸收。手术过程顺利开放右侧全组鼻窦,完整切除病变组织,右侧鼻腔可见灰白色软组织颗粒,行组织病理学检查。组织病理学检查结果诊断为右侧鼻腔肿物,符合脊索瘤的特征(图1I)。免疫组织化学检测结果:胎盘碱性磷酸酶(PLAP,-)、波形蛋白(Vimentin,+)、胶质纤维酸性蛋白(GFAP,-)、P63(-)、酸性钙结合蛋白(S-100,-)、神经特异性烯醇化酶(NSE,-)、肌酸激酶(CK,-)、平滑肌肌动蛋白(SMA,灶性+)、细胞增殖核抗原Ki67(10%+)、CD56(+)、P53(60%+)、CD34(血管+)、上皮膜抗原(EMA,-)、CK8(-)、Desmin(-)、孕激素受体(PR,-)、突角素(Syn,-)、嗜铬粒蛋白A(CgA,-)、白细胞共同抗原(LCA,灶状+)、CD3(小灶状+)、CD5(小灶状+)、CD20(-),糖原(PAS)特殊染色(+)。
脊索瘤是罕见的恶性肿瘤,多局限在轴向骨骼中,从脊骨到尾骨均可发生。脊索瘤生长缓慢,并呈浸润性生长,对局部骨质具有破坏倾向,在发现并诊断时,大部分已经出现骨质破坏[1,2]。有少数报道显示脊索瘤具有家族遗传模式,表现为常染色体显性遗传[3]。其最常发生的部位为骶尾区(50%),其次是颅底(30%)、脊柱和其他部位(20%)。脊索瘤的年发病率为0.08/10万人,发病年龄以50~60岁为主,很少发生在儿童和青少年中(<5%),男女发病比例为2∶1[4],其临床症状主要表现为软组织肿块,并有邻近的骨质破坏[5]。国内外已有诸多文献报道了好发于骶尾区和颅底区脊索瘤的影像学特征,研究鼻腔和鼻窦原发性脊索瘤影像学特征的文献较少,本病例为右侧筛窦-鼻腔原发性脊索瘤,属于罕见发病部位。
脊索瘤的影像学特点如下。(1)密度及信号:肿瘤密度不均匀,CT显示病灶内可见斑块样不规则高密度钙化影。MRI T1WI呈中等信号,T1WI呈小灶性高信号影提示病灶内有出血或黏液、胶样物质成分,这些成分的多样性可以解释T2WI肿瘤呈现高信号特征的原因,在弥散加权图像上,肿瘤呈弥散受限高信号影。(2)骨质破坏:脊索瘤对周围骨质呈溶骨性破坏,CT在评估肿瘤内的钙化方面优于MRI。(3)增强扫描:肿瘤呈不均匀轻中度强化,内部坏死部分不强化,T2压脂序列有助于肿瘤与邻近组织的区分。将CT和MRI相结合可以获得临床诊断和临床预处理评估的理想效果。
鼻腔内翻性乳头状瘤是鼻腔及鼻窦最常见的良性肿瘤之一,多见于中鼻道鼻腔外侧壁,其最显著的特征是具有侵袭性、高复发性及多中心性,好发于中老年男性[6,7]。CT检查能够显示肿瘤骨质的破坏情况,病灶内钙化少见[8]。MRI检查可以分辨出肿瘤软组织及其内部情况,积液、囊变的T1WI呈低信号,T2WI呈高信号,增强扫描后不强化;病灶内出血通常在T1WI呈高信号影;MRI增强扫描表现为特征性脑回样的强化方式[9]。鼻咽纤维血管瘤是一种纤维血管性、局部侵袭性、高复发率的良性肿瘤,好发于青少年男性,肿瘤起源于枕骨斜坡底部、蝶骨体及翼突内侧的骨膜,也有文献报道其起源于鼻后腔和鼻咽,约90%的肿瘤侵犯翼腭窝,还可累及鼻腔、上颌窦、筛窦和颅底等邻近结构[10,11]。肿瘤以翼腭窝为中心向周围多个间隙侵犯,向前累及后鼻道与鼻腔。CT平扫显示肿瘤与邻近肌肉的密度相近;肿瘤T1WI呈等或稍低信号,T2WI呈高信号,肿瘤内部及周围有时可见血管流空信号,MRI增强扫描呈明显均匀强化[12];CT血管造影(CTA)显示肿瘤的主要供血动脉来自上颌内动脉,即颈外动脉的分支[13]。鼻腔-鼻旁窦恶性肿瘤最好发于鼻腔中,鳞状细胞癌是其最常见的组织病理学亚型,占所有鼻窦恶性肿瘤的一半以上,好发于中老年男性[14,15]。CT检查肿瘤内可见钙化及邻近窦壁和鼻甲不规则侵蚀性骨质破坏,肿瘤内坏死是鼻窦鳞状细胞癌的特征之一。肿瘤通常在T2WI呈非特异性高信号,T1WI呈低至等信号,坏死部分在T1WI呈低信号,在T2WI呈高信号;肿瘤内的T1WI高信号表明存在出血、高铁血红蛋白、黑色素、脂质、蛋白质和矿物质等。MRI弥散加权图像中肿瘤弥散受限,MRI增强扫描呈明显不均匀强化,内部无强化坏死区[15,16]。淋巴瘤是仅次于鳞状细胞癌的鼻窦第二常见的原发性恶性肿瘤,好发于中老年男性,发病部位最常见于上颌窦[17]。鼻腔鼻窦淋巴瘤通常表现为不规则的软组织肿块,并有不同程度的侵蚀性骨质吸收、破坏,并可以通过窦壁侵犯周围邻近结构,部分骨质吸收也可能伴有骨质硬化[15]。鼻腔鼻窦淋巴瘤在T1WI上呈等信号,T2WI上呈高信号,MRI增强扫描可见明显的均匀强化,肿瘤内少见坏死,弥散加权图像中肿瘤弥散受限。有文献报道鼻腔鼻窦淋巴瘤的表观扩散系数值(0.61×10-3 mm2/s)比鼻窦鳞状细胞癌的表观扩散系数值(0.95×10-3 mm2/s)小[17,18],这表明淋巴瘤细胞增多,可以与其他肿瘤相鉴别。
本病例属于少见肿瘤的罕见发病部位,需结合临床及影像学资料联合诊断,明确诊断还需经组织病理学检查,穿刺活检操作简单,且局部损伤小,可反复检查。对于该病应掌握肿瘤的起源部位、侵犯范围、周围骨质的破坏情况、肿瘤血供、肿瘤内部是否出血或坏死、与邻近周围组织的关系等表现,可在术前为临床提供参考信息,制定合理的手术方案。
所有作者声明无利益冲突



























